银杏叶提取物对内毒素致大鼠肺动脉内皮细胞损伤的保护作用*
2012-01-12王桂成
王桂成 刘 岩
(泰山医学院附属泰山医院老年科一科,山东 泰安 271000)
目前中国已进入老龄化社会,老年人发生院内和院外感染的几率增加,引起老年人感染尤其是院内感染的主要致病菌是G-杆菌,由G-杆菌产生的内毒素脂多糖(LPS)所造成的血管内皮细胞的损伤能够加重器官功能的衰竭。其中肺血管内皮细胞损伤是LPS导致急性肺损伤(ALI)的关键环节[1]。银杏叶提取物(gingko biloba extrac,GbE)是一种广泛用于治疗心脑血管疾病的中成药。GbE中黄酮类化合物、银杏内酯和白果内酯以及银杏根中的提取物银杏内酯M均有清除自由基作用如O2-、·OH等[2]。并且有研究[3]表明银杏叶提取物能够缓解由于过氧化氢所导致的内皮细胞凋亡。本研究以大鼠肺动脉内皮细胞( pulmonary artery endothelial cells,PAECs)为研究对象,通过LPS制备细胞损伤模型,GbE进行药物干预以探讨GbE在LPS介导的RPAECs损伤的保护作用。
1 材料与方法
1.1实验动物 Wistar大鼠,清洁级,雌雄不拘,体重300~350 g,购于山东中医药大学动物实验室。在泰安市中心医院中心实验室标准饲料喂养,自由取水。
1.2检测所需试剂及试剂盒 LPS(Sigma产品)、GbE(北京双鹤药业)、MDA、LDH、SOD试剂盒(南京建成);兔抗人Ⅷ因子相关抗原抗血清(DAKO产品),华美分装、FITC标记羊抗兔IgG,FITC标记羊抗小鼠IgG(中杉金桥)、小鼠抗硝基洛氨酸单克隆抗体(Cayman)。
1.3主要仪器及器材 流式细胞仪(FACS Calibur, BD公司),普通倒置光学显微镜(Olympus IX70);荧光显微镜(Olympus、日本);酶标仪(Bio-R9d 550,美国);722分光光度计等。
1.4实验方法
1.4.1PAECs的原代培养[4]10%乌拉坦按10 μl/g腹腔注射麻醉大鼠。碘伏常规消毒,打开胸腔,取下完整的心肺组织,暴露其肺动脉。眼科剪将肺动脉剪成大小约1 mm×1 mm的组织块,以其内膜面贴于用明胶包被过的六孔板上。放于5%、37 ℃CO2培养箱干涸2小时后每孔加入RPIM-1640培养液约3 ml,放回CO2培养箱培养,48小时后去除肺动脉组织块即可见到有一定数量的细胞生长。
1.4.2PAECs的鉴定 倒置显微镜下细胞形态的观察;免疫荧光染色:细胞涂片后甲醛固定,一抗为兔抗人Ⅷ因子相关抗原抗血清,稀释200倍后,铺满整个载玻片,置于4 ℃冰箱过夜。加入按1︰8稀释的二抗FITC标记的羊抗兔IgG,铺满整个载玻片,避光30分钟,置于荧光显微镜下观察。阴性对照片一抗用PBS代替,余步骤同前。
1.4.3实验分组 将细胞随机分成三组,其中药物干预组每组设三个水平,具体分组情况如下:①对照组,②LPS组(1 μg/ml),③GbEⅠ组(10 μg/ml),GbEⅡ组(50 μg/ml),GbEⅢ组(100 μg/ml)。除空白对照组外其余各组均加入LPS最终浓度为1 μg/ml,与细胞共同孵育24 h后待检。
1.4.4各项指标的检测 严格按照操作说明书进行SOD、LDH、MDA、IL-8的检测。流式细胞仪检测细胞中NT%[1]。

2 结 果
21PAECs原代培养与鉴定 倒置显微镜下贴壁细胞呈多角形、梭形或不规则型(图1)。融合成片的细胞呈铺路石样、镶嵌状、漩涡状排列(图2)。免疫荧光染色PAECs呈明亮的黄绿色荧光(图3)。阴性对照未出现黄绿色荧光(图4)。
图1 肺动脉块植入后72小时可见有细胞爬出(×100 )

图2 细胞培养5天后细胞呈现鹅卵石样排列(×100)

图3 细胞荧光染色:PAECs呈现明亮黄绿色荧光(×100)

图4 细胞荧光染色阴性对照
2.2LDH、SOD、MDA检测结果 见表1。

表1 各组LDH、SOD、MDA检测结果
注:*为对照组、GbE组中、高药物浓度水平与LPS组相比较LDH、MDA明显降低,#SOD明显升高,P均<0.05。
2.3各组间IL-8结果比较 如图5。

图5 各组间IL-8结果比较
注:*表示与LPS组和对照组相比,P<0.05。
2.4各组间NT%的比较 如图6
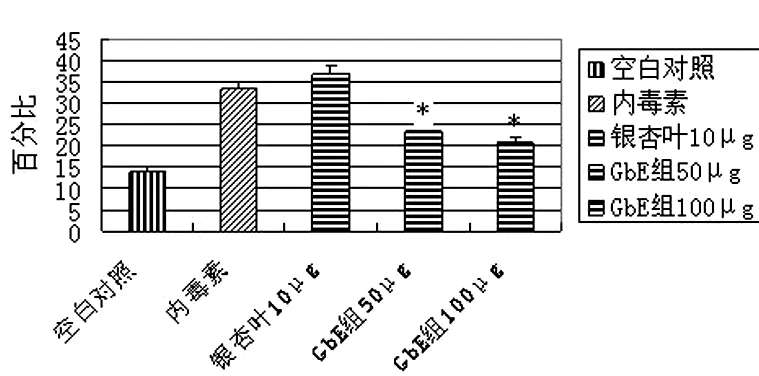
图6 各组间NT%的比较
注:*代表与LPS组相比较,P<0.05。
3 讨 论
PAECs由于其特殊的解剖位置在肺部疾病以及心脏病的发病及发展过程中有至关重要的作用,因此研究肺动脉血管内皮细胞的损伤与保护具有极其重要的意义。在引起PAECs损伤的原因中活性氧物质的作用越来越受到重视,它的强氧化作用是造成细胞损伤的一个基本环节。PAECs内既存有结构型NO合酶基因,又有诱导型NOS基因分布。在LPS 作用下诱导型NO合酶基因表达增加使NO大量生成,而使肺血管内皮细胞损伤、脱落[5]。在LPS损伤PAECs的过程中LPS首先与内毒素结合蛋白(LBP)结合,由于内皮细胞是膜结合CD14阴性细胞,因此LBP将LPS以单体的形式转运到可溶性CD14,在其辅助下直接作用于内皮细胞膜上的特殊受体激活细胞。近几年来已经证实这种特殊受体是膜蛋白TLR4,最终激活核因子κB (NF-κB)从而调节相关基因转录,使内皮细胞产生大量的炎性介质和细胞因子[6],如NO等。NO与细胞代谢过程中生成的O2-迅速反应生成ONOO-,后者具有强氧化性,能够导致酶类、线粒体、DNA以及细胞膜的损伤。
GbE的主要成分从银杏叶中提取出来被广泛应用于治疗心脑血管疾病。它的主要有效成分包括银杏黄酮、银杏内酯和白果内酯等。有资料[7]报道GbE具有明显的抗氧化作用,是一种广谱的自由基清除剂,它含有多种黄酮,如山奈酚和皮质素均能捕捉和清除超氧自由基包括O2-、·OH、NO等。通过测定未反应的超氧阴离子及其清除程度来测定SOD活性,证明GbE有直接清除O2-,即GbE具有SOD的作用。本研究中, GbE组各药物浓度水平干预后的细胞培养上清中MDA、LDH含量较LPS组显著降低,SOD明显上升(P均<0.05),说明GbE能够起到抗氧化、清除自由基的作用。GbE组IL-8明显降低,说明GbE能够显著降低细胞的炎性反应,减轻细胞损伤,GbE组中NT%较LPS组明显降低(P<0.05),说明GbE显著降低了由于LPS导致的ONOO-的生成,间接反映了NO的生成减少,ONOO-的生成减少能够降低它的强氧化性,从而有效的保护内皮细胞。
综上所述,应用GbE进行药物干预能够降低由LPS介导的大鼠肺动脉内皮细胞的损伤,这种保护主要是通过GbE通过抑制NO的生成、清除氧自由基,而起到抗氧化作用。本研究为临床内毒素损伤内皮细胞问题提供了新的治疗思路。
[1] 谷振勇,凌亦凌.肺动脉内皮细胞生成过氧亚硝基阴离子的意义[J].中国应用生理学杂志,2009,17(4):125-128.
[2] Tapping RI, Gegner JA, Kravchenk VV, et al. Antagonistic effects of extract from leaves of Ginkgo biloba on glutamate neurotoxicity [J].Prog Clin BiolRes, 2008:156-158.
[3] Da Silva Correia J, Uleritch RJ. MD-2 and TLR4 N-linked glycosylations are important for a functional lipopolysaccharide receptor [J]. J Biol Chem, 2007, 277(3): 1845-1847.
[4] Ozinsky A, Underhill DM, Fontenot JD, et al. The repertoire for pattern recognition of pathogens by the innate immune system is defined by cooperation between toll like receptors [J].Proc Natl Acad Sci USA, 2010, 97 (25): 13766-13771.
[5] 周卫东,章如新,李兆基,等.豚鼠鼻粘膜一氧化氮合酶表达[J].中华耳鼻咽喉科杂志,2001,36(1):64-65.
[6] Da Silva Correia J, Uleritch RJ.MD-2 and TLR4 N-linked glycosylations are important for a functional lipopolysaccharide receptor[J] .J Biol Chem, 2009, 277(3):1845-1847.
[7] Packer L. Antioxidant action of Ginkgo biloba extract (EGb 761)[J]. Food Free Radicals, 2006, 21(5): 75-78.
