S100A4和缺氧诱导因子-1α在胃癌中的表达及意义*
2012-01-12逄小红郭静芹
逄小红 郭静芹
(1.泰山医学院人体解剖学教研室,山东 泰安 271016; 2.泰山护理职业学院,山东 泰安 271000)
缺氧诱导因子-1α(HIF-1α)是一种在缺氧状态下发挥活性的核转录因子。 研究[1-2]证实,HIF-1α可调控包括血管内皮生长因子(vasular endothelial growth factor,VEGF)在内的众多促血管生长因子的生成以及肿瘤转移相关蛋白的表达。S100A4是Ca2+结合蛋白S100家族的成员之一,可降低细胞间黏附能力、促进细胞外基质水解和重塑、增加肿瘤细胞运动能力、促进血管生成等,在肿瘤侵袭转移过程中发挥关键性作用[3-5]。作为肿瘤转移相关基因的S100A4是否受HIF-1α调控,相关的报道很少。我们采用手术新鲜标本在mRNA及蛋白质水平检测HIF-1α和S100A4在胃癌中的表达情况,分析其与胃癌临床病理特征的关系以及二者之间的相互联系,旨在探讨HIF-1α和S100A4在胃癌中的表达及其临床意义。
1 对象与方法
1.1对象 胃腺癌手术标本45例,男25例,女20例,年龄29~65岁,中位年龄52岁。采集方法:同一患者胃癌组织及切端未被损毁正常组织均于术后半小时内采集,新采标本由乙二基焦磷酰胺处理,冻存管分装,液氮运送并立即冻存于-80℃冰箱待用。标本性质均经术后病理证实。
1.2方法
1.2.1主要试剂 Trizol购于美国Gibco BRL 公司,逆转录试剂盒购于日本Takara公司,PCR试剂盒购于大连宝生物工程有限公司。小鼠抗人HIF-1α单克隆抗体购于美国Lab Vision公司,兔抗人S100A4多克隆抗体购于Neo Marker公司,SP免疫组化试剂盒、DAB显色试剂盒均购于北京中山生物技术有限公司。
1.2.2RNA提取 按照Trizol试剂说明书操作。测定RNA浓度及吸光度(A)值,A值在1.8~2.0之间,并经1%甲醛琼脂糖变性凝胶电泳观察RNA质量以检测其完整性。
1.2.3RT-PCR 逆转录。每20 μl逆转录体系加入总RNA 1 μg,合成cDNA第1链,反应条件为30℃ 10 min,42℃ 30 min,95℃ 5 min,5℃ 5 min。HIF-1α、S100A4和β-肌动蛋白内参照引物序列及退火温度见表1。反应条件:94℃60 s,55℃ 50 s,72℃ 60 s,共35个循环。产物直接在 1.5%琼脂糖凝胶中(含溴化乙锭)电泳,紫外灯下观察目的条带,采用IBAS2.0Kontron真彩图像分析仪对条带灰度值进行扫描分析。

表1 扩增基因、引物、扩增片段大小及退火温度
1.2.4免疫组化染色和判断标准 操作步骤按免疫组化试剂盒说明进行。以枸橼酸抗原修复液进行抗原修复,DAB显色,苏木精复染,明胶甘油封片。用PBS代替一抗作为阴性对照,用已知的结肠癌阳性片作为阳性对照。HIF-1α和S100A4均以细胞质和(或)细胞核出现棕黄色或棕褐色颗粒为阳性。首先按染色强度评分:无色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分;然后按阳性细胞率评分:肿瘤细胞内无阳性染色者为0分,阳性细胞率≤10%为1分,11%~50%为2分,51%~75%为3分,>75%为4分。两者乘积≤2分为免疫组化反应阴性,≥3分为阳性。
1.2.5统计学分析 癌组织和正常组织mRNA表达比较用Studentt检验,癌组织和正常组织蛋白质表达比较用χ2检验。HIF-1α和S100A4相关性分析采用χ2关联性分析。全部数据采用SPSS13.0统计分析软件,P≤0.05为差异有统计学意义。
2 结 果
2.1胃癌组织和切端正常胃黏膜组织HIF-1α和S100A4 mRNA表达情况 切端正常胃黏膜组织未见HIF-1α和 HIF-1α mRNA的表达。在胃癌组织中HIF-1α mRNA扩增产物电泳条带位于168 bp位置,S100A4 mRNA扩增产物电泳条带位于 340 bp位置,β-肌动蛋白mRNA扩增产物电泳条带位于513 bp位置。扩增结果经凝胶灰度扫描进行定量分析,胃癌组织HIF-1α mRNA的相对含量为0.5207±0.0375,S100A4 mRNA的相对含量为0.6493±0.0300。
2.2胃癌组织和切端正常胃黏膜组织HIF-1α和S100A4 蛋白质表达情况 HIF-1α蛋白在切端正常胃黏膜组织无表达,在胃癌组织胞核与胞质均有表达,核强于胞质(图1)。胃癌组织中HIF-1α蛋白阳性率为60%(27/45)。S100A4蛋白在正常胃黏膜中几乎无表达,在胃癌组织中有中等强度的胞质着色,偶见胞核着色,血管平滑肌细胞和间质细胞也有着色(图2)。S100A4在胃癌组织中的阳性率为48.9%(22/45)。

图1 HIF-1α蛋白在胃癌组织中阳性表达(SP×200)
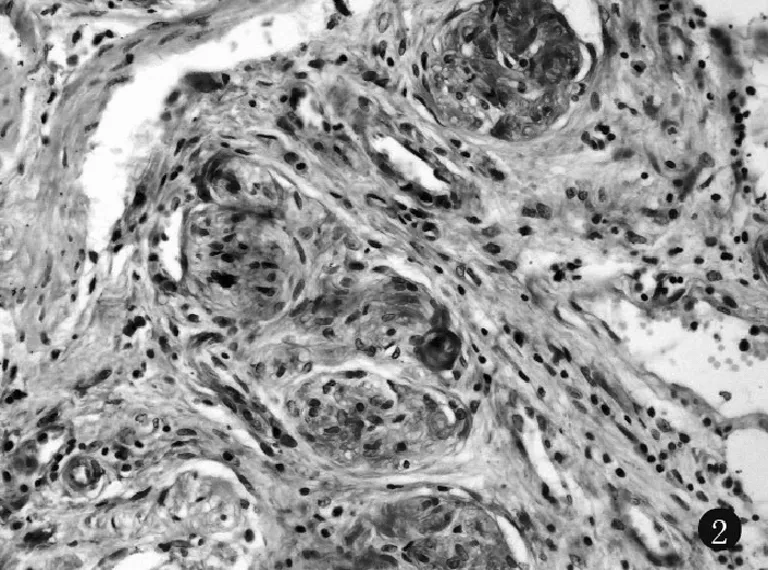
图2 S100A4蛋白在胃癌组织中阳性表达(SP×200)
2.3临床病理关系研究
2.3.1HIF-1α和S100A4 mRNA与临床病理关系 HIF-1α和S100A4 mRNA表达与肿瘤淋巴结转移及临床病理分期有关,其表达水平随淋巴结转移和临床病理分期的升高而增高,差异有统计学意义(P﹤0.05,P﹤0.01)。没有发现两者mRNA与其他临床病理因素有联系(表2)。
2.3.2HIF-1α和S100A4蛋白与临床病理关系 HIF-1α和S100A4蛋白表达与肿瘤淋巴结转移、浸润深度和临床病理分期有关,其表达水平随淋巴结转移、浸润层次的深入和临床病理分期的升高而增高,差异有统计学意义(P均﹤0.05)。HIF-1α和S100A4表达与肿瘤组织学分级无关(表3)。
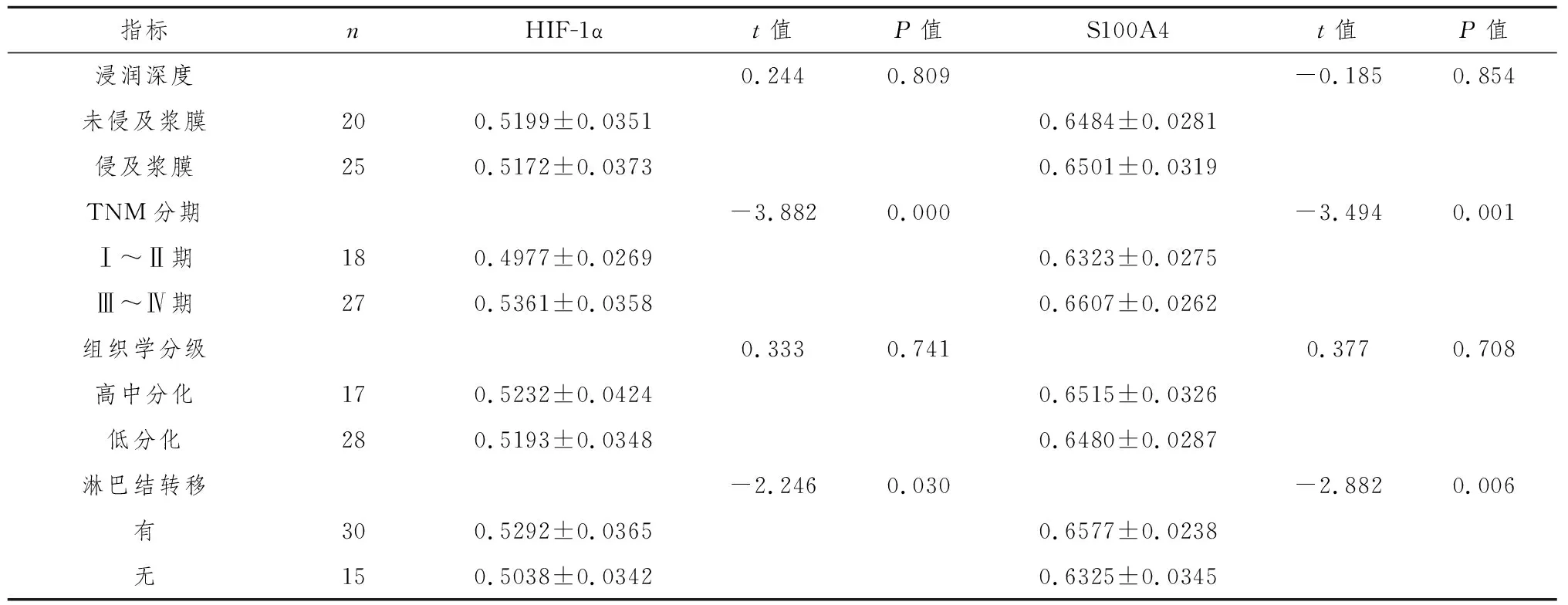
表2 HIF-1α和S100A4 mRNA与胃癌临床病理关系

表3 HIF-1α和S100A4蛋白与胃癌临床病理关系
2.4胃癌组织中HIF-1α表达和S100A4表达的关系 对HIF-1α和S100A4 mRNA进行相关性分析,相关系数r=0.971,P=0.000,两者表达呈正相关。HIF-1α蛋白和S100A4蛋白表达亦呈正相关关系(r=0.345,P=0.020,表4)。

表4 胃癌组织HIF-1α与S100A4蛋白表达的关系
3 讨 论
HIF-1是由α和β亚基组成的异二聚体核转录因子,其中HIF-1α是HIF的调节亚基和功能亚基,决定HIF的活性。近年来的研究[6-8]发现,HIF-1α在人类多种肿瘤中高表达,而且HIF-1α的高表达既是反映肿瘤组织缺氧的指标,也是肿瘤预后不良的标志,与肿瘤的临床恶性进程存在明显正相关,而与治疗敏感性、患者生存率存在负相关。本研究发现HIF-1α蛋白在切端正常胃黏膜组织无表达,在胃癌组织胞核与胞质均有表达,且HIF-1α的表达水平随肿瘤淋巴结转移、浸润深度和临床病理分期的升高而增高,说明HIF-1α的表达与肿瘤的关系密切。HIF-1α高表达的原因,一方面考虑由于癌组织生长过快,血供不足造成的缺氧状态,使蛋白酶体介导的HIF-1α的降解途径被阻断所致。同时,与肿瘤发生、发展有关的癌基因、转录共激活因子p300、NO等诸多物质构成的信号通路亦可刺激HIF-1α 的活化,增加HIF-1α mRNA和蛋白质表达水平[9]。
S100A4蛋白与其它21个成员共同组成钙离子结合蛋白S100家族,通过钙离子信号转导途径在细胞增殖、分化,肌肉收缩,基因表达、分泌及细胞凋亡中发挥重要作用。近年来诸多研究[3-5]表明,S100A4蛋白的表达与肿瘤的发生、发展和侵袭转移有关。本研究结果显示,胃癌组织中S100A4的阳性表达率为48.9%,在正常胃黏膜中几乎无表达。S100A4的表达与肿瘤淋巴结转移、浸润深度和临床病理分期有关,即在淋巴结转移组中显著高于无转移组,在浸润侵及浆膜组显著高于未侵及浆膜组,在临床分期中,随临床分期的升高而明显增加,即分期越晚,S100A4的阳性率越高,提示S100A4蛋白参与胃癌的发生及发展,与胃癌的侵袭和转移密切相关,可以用于评估病情。
本研究还发现胃癌组织中HIF-1α和S100A4 mRNA表达高于切端正常胃黏膜组织,HIF-1α和S100A4 mRNA表达与肿瘤淋巴结转移及临床病理分期有关,而与肿瘤浸润深度无关,这可能与HIF-1α和S100A4转录后的调节有关。
本研究结果显示, 胃癌组织中HIF-1α和S100A4的表达在mRNA和蛋白质水平均呈正相关关系, 表明二者在生化水平上存在一定的关联,在功能上可能存在相互作用机制。滑君等[10]应用低氧模拟剂氯化钴处理胃癌细胞BGC823,结果发现经氯化钴处理后, 胃癌细胞S100A4 mRNA 及蛋白表达明显增加,提示低氧模拟剂氯化钴可促进胃癌细胞BGC823 中S100A4 基因表达。Zhang R等[11]在随后的研究中应用生物信息学软件预测到S100A4基因的内含子存在低氧反应元件(hypoxia responsive element, HRE),并且发现HIF-1可以与HRE结合,提示S100A4是低氧诱导基因,它的转录至少部分是通过HIF-1和HRE结合后激活的。因此推测HIF-1α和S100A4关系的机制可能为:随着肿瘤的不断生长、体积增大,血供不足产生缺氧微环境,诱导HIF-1α过度表达。HIF-1α转移入胞核后与HIF-1β形成异二聚体,与S100A4 HRE结合,启动S100A4的转录,使S100A4表达上调。
通过以上研究表明,HIF-1α与S100A4过表达可能是胃癌发生和进展过程中的重要分子事件,与肿瘤的生物学行为密切相关,在一定程度上体现肿瘤的恶性潜能。因此,HIF-1α与S100A4可能作为肿瘤诊断和进展的生物学指标,成为基因治疗以及免疫治疗的靶点,具有重要的基础和临床意义。
[1] Semenza GL. HIF-1 and tumor progression:pathophysiology and therapeutics[J].Trends Mol Med, 2002,8(4 Suppl):S62-67.
[2] Mottet D, Ruys SP, Demazy C, et al. Role for casein kinase 2 in the regulation of HIF-1 activity[J]. Int J Cancer,2005,117:764-774.
[3] Mazzuccheli L. Protein S100A4: too long overlooked by pathologists[J]. Am J Pathol, 2002, 160(1): 7-13.
[4] Jenkinson SR, Barraclough R, West CR, et al.S100A4 regulates cell motility and invasion in an in vitro model for breast cancer metastasis[J]. Br J Cancer, 2004, 90(1): 253-262.
[5] Grigorian M, Andresen S, Tulchinskyn E, et al. Tumor suppressor p53 protein is a new target for the metastasis-associated Mts1/S100A4 protein: functional consequences of their interaction[J]. J Biol Chem, 2001, 276(25): 22699-22708.
[6] Zhong H, De Marzo AM, Laughner E, et al. Overexpression of hypoxia inducible factor 1alpha in common human cancers and their metastases [J].Cancer Res, 1999, 59(22):5830-5835.
[7] Kimura S, Kitadai Y, Tanaka S, et al.Hypoxia-inducible factor-1α expression in the gastric carcinogenesis sequence and its prognostic role in gastric and gastro-oesophageal adenocarcinomas [J].Br J Cancer, 2007,96(1): 95-103.
[8] Rohwer N, Lobitz S, Daskalow K,et al. HIF-1alpha determines the metastatic potential of gastric cancer cells[J].Br J Cancer, 2009,100(5):772-781.
[9] Bárdos JI, Ashcroft M. Negative and positive regulation of HIF-1: a complex network[J]. Bioch Biophy Acta, 2005,1755(2):107-120.
[10] 滑君,付浩,张瑞秀,等. 低氧模拟剂氯化钴对胃癌细胞BGC823中S100A4基因表达的影响[J].遗传,2008,30(12):1563-1566.
[11] Zhang R, Fu H, Chen D,et al. Subcellular distribution of S100A4 and its transcriptional regulation under hypoxic conditions in gastric cancer cell line BGC823[J]. Cancer Sci, 2010,101(5):1141-1146.
