棕色脂肪组织与肥胖症药物治疗的新靶点
2012-01-12张玉彬
钱 杰, 张玉彬
(中国药科大学生命科学与技术学院,江苏南京210009)
目前,肥胖症正在成为一种全球性疾病,其可引发代谢综合征,严重影响人类健康。而曾获准用于治疗肥胖的药物西布曲明(sibutramine)和奥利司他(orlistat)均存在严重的副作用,前者已遭退市,后者市场前景亦堪忧[1],因此,临床上迫切需要有新的减肥药物。
近年来人们对脂肪组织分化形成机制的认识和了解逐步深入,为开发减肥药物提供了新目标,而基于棕色脂肪组织的抗肥胖药物研究便是其中一例。
1 棕色脂肪组织及其作用
哺乳动物体内存在2种类型的脂肪组织:白色脂肪组织(white adipose tissue,WAT)和棕色脂肪组织(brown adipose tissue,BAT)。其中,WAT占正常健康成人体质量的10%,主要功能是储存脂肪以作为人体能源库和皮下隔热垫。现代医学发现其还是肥胖患者体内一个重要的炎症源,可分泌多种前炎性因子,加剧胰岛素抵抗。BAT则是体内重要产热组织,通过消耗脂肪产热,维持体温以适应环境,这在啮齿类动物及婴儿身上尤为明显。
BAT由棕色脂肪细胞,以及丰富的血管、神经和脂肪组织来源的基质细胞(adipose tissue-derived stromal cell,ADSC)组成。其主要成分棕色脂肪细胞本身具有非常特殊的细胞结构,细胞中脂肪通常以多个小脂肪滴的方式储存三酰甘油酯(TG),而在白色脂肪细胞中则以大脂肪滴的形式储存。此外,棕色脂肪细胞富含线粒体,其线粒体含量远远超过白色脂肪细胞,且线粒体内膜上存在特有的解偶联蛋白-1(uncoupling protein-1,UCP-1),后者可将内膜间隙的大量质子转入线粒体基质,使氧化磷酸化作用解偶联,从而降低线粒体膜电位,提高线粒体电子转运率,最终导致产热和大量化学能的消耗[2]。
长期以来,人们一直认为人类在出生后不久其体内的BAT便逐渐消失。然而,现代磁共振技术证实BAT仍存在于正常成人体内,且其在肥胖患者体内的活性随肥胖程度增加而降低[3],因此,人们正试图通过增加体内BAT数量和提高BAT活性或使WAT具有BAT产热特性,从而消耗肥胖患者体内多余脂肪来发挥减肥作用。
2 基于棕色脂肪组织的抗肥胖药物及作用靶点
棕色脂肪细胞和白色脂肪细胞由前脂肪细胞通过不同途径分化而成。大量细胞培养及体内研究已揭示了控制前脂肪细胞分化为白色脂肪细胞过程的分子途径[4],有关棕色脂肪细胞的分化研究则相对滞后。研究发现,过氧化物酶体增殖物激活受体-γ (peroxisome proliferator-activated receptor-γ,PPARγ)作为核受体超家族的一员,可与棕色脂肪细胞分化过程中关键调控因子结合发挥其促分化作用,在棕色脂肪细胞的分化过程中扮演着重要角色[5]。而转录因子C/EBP家族的成员——CCAAT/增强子结合蛋白α、β和δ(C/EBPα、C/EBPβ和C/EBPδ)参与激活和维持包括PPARγ在内的脂肪形成诱导基因的表达[6]。近年来又有研究发现,PPARγ辅激活因子-1α(peroxisome proliferator-activated receptor gamma coactivator-1α,PGC-1α)、锌指蛋白PRDM16和胎盘特异性蛋白 8(placenta specific 8,Plac8)等[7-8]均参与了棕色脂肪细胞的分化成熟过程(见图1[9]),因此,这些位点均有望成为肥胖症药物治疗的新靶点。

图1 PRDM 16介导的棕色脂肪细胞的分化过程Figure 1 Differentiation process of brown adipocyte induced by PRDM16
2.1 解偶联蛋白-1及相关肥胖症治疗药物
UCP-1是迄今发现的5种UCP亚型之一,相对分子质量为32 000,占棕色脂肪细胞线粒体膜蛋白总量的10%。其单体由约300个氨基酸残基组成,每个单体有6个跨膜结构域,N端和C端均位于线粒体内膜内侧,并具有1个核苷酸结合位点。当该位点与核苷酸(ADP或GDP)结合时,H+的传递受到抑制,UCP-1活性便受到抑制,而体内游离脂肪酸(FFA)可通过提供羧基,与UCP-1转膜通道上氨基酸羧基共同运输质子,进而增加UCP-1转移质子的能力而激活UCP-1[10]。研究发现,定向敲除啮齿类动物BAT中ucp-1基因会导致肥胖症及其相关代谢性疾病[11]。遗传学实验显示:通过增加小鼠棕色脂肪细胞的数量和功能,可增加UCP-1的表达及活性,从而促进其具有瘦型健康表型。体内BAT含量较高的小鼠不但体质量更轻,而且对胰岛素更敏感,血浆FFA水平更低,并能抵御糖尿病及其他代谢性疾病的发生[12]。
BAT通过UCP-1产热来抵御寒冷的作用称适应性产热。啮齿类动物或人类长期暴露于寒冷环境下可导致BAT的增大及活性增加。寒冷通过中枢神经系统的感知,使交感神经兴奋而分泌儿茶酚胺类物质[如去甲肾上腺素(NE)],并激活棕色脂肪细胞表面的肾上腺素能受体,通过细胞内一系列信号转导反应而产生热量(见图2)[13],因此,可通过增加UCP-1的表达或提高其活性,使BAT燃烧脂肪的作用增加。目前已发现一些β3-肾上腺素能受体(β3-AR)激动剂和蛋白质激素可通过间接或直接方式诱导UCP-1的表达。
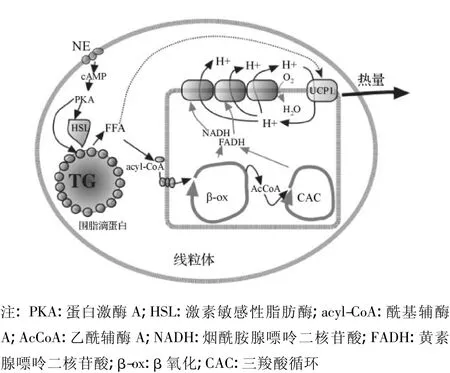
图2 棕色脂肪细胞产热作用的基本原理Figure 2 Thermogenesismechanism of brown adipocyte
2.1.1 β3-肾上腺素能受体激动剂 β3-AR是由402个氨基酸残基组成的典型的G蛋白偶联受体(GPCR),主要分布于棕色脂肪细胞表面。激活该受体可使与其偶联的激活型G蛋白(Gs)活化,从而导致腺苷酸环化酶(AC)系统的激活和细胞内cAMP水平的增高,继而激活cAMP依赖的PKA,后者不但能使HSL磷酸化,促进脂滴中贮存的TG分解为甘油和脂肪酸,还能使cAMP反应元件结合蛋白(CREB)因磷酸化而活化,进而诱导PGC-1α的表达;同时,活化的PKA还可通过对PGC-1α的磷酸化修饰增加PGC-1α活性,从而诱导棕色脂肪细胞UCP-1高表达。UCP-1可使H+从线粒体内膜渗漏到基质中,减少三磷酸腺苷(ATP)的合成并产生热能,其分子机制如图3所示。由此可知,可通过β3-AR激动剂激活成年动物体内棕色脂肪细胞表面的β3-AR,增加机体的产热作用[14]。
目前具有代表性的β3-AR激动剂有:法国赛诺菲-圣德拉堡(Sanofi-Synthelabo)公司的SR-58611A (1)、日本Dainippon公司和Nisshin Kyorin公司联合研制的TAK-677(2)、默克(Merck)公司的L-796568 (3)、辉瑞(Pfizer)公司的CP-114271(4)和惠氏艾尔斯特(Wyeth-Ayerst)公司的CL-316243(5)。其中,SR-58611A可通过激活cAMP(EC50=20 nmol·L-1)而诱导ucp-1基因表达,目前其已进入Ⅲ期临床试验。进入Ⅱ期临床试验的TAK-677则通过降低血糖、FFA水平(EC50=0.062 nmol·L-1)和提高能量代谢(EC50=0.47 nmol·L-1)而发挥作用。L-796568和CP-114271均已进入Ⅰ期临床试验,肥胖症患者在口服L-796568(1 000 mg)后,经间接量热法检测发现脂解作用和能量消耗增加约8%(P<0.01)。CP-114271可迅速被人体吸收,口服该药5~160 mg后,2 h内即达最大血药浓度,40%以上的药物在服药6 h内以原形从尿中排出[15]。此外,大量动物实验表明:CL-316243是高选择性的β3-AR激动剂,可抑制动物的进食,降低动物体质量。连续10 d给大鼠皮下注射CL-316243(1 mg· kg-1·d-1,微量注射泵泵速为0.5μL·h-1)可使其体质量下降(2.2±2.5)%,白色脂肪总质量明显低于空白对照组[(12.71±1.75)vs(26.48±3.07) g][16]。

图3 β3-肾上腺素能受体介导的UCP-1转录级联反应Figure 3 Transcriptional cascades of UCP-1 mediated by β3-AR

值得一提的是,近年来研究发现,β3-AR除了存在于BAT及WAT外,在人类心脏、胆囊、胃肠道、膀胱逼尿肌、大脑以及内子宫肌膜等也有少量表达[17]。为此,人们正积极开展棕色脂肪细胞中β3-AR信号通路的深入研究,以期找到该信号通路上的新靶点,从而尽可能降低因β3-AR激动剂激活其他组织上β3-AR而造成的副作用[18]。
2.1.2 蛋白质激素 Boström等[19]发现,小鼠骨骼肌中的膜蛋白FNDC5经剪切后可形成一种由111个氨基酸残基组成的蛋白质激素——irisin。Irisin的相对分子质量约为32 000,其分子中含有N-糖基化位点,去糖基化后相对分子质量降为20 000,可见其为一种高度糖基化的蛋白质激素。体内外研究显示:irisin作用于白色脂肪细胞后可刺激UCP-1的表达。给野生型BALB/c小鼠静脉注射整合了fndc 5基因的腺病毒载体(含1010个病毒颗粒)。结果显示:小鼠血浆中irisin的水平较注射前升高了3倍,在不影响其活动和进食的情况下,能量消耗增加了100%,且小鼠未出现任何不良反应;注射腺病毒载体10 d后,其皮下脂肪组织中ucp-1 mRNA的表达增加了13倍,prdm 16及pgc-1αmRNA的表达也有少量增加,可见,血浆中irisin水平适当提高后可诱导体内白色脂肪细胞具有棕色脂肪细胞特征。这一新的发现提示,通过采用生物技术方法获得具有生物活性的irisin,有可能成为肥胖症及肥胖相关代谢性疾病治疗的新手段。
2.2 以锌指蛋白PRDM16为靶点的肥胖症治疗
PRDM16包含N-端7个重复的C2H2锌指结构域(ZF1结构域)、C-端3个类似的重复结构域(ZF2结构域)以及1个公认的SET结构域和1个与组蛋白赖氨酸甲基转移酶中保守区域同源的结构域。研究显示:当在体外培养的可分化为白色脂肪细胞的前脂肪细胞中异位表达PRDM16时,会诱发完整的棕色脂肪细胞分化成熟过程,以及生热基因(如ucp-1、pgc-1α以及dio 2)、线粒体基因和其他BAT选择性基因的表达增加。此外,在脂肪组织中转基因表达PRDM16也可诱导WAT中生成大量表达UCP-1的棕色脂肪细胞。过表达PRDM16的细胞可高水平应答cAMP的解偶联细胞呼吸作用,表现出极高的棕色脂肪细胞特征[20-22]。然而,据文献[21]报道,从培养的棕色脂肪细胞中去除PRDM16则造成几乎所有棕色脂肪特征的消失。原代棕色脂肪细胞中PRDM16的完全缺失,还会启动明显的骨骼肌细胞分化。此外,解剖处于胚胎发育期17 d的prdm 16缺陷型小鼠,取BAT经苏木精和伊红染色后发现,其呈不正常的形态结构,实时PCR检测显示其出现显著的生热基因表达减少和肌肉特异性基因表达的增加。
BAT分化调控研究的最新结果表明:PRDM16是前脂肪细胞分化为棕色脂肪细胞的决定性调控因子,因此,开发能提高体内前脂肪细胞中PRDM16表达的药物,有望成为治疗肥胖症及其相关代谢疾病的可行途径。根据prdm 16基因表达调控特性,便可能从化合物库及已知药物中筛选出可激活PRDM16表达的先导物[9]。Ohno等[23]发现,PPARγ激动剂可通过PRDM16通路诱导小鼠皮下WAT棕色化,并通过稳定 prdm 16的 mRNA使PRDM16蓄积,从而使更多白色脂肪细胞稳定地转变成棕色脂肪细胞,这一发现为设计开发可激活棕色脂肪细胞发育的药物提供了依据。
鉴于目前对PRDM16在非脂肪组织中的功能尚知之甚少,且一些白血病患者体内存在PRDM16过表达现象[24-25],研究人员不得不仔细分析单纯提高PRDM16表达水平的药物可能存在的毒副作用。目前,科研人员正尝试采用前体细胞分化的方法,即先体外培养肥胖病人自身肌肉前体细胞,然后用PRDM16进行体外诱导,使其分化为棕色脂肪细胞,最后将分化成熟的棕色脂肪细胞植入人体内,从而发挥其燃烧脂肪的作用[9]。然而,目前尚不确定将这些自体工程细胞移植至体内的何处,才能使其处于最佳生存环境,从而更好地发挥棕色脂肪细胞功能,最终达到治疗效果[26]。
2.3 以过氧化物酶体增殖物激活受体γ辅激活因子-1α为靶点的肥胖症治疗
美国哈佛大学Spiegelman教授(Cell,1998年)在研究BAT中PPARγ的相互作用蛋白质时,首次发现并报道了在寒冷刺激下可被高度诱导和激活的PGC-1α。其可在多种细胞中通过与各种转录因子相互作用对基因转录发挥辅激活作用,促进线粒体生成和UCP-1表达。在白色脂肪细胞中异位表达PGC-1α时,可诱导大量的线粒体生成基因及生热作用基因的表达。
PGC-1α在棕色脂肪细胞的分化发育中具有重要作用。研究显示:小鼠基因敲除pgc-1α会导致冷诱导的适应性产热能力大幅降低[27]。然而,在pgc-1α缺失的情况下,前脂肪细胞分化过程本身并未改变,表明PGC-1α并非棕色脂肪细胞分化的决定性调控因子,而是一个对适应性产热作用起决定性作用的调节因子。值得注意的是,目前已发现一些分子可通过调节PGC-1α的表达或转录激活,在一定程度上影响到棕色脂肪细胞的分化发育及功能。例如,辅阻遏物RIP140可直接与PGC-1α结合,并通过作用于PGC-1α与RIP140共用的一些靶基因启动子来对抗PGC-1α的转录功能[28];类固醇受体辅激活因子-1(SRC-1)可增强 PGC-1α对PPARγ转录活性的共激活作用,SRC-2则通过抑制PPARγ与PGC-1α的相互作用而抑制PGC-1α的转录活性,SRC-3也可通过诱导PGC-1α的乙酰转移酶GCN5使 PGC-1α乙酰化失活而抑制其转录活性[29-30]。
PPARγ受体激动剂曾作为胰岛素增敏剂,成为糖尿病的治疗药物之一,如噻唑烷二酮(TZD)类药物。其可通过激活PPARγ受体,募集PGC-1α来增加下游相关基因的表达,但由于PGC-1α的292—338区域为配基非依赖性PPARγ结合区域,其与脂肪合成相关,故PPARγ受体的激活也导致了TG的堆积,有增肥等副作用,一些药物如马来酸罗格列酮(商品名:文迪雅)因此被迫退出市场。然而,近年来研究发现,PPARγ受体的某些不完全激动剂可减弱甚至抵抗上述副作用,如PA-082(6)。该化合物可通过优先激活PGC-1α/ERRa/OXPHOS通路,与TZD类药物竞争PPARγ受体,从而在消耗能量的同时抵抗TZD类药物诱导的TG堆积作用[31-32]。

据文献[33]报道,新发现的PGC-1α的家族成员NT-PGC-1α促进脂肪酸 β氧化代谢的关键酶——肉碱棕榈酰转移酶Ⅰ(carnitine palmitoyltransferase 1β,CPT-1β)表达的活性是PGC-1α的18倍,表明NT-PGC-1α可更有效地作用于脂肪酸的氧化分解代谢,从而发挥减肥作用。笔者所在课题组在进行代谢性疾病治疗的研究时,对代谢途径中新发现的因子NT-PGC-1α进入了深入的探索。已有研究结果表明:运动及β3-AR激动剂能够促进小鼠BAT中NT-PGC-1α的表达。此外,对高脂饮食诱导的肥胖模型小鼠的研究显示:BAT中NT-PGC-1α及PGC-1α的表达量有所下降,而β3-AR激动剂可逆转这种变化,且改善小鼠血清中的TG、总胆固醇(TC)等指标。
2.4 以胎盘特异性蛋白8为靶点的肥胖症治疗
Plac 8是新发现的一种棕色脂肪细胞分化调节因子。其可调控转录因子C/EBPβ和PRDM16的表达,通过与C/EBPβ启动子上游2.1 kb处的转录起始位点结合发挥作用。例如,当棕色脂肪细胞系中的Plac 8过表达时,C/EBPβ和PRDM16的表达水平也随之增加,从而启动棕色脂肪细胞的分化。缺失plac 8则会导致小鼠肥胖和不耐受寒冷。有研究发现,plac8基因敲除小鼠的BAT中特异性基因(如c/ebpβ、prdm 16、pgc-1α和ucp-1等)表达下调,将其BAT经苏木精和伊红染色后在显微镜下观察,发现棕色脂肪细胞的脂肪滴也明显增大,呈白色脂肪的特点。由此可知,作为棕色脂肪细胞分化的一个重要的上游调节蛋白,Plac 8可能成为肥胖症治疗的又一新靶点[8]。随着对Plac 8研究的深入,人们可逐步了解棕色脂肪细胞发生的早期信号通路,特别是与Plac 8相互作用的因子,从而找到更好的途径来利用BAT治疗肥胖症。
3 展望
目前针对肥胖症治疗的方案主要有2种:其一是通过抑制食欲或吸收以减少能量的摄取,其二是增加能量的消耗。然而,抑制食欲或吸收的药物中,除奥利司他外,安非他明、利莫那班和西布曲明等均因出现严重的副作用而被撤出市场[1,34],因此,针对第2种方案的药物研究显得尤为重要,为此,研究人员又将视线重新转向具有消耗脂肪作用的BAT。
从理论上来说,通过增加棕色脂肪的数量和活性而来消耗脂肪,是一种安全有效的肥胖症治疗方法。早在70年前,Samuel(JAm Med Assoc,1937年)曾利用解偶联剂如2,4-二硝基苯酚来增加机体生热效应,从而燃烧脂肪,达到减肥的目的,但终因存在心律失常、昏迷、抽搐和呼吸麻痹及其他严重副作用而终止使用,此后再无此类药物上市。尽管如此,最新研究表明:β3-AR激动剂确实可促进棕色脂肪的活性[35],要解决的问题是如何提高β3-AR激动剂对BAT的靶向性。
总的来说,通过研究棕色脂肪细胞的分化调控因子,并针对其中的关键调控因子设计药物靶点,有助于新型减肥药物的发现。尽管目前对于棕色脂肪细胞生长分化过程中关键因子的研究仍不够清晰,且其组织特异性也有待考察,但相信随着研究的深入,可加深对各种调控因子作用机制的进一步了解,从而为开发出更为安全有效的肥胖症治疗药物提供新的理论依据。
[1] Kang JG,Park C Y.Anti-obesity drugs:a review about their effects and safety[J].Diabetes Metab J,2012,36 (1):13-25.
[2] Frühbeck G,Becerril S,Sáinz N,et al.BAT:a new target for human obesity?[J].Trends Pharmacol Sci,2009,30 (8):387-396.
[3] van Marken LichtenbeltW D,Vanhommerig JW,Smulders N M,et al.Cold-Activated brown adipose tissue in healthy men[J].N Engl JMed,2009,360(15):1500-1508.
[4] Gesta S,Tseng Y H,Kahn C R.Developmental origin of fat:Tracking obesity to its source[J].Cell,2007,131 (2):242-256.
[5] Nedergaard J,Petrovic N,Lindgren E M,et al.PPARγin the control of brown adipocyte differentiation[J].Biochim Biophys Acta,2005,1740(2):293-304.
[6] Karamanlidis G,Karamitri A,Docherty K,et al.C/EBPβ reprograms white 3T3-L1 preadipocytes to a brown adipocyte pattern of gene expression[J].J Biol Chem,2007,282(34):24660-24669.
[7] Seale P,Conroe H M,Estall J,et al.Prdm16 determines the thermogenic program of subcutaneous white adipose tissue in mice[J].JClin Invest,2011,121(1):96-105.
[8] Jimenez-Preitner M,Berney X,Uldry M,et al.Plac8 is an inducer of C/EBPβrequired for brown fat differentiation,thermoregulation,and control of body weight[J].Cell Metab,2011,14(5):658-670.
[9] Seale P,Kajimura S,Spiegelman B M.Transcriptional control of brown adipocyte development and physiological functionof mice and men[J].Genes Dev,2009,23 (7):788-797.
[10]Tomás P,Jiménez-Jiménez J,Zaragoza P,et al.Activation by retinoids of the uncoupling protein UCP1[J].Biochim Biophys Acta,2004,1658(1/2):157-164.
[11]Feldmann H M,Golozoubova V,Cannon B,et al.UCP1 ablation induces obesity and abolishes diet-induced thermogenesis inmice exempt from thermal stress by living at thermoneutrality[J].Cell Metab,2009,9(2):203-209.
[12] Xue B,Rim J S,Hogan J C,et al.Genetic variability affects the development of brown adipocytes in white fat but not in interscapular brown fat[J].J Lipid Res,2007,48(1):41-51.
[13]Cannon B,Nedergaard J.Nonshivering thermogenesis and its adequatemeasurement inmetabolic studies[J].J Exp Biol,2011,214(2):242-253.
[14]Russell S T,Tisdale M J.Role ofβ-adrenergic receptors in the anti-obesity and anti-diabetic effects of zinc-α2-gly-coprotien(ZAG)[J].Biochim Biophys Acta,2012,1821 (4):590-599.
[15]刘昭前,孙红,刘亚利,等.特异性β3肾上腺素能受体激动剂研究进展[J].中国药理学通报,2005,21 (10):1153-1157.
[16]Raquel F L,Cristina C,MariàA,et al.Combined effects of oleoyl-estrone and a specificβ3-adrenergic agonist (CL316,243)on the expression of genes involved in energy metabolism of rat white adipose tissue[J].Life Sci,2005,77(16):2051-2058.
[17]Ursino M G,Vasina V,Raschi E,etal.Theβ3-adrenoceptor as a therapeutic target:Current perspectives[J].Pharmacol Res,2009,59(4):221-234.
[18]Bracale R,Labruna G,Finelli C,et al.The absence of polymorphisms in ADRB3,UCP1,PPARγ,and ADIPOQ genes protects morbid obese patients toward insulin resistance[J].JEndocrinol Invest,2012,35(1):2-4.
[19]Boström P,Wu J,Jedrychowski M P,et al.A PGC1-αdependentmyokine that drives brown-fat-like development of white fat and thermogenesis[J].Nature,2012,481 (7382):463-468.
[20]Kajimura S,Seale P,Tomaru T,et al.Regulation of the brown and white fat gene programs through a PRDM16/ CtBP transcriptional complex[J].Genes Dev,2008,22 (10):1397-1409.
[21]Seale P,Kajimura S,YangW,etal.Transcriptional control of brown fat determination by PRDM16[J].Cell Metab,2007,6(1):38-54.
[22]Seale P,Bjork B,Yang W,et al.PRDM16 controls a brown fat/skeletal muscle switch[J].Nature,2008,454 (7207):961-967.
[23]Ohno H,Shinoda K,Spiegelman B M,et al.PPARγagonists induce awhite-to-brown fat conversion through stabilization of PRDM16 protein[J].Cell Metab,2012,15 (3):395-404.
[24]Shing D C,Trubia M,Marchesi F,et al.Overexpression of sPRDM16 coupled with loss of p53 inducesmyeloid leukemias in mice[J].J Clin Invest,2007,117(12): 3696-3707.
[25]Modlich U,Schambach A,Brugman M H,et al.Leukemiainduction after a single retroviral vector insertion in Evi1 or Prdm16[J].Leukemia,2008,22(8):1519-1528.
[26]Richard D,Carpentier A C,DoréG,et al.Determinants of brown adipocyte development and thermogenesis.[J].Int JObesity,2010,34(2):59-66.
[27]Lin J,Handschin C,Spiegelman B M.Metabolic control through the PGC-1 family of transcription coactivators[J].Cell Metab,2005,1(6):361-370.
[28]Hallberg M,Morganstein D L,Kiskinis E,et al.A Functional interaction between RIP140 and PGC-1αregulates the expression of the lipid dropletprotein CIDEA[J].Mol Cell Biol,2008,28(22):6785-6795.
[29]Picard F,Géhin M,Annicotte JS,et al.SRC-1 and TIF2 control energy balance between white and brown adipose tissues[J].Cell,2002,111(7):931-941.
[30]Lerin C,Rodgers J T,Kalume D E,et al.GCN5 acetyltransferase complex controls glucose metabolism through transcriptional repressionof PGC-1α[J].Cell Metab,2006,3(6):429-438.
[31]Handschin C.The biology of PGC-1αand its therapeutic potential[J].Trends Pharmacol Sci,2009,30(6): 322-329.
[32]Arany Z,Wagner B K,Ma Y,etal.Gene expression-based screening identifies microtubule inhibitors as inducers of PGC-1αand oxidative phosphorylation[J].Proc Natl Acad Sci USA,2008,105(12):4721-4726.
[33]Zhang Y B,Huypens P,Adason A W,et al.Alternative mRNA splicing produces a novel biologically active short isoform of PGC-1α[J].J Biol Chem,2009,284(47): 32813-32826.
[34] Maria L I,Fernando C.Approved and off-label uses of obesity medications,and potential new pharmacologic treatment options[J].Pharmaceuticals,2010,3(1): 125-145.
[35] Mirbolooki M R,Constantinescu C C,Pan M L,et al.Quantitative assessment of brown adipose tissuemetabolic activity and volume using18F-FDG PET/CT andβ3-adrenergic receptor activation[J].EJNMMI Res,2011,1(1):30-40.
