筋脉通含药血清降低高糖培养大鼠雪旺细胞活性氧水平及PARP-1蛋白表达
2012-01-11梁晓春王普艳
石 玥,梁晓春*,张 宏,王普艳,赵 丽
(中国医学科学院北京协和医学院1.北京协和医院中医科转化医学中心,北京100730;2.基础医学研究所细胞中心,北京100005)
筋脉通含药血清降低高糖培养大鼠雪旺细胞活性氧水平及PARP-1蛋白表达
石 玥1,梁晓春1*,张 宏2,王普艳1,赵 丽1
(中国医学科学院北京协和医学院1.北京协和医院中医科转化医学中心,北京100730;2.基础医学研究所细胞中心,北京100005)
目的 研究筋脉通含药血清对体外高糖培养雪旺细胞活性氧(ROS)水平及多聚(ADP-核糖)聚合酶-1(PARP-1)蛋白表达的影响。方法 30只雄性SD大鼠随机分为3组,分别灌胃筋脉通(JMT)、维生素C(VC)或蒸馏水制备含药血清和对照血清。取新出生大鼠的双侧坐骨神经用于制备雪旺细胞,分为高糖组、JMT组(加入筋脉通含药血清)、VC组(加入维生素C含药血清)及正常对照组。培养48 h后,采用激光扫描共聚焦显微技术检测细胞内二氯荧光黄(DCF)的荧光强度而测得细胞内ROS水平;采用免疫印迹法(Western blot)检测细胞PARP-1(89 ku)的蛋白表达。结果 1)高糖组雪旺细胞ROS-DCF荧光值(86.59±8.14)显著高于正常值(P<0.01);筋脉通含药血清组(44.58±8.67)与维生素C含药血清组(46.12±8.80)均显著低于高糖组(P<0.01)。2)与正常组比较,高糖组雪旺细胞内PARP-1(89 ku)含量(0.712±0.012)明显增加(P<0.01);与高糖组比较,筋脉通含药血清组含量(0.307±0.025)明显降低(P<0.01),且明显优于维生素C组(0.594±0.017)(P<0.01)。结论 筋脉通含药血清能显著减少ROS生成,降低PARP-1的活性和酶解,减轻细胞DNA氧化损伤。
雪旺细胞;高糖;氧化应激损伤;PARP-1;筋脉通
糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是糖尿病(diabetes mellitus,DM)最常见的慢性并发症之一,文献报道患病率达40% ~90%,是导致糖尿病患者足溃疡或非创伤性截肢最常见的原因[1]。雪旺细胞(Schwann cell,SC)作为周围神经系统特有的胶质细胞,具有形成髓鞘和促进轴索生长及再生的作用,SC因氧化应激而发生细胞凋亡是导致上述DPN病理改变的重要原因之一。聚腺苷二磷酸核糖聚合酶(poly ADP ribose polymerase-1,PARP-1)是一类催化聚ADP核糖化的核酶,广泛存在于除酵母外所有真核细胞中,具有修复DNA损伤、调控基因转录、促细胞分裂和维持染色质及基因组稳定等生理功能[2]。有研究发现,PARP在抗氧化应激,保护雪旺细胞,改善糖尿病周围神经病变过程中发挥着重要的作用[3]。本研究既往研究已证实中药筋脉通可以增进高糖培养SC的增殖,促进其分泌神经生长因子[4],具有降低 NF-κB 的蛋白及其 mRNA 的表达[5]等作用。本实验进一步探讨筋脉通对雪旺细胞ROS水平及PARP-1蛋白表达的影响。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:SPF级出生3~5 d的SD雄性乳鼠以及出生6~8周雄性SD大鼠(北京维通利华实验动物技术有限公司,合格证号:京2007-0001)。前者用于雪旺细胞原代培养,后者用于含药血清的制备。
1.1.2 实验药物:筋脉通胶囊(由菟丝子、女贞子、水蛭、桂枝、元胡及细辛等组成),中国医学科学院北京协和医院院内制剂,每粒含生药0.35 g,批准文号(97)京卫药制加字[48]第F-292号,生产批号061019。维生素C(Vitamin C,VC)(北京双鹤药业股份有限公司),0.1 g/片,批准文号国药准字H11021503,生产批号080213。
1.1.3 主要试剂:胎牛血清蛋白、细胞培养基(DMEM)和0.05%胰蛋白酶(Hyclone公司),HEPES(Amresco公司),L-谷氨酰胺、丙酮酸钠和活性氧检测试剂盒(Sigma公司),Cleaved-PARP-1(89 ku)多克隆抗体(CST)、FITC标记山羊抗大鼠IgG、一抗稀释液和DAB显色试剂盒(北京中杉金桥公司),DNaseI(Takara公司),兔抗鼠S-100多克隆抗体(武汉博士德公司),猪抗兔荧光二抗/FITC(Dako公司)Triton-X100(Nacayouitesuwa株式会社),ENMED(Scientifics公司),EDTA(北京化学试剂公司)。
1.2 实验方法
1.2.1 含药血清及正常大鼠血清的制备:随机将大鼠分为筋脉通含药血清组、维生素C含药血清组以及正常组,适应性喂养24 h后开始每天2次灌胃。筋脉通组按成人剂量的15倍给药,即1.312 5 g/kg;维生素 C组按成人剂量的 15倍给药,即0.075 g/kg;正常组予同等体积蒸馏水,连续3 d。于末次灌胃后2 h内进行血液采集。腹腔注射12%乌拉坦(1 mL/100 g BW)麻醉,无菌条件下颈总动脉取血,室温静置2 h后,4 000 r/min离心10 min,分离血清,56℃水浴灭活30 min,分装,置-20℃冰箱保存备用。
1.2.2 SC的原代培养、纯化、传代以及鉴定:无菌条件下,取新生5~8 d乳鼠,切取双侧坐骨神经,D-Hank's漂洗后将组织剪碎至1.0 mm×1.0 mm×1.0 mm左右小块,均匀接种于含胎牛血清20%的DMEM培养基中,5%37℃ CO2培养箱中培养。48 h后首次换液,2~3 d换液1次。当细胞生长到覆盖瓶底壁的80%以上时,D-Hank's液冲洗,加入0.05%胰蛋白酶及0.02%EDTA消化约3~5 min,离心弃上清,完全培养基重悬,接种于T25培养瓶,差速贴壁30 min后收集细胞悬液,以1×105个细胞/mL浓度接种于T25培养瓶,37℃ CO2培养箱中继续培养。当细胞汇合程度达80% ~90%时即可进行传代,吸去原培养液,D-Hank's液冲洗,消化,计数后稀释至浓度为(2~4)×105cells/mL进行传代。取第3代生长良好的细胞,进行S-100蛋白免疫组织化学鉴定,胞质显棕黄色者为阳性细胞。
1.2.3 分组及含药血清干预:根据本实验既往研究结果,设定50 mmol/L葡萄糖为高糖浓度,1∶2稀释筋脉通含药血清、1∶1维生素C含药血清作为理想干预条件,药物作用后的第48小时为观察点。综合分析不同浓度筋脉通含药血清干预后SC的生长曲线与细胞形态,分为1)正常对照组(Con):DMEM培养基+20%正常大鼠血清;2)高糖对照组(Glu):DMEM(50 mmol/L Glu)培养基+20%正常大鼠血清;3)筋脉通(JMT)组:DMEM(50 mmol/L Glu)培养基+10%筋脉通含药血清+10%正常大鼠血清;4)维生素C(VC)组:DMEM(50 mmol/L Glu)培养基+20%VC含药血清。
1.2.4 免疫荧光技术检测筋脉通含药血清对高糖培养SC活性氧水平的影响:取第3代SC进行消化,按上述分组所配制的条件培养液稀释成细胞悬液,按1×105细胞/孔的浓度接种于置有盖玻片的6孔板内,置5%CO237℃培养箱培养48 h。PBS漂洗后加入荧光探针 DCFH-DA(1∶1 000),10~20 μL/片,37℃湿盒内孵育30 min。阴性对照组以0.01 mol/L PBS代替一抗。PBS液振洗后GENMED封片处理液封片,于激光扫描共聚焦显微镜(confocal laser scanning microscope,CLSM)扫描。探测FITC荧光强度,激发光为488 nm,发射光为525 nm。CLSM下观察并照相,所摄图像以 Leica Confocal图像分析软件检测绿色荧光强度,每组计数15~20个细胞。
1.2.5 Western blot检测雪旺细胞PARP-1(89 ku)蛋白表达:1)细胞总蛋白的提取,接种SC于6孔板中,当细胞汇合至70% ~80%时,PBS冲洗,每孔加入100 μL细胞裂解液,细胞刮刀刮下贴壁细胞转移至微量离心管中涡旋振荡器振荡,使细胞充分裂解,收集悬液,4℃ 12 000 r/min离心10 min,吸取上清,-80℃保存。2)BCA法测定总蛋白浓度,PBS溶液稀释待测蛋白样品(5倍稀释),取BCA试剂盒A液和B液适量以50∶1的比例混匀形成浅绿色工作液。将50 μL不同浓度梯度的BSA标准品及稀释好的待测蛋白样品分别与400 μL工作液混合,37℃水浴反应30 min。将反应后的蛋白溶液,分别取200 μL(每个标准品或样品设置二个重复孔)加入到96孔板中,振荡30 s。酶标仪单波长570 nm测A值,绘标准曲线。待测样品浓度通过计算标准曲线公式获得。3)SDS-PAGE、蛋白质印迹、ECL显色反应,计算蛋白上样体积,将蛋白与5×上样缓冲液按体积比1∶4混合,100 ℃沸水煮5 min,12 000 r/min离心10 min,使蛋白内絮状物充分沉淀。按顺序吸取蛋白样品(50 μg总蛋白)至加样孔内,进行电泳。开始电压为60 V(恒压),待染料进入分离胶后,将电压增加到100 V,继续电泳直到染料抵达分离胶底部。
SDS-PAGE结束后,冰浴中进行电转(恒压60 V)3 h。电转结束后,丽春红染液染色,TBS-T漂洗,可见蛋白条带。标记边侧的蛋白质分子量标准,根据目的蛋白的分子质量对转印膜进行裁剪。将标记好的转印膜经TBS-T漂洗,加入适量封闭液中,室温轻摇30 min。将转印膜放入杂交袋内,按0.1 mL/cm2加入抗体稀释液(3%BSA/PBS)、PARP-1(89 ku)抗体和β-actin抗体(1∶1 000稀释)。于4℃摇床上轻摇过夜。TBS-T漂洗,加入抗体稀释液后加入兔抗鼠HRP-IgG,室温轻摇1 h,TBS-T漂洗。
各取等体积ECL试剂A液、B液混合,将ECL混合液加到转印膜上,反应1 min,将转印膜连同黑色背景进行曝光拍照,保存电子格式Tiff结果。
1.3 统计学分析
采用SPSS13.0统计软件进行数据分析及处理。分析前采用One Sample Kolmoglrov-Smirnov Z test检验数据是否符合正态分布,符合正态分布的数据采用均数±标准差(±s)描述,多组独立样本比较采用单因素方差分析(One-Way ANOVA);非正态分布数据采用非参数检验方法(k个独立样本的检验)。
2 结果
2.1 筋脉通含药血清对高糖培养雪旺细胞内ROS水平的影响
阳性对照组活性氧试剂盒绿色荧光表达最强;高糖组表达比阳性对照组稍弱;VC组和JMT组亦可见表达,但都较高糖组弱;而正常对照组(Con)与阴性对照组仅见模糊细胞影,染色不明显。高糖组SC中ROS-DCF的荧光强度显著高于正常对照组(P<0.01)。JMT组及VC组ROS-DCF的荧光强度值均较Con组显著增高(P<0.01),较高糖组显著降低(P<0.01)(表1)。
表1 筋脉通含药血清对高糖培养雪旺细胞ROS表达的影响Table 1 Effect of Chinese herbal medicine Jinmaitongmedicated serum on the expression of ROS in Schwann cell cultured in high-glucose medium(±s)

表1 筋脉通含药血清对高糖培养雪旺细胞ROS表达的影响Table 1 Effect of Chinese herbal medicine Jinmaitongmedicated serum on the expression of ROS in Schwann cell cultured in high-glucose medium(±s)
*P <0.01,**P <0.01 compared with control group;#P <0.01,##P<0.01 compared with high glucose group.
group ROS-DCF fluorescent intensity control 4.59±2.95 50 mmol/L Glu 86.59±8.14**JMT 44.58±8.67*#VC 46.12±8.80**##

图1 各组高糖培养SC内PARP-1蛋白表达的结果Fig 1 Expression of PARP-1(89 ku)among each group in Schwann cell cultured in high-glucose medium
2.2 筋脉通含药血清对高糖培养雪旺细胞PARP-1表达的影响
免疫印迹法(Western blot)检测高糖培养SC内PARP-1结果显示(图1,表2):Con组大鼠坐骨神经在89ku处出现轻淡条带,浓度与本底接近,其余各组均在89 ku出现明显条带。密度扫描分析显示:与Con组比较,高糖组SC内PARP-1的IA值明显增加(P<0.01),JMT组及VC组SC内PARP-1 IA值均较Con组显著增加(P<0.05,P<0.01)。与高糖组比较,JMT组 SC内PARP-1 IA值显著降低(P<0.01);VC组SC内PARP-1 IA值亦显著降低(P<0.05)。治疗组间比较,JMT组SC内PARP-1 IA值明显低于VC组(P<0.01)。
表2 各组高糖培养SC内PARP-1蛋白表达IA值比较Table 2 IA of the expression of PARP-1 among each group in Schwann cell cultured in highglucose medium(±s)
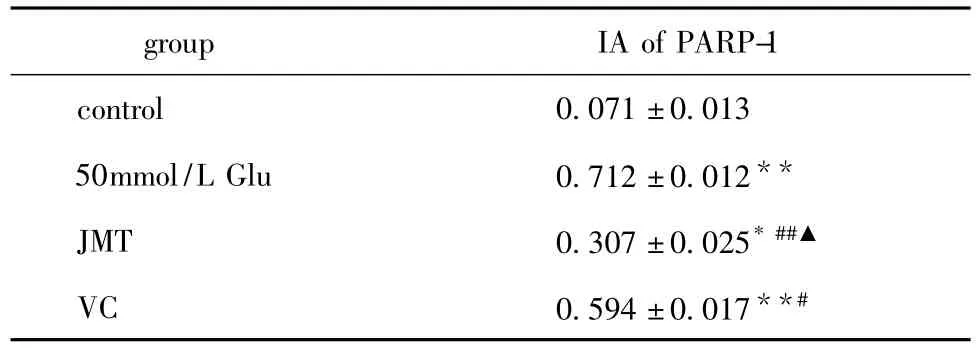
表2 各组高糖培养SC内PARP-1蛋白表达IA值比较Table 2 IA of the expression of PARP-1 among each group in Schwann cell cultured in highglucose medium(±s)
*P <0.05,**P <0.01 compared with control group;#P <0.05,##P <0.01 compared with high glucose group;▲P <0.01 compared with VC group.
group IA of PARP-1 control 0.071±0.013 50mmol/L Glu 0.712±0.012**JMT 0.307 ±0.025*##▲VC 0.594±0.017**#
3 讨论
SC作为周围神经的髓鞘形成细胞,其形态学和生物学改变可直接影响神经再生的微环境,可导致轴索不能生长或再生速度下降[6-7]。当SC暴露在高糖环境中时,葡萄糖顺浓度梯度转运到细胞内部,SC内的高糖状态可以通过线粒体呼吸链和酶氧化以及AGE的堆积等途径增加ROS的来源[8]。氧化应激损伤时,被激活活化的PARP通过将NAD+中的ADP核糖转移到核蛋白上而启动一个能量消耗循环,导致细胞内NAD+和ATP池的耗竭,减慢糖酵解和线粒体呼吸速度,导致细胞功能紊乱发生细胞凋亡。PARP-1是PARP家族中含量最多,功能最重要的一个成员[9]。PARP-1(89 ku)片段具有该酶的自我修饰域和催化域,不具有结合损伤DNA的活性,只保持了PARP酶的基本活性。因此在组织及细胞中发现PARP-1裂解89 ku片段的出现,代表细胞凋亡程序启动[10]。
中医认为DPN的主要病机是由于消渴日久,肾阴受损,阴虚内热,煎熬津液,血黏成瘀,阻滞筋脉;久致阴损及阳,寒凝血滞,气血不能通达四肢,肌肉筋脉失于濡养所致。中药筋脉通以“补肾活血、温筋通络”为组方依据[11],遣菟丝子、女贞子、元胡、水蛭、桂枝、细辛等药味组方而成。菟丝子女贞子共为君药,菟丝子阴阳双补,女贞子善滋养肝肾之阴并清虚热,两者配伍寓阳中求阴之意,俱补肾之阴阳。
目前临床常用的抗氧化药物有维生素C、维生素E和α-硫辛酸。维生素E和α-硫辛酸是脂溶性或醇溶性抗氧化剂,给药方式与水溶性试验药物存在差异,易导致实验条件偏倚,而水溶性抗氧化剂维生素C与实验药物在使用方法上则更趋于一致。维生素C可与O2-、HOO-及 OH-迅速反应,生成半脱氢抗坏血酸[12],清除单线态氧,还原硫自由基,抑制动脉内皮细胞产生脂质过氧化,促进前列环素2合成,发挥延缓细胞凋亡和抗氧化作用[13],故本研究选择水溶性抗氧化剂维生素C作为本实验的阳性对照药物。本次研究的结果显示,筋脉通和维生素C含药血清组均能削弱SC内ROS荧光探针的表达强度,在细胞水平上二者抗氧化能力接近。进一步对DNA氧化损伤致细胞凋亡途径中的关键环节进行检测,发现筋脉通能够明显降低PARP-1的过度表达,抑制细胞凋亡的发生,作用优于维生素C。现代药理研究认为菟丝子中含有多种抗氧化作用的活性成分,包括槲皮素、紫云英甙、金丝桃甙和槲皮素-3-O-β-半乳糖-7-O-β-葡萄糖甙等。而女贞子中发挥抗氧化作用的主要成分为槲皮素和红景天苷。槲皮素在体内外对各种自由基的清除作用已被许多实验证明。通过磷钼法测定其总抗氧化能力(TAC),发现其在pH 7-9.5之间与水溶性维生素E相当,约3倍于姜黄素[14]。槲皮素的抗氧化应激作用明显强于芦丁、白藜芦醇、柚皮素等其他黄酮类化合物,成为抗氧化应激天然药物的优先选择[15]。另一方面,虽然筋脉通含药血清与VC抗氧化应激能力相当,但是在抑制PARP-1方面却表现了明显优势,可能与中药复方制剂多靶点多途径作用相关,提示筋脉通复方制剂可能通过其他途径抑制神经细胞凋亡,有待我们进一步的研究阐释。
综上所述,筋脉通可以有效减少ROS的生成,减轻DNA氧化损伤,并抑制DNA损伤感受器PARP的活性和酶解,从而阻止细胞凋亡程序的执行。这可能是中药筋脉通防止神经组织结构破坏,起到对周围神经保护作用的途径之一。
[1]Dobretsov M,Romanovsky D,Stimers JR.Early diabetic neuropathy:Triggers and mechanisms[J].World J Gastroenterol,2007,13:175-191.
[2]Hassa PO,Hottiger MO.The diverse biological roles of mammalian PARPS,a small but powerful family of poly-ADP-ribose polymerases[J].Front Biosci,2008,13:3046-3082.
[3]Lupachyk S,Shevalye H,Maksimchyk Y,et al.Drel VR,Obrosova IG.ARP inhibition alleviates diabetes-induced systemic oxidative stress and neural tissue 4-hydroxynonenal adduct accumulation:correlation with peripheral nerve function[J].Free Radic Biol Med,2011,50:1400-1409.
[4]孙连庆,梁晓春,张宏,等.中药筋脉通对高糖培养雪旺细胞增殖及NGF表达的影响[J].中华中医药杂志,2009:1019-1022.
[5]吴群励,梁晓春,张宏,等.中药筋脉通含药血清对高糖培养雪旺细胞NF-κB表达的影响[J].世界中西医结合杂志,2011:478-481.
[6]Bunge MB,Johnson MI,Ard MD,et al.Factors influencing the growth of regenerating nerve fibers in culture[J].Prog Brain Res,1987,71:61-74.
[7]Carey DJ,Bunge RP.Factors influencing the release of proteins by cultured Schwann cells[J].J Cell Biol,1981,91:666-672.
[8]Erzola D,Bertolotto MB,Villaggio B,et al.Oxidative stress mediates apoptosic changes induced by hyperglycemia in human tubular kidney cells[J].J Am Soc,2004,15:85-87.
[9]Pacher P,Szabó C.Role of poly(ADP-ribose)polymerase-1 activation in the pathogenesis of diabetic complications:endothelial dysfunction,as a common underlying theme[J].Antioxid Redox Signal,2005,7:1568-1580.
[10]Salvesen GS,Dixit VM.Caspase:intracellular signaling by proteolysis[J].Cell,1997,91:443-446.
[11]梁晓春,郭赛珊.治疗糖尿病神经病变的思路与方法[J].中医杂志,1999,40:52-53.
[12]Bendich A.The antioxidant role of vitamine[J].Cadv,Free Biol Med,1986:419.
[13]Yallampalli S,Micci MA,Taglialatela G,et al.Ascorbic acid prevents beta-amyliod-induced intracellular calcium increase and cell death in PC12 cells[J].Neurosci Lett,1998,251:105-108.
[14]Zhang M,Swarts SG,Yin L,et al.Antioxidant properties of quercetin[J].Adv Exp Med Biol,2011,915:283-289.
[15]Çelik1 H,Arinç E.Evaluation of the protective effects of quercetin,rutin,resveratrol,naringenin and trolox against idarubicin-induced DNA damage[J].Pharm Pharmaceut,2010,13:231-241.
Effects of Chinese herbal medicine Jinmaitong-containing serum on the ROS level and expression of PARP-1 of rat Schwann cells cultured in high-glucose medium
SHI Yue1,LIANG Xiao-chun1*,ZHANG Hong2,WANG Pu-yan1,ZHAO Li1
(1.Dept.of Traditional Chinese Medicine,Translational Medicine Center,PUMC Hospital,CAMS & PUMC,Beijing 100730;2.Institute of Basic Medical Sciences,CAMS & PUMC,Beijing 100005,China)
ObjectiveTo investigate the effects of medicated serum prepared by administration of Jinmaitong(JMT),a compound Chinese herbal medicine,on oxidative damage and poly ADP-ribose polymerase-1(PARP-1)of Schwann cells cultured in high-glucose medium.MethodsSD rats were divided into normal control group(distilled water),JMT group and vitamin C group to prepare medicated serum.Bilateral sciatic nerves of new born SD rats were used to separate Schwann cells.Schwann cells cultured in high-glucose medium were divided into high glucose group(50 mmol/L glucose medium,JMT group(JMT-medica-ted serum)and vitamin C(VC)group(VC-medicated serum).Schwann cells cultured in DMEM were used as the normal control.After 48 h culturing,the level of ROS was measured by confocal laser scanning microscope with 2',7'-dichlorofluorescein(DCF)as a molecular probe and the expression of PARP-1 protein was detected by Western blot.Results1)Compared with high glucose group,the fluorescence intensities of ROS-DEC in Schwann cells cultured in JMT and VC groups were weaker significantly(P<0.01).There were no significant differences between these two treated groups.2)Compared with high glucose group,the expression of PARP-1(89 ku)in Schwann cells cultrued in JMT group decreased significantly(P<0.01).The expression of JMT group was also much lower than that of VC group(P<0.01).ConclusionsThe medicated serum of JMT down-regulates the expression of ROS and PARP-1 of Schwann cells cultured in high glucose medium and reduces the oxidative DNA damage.
Schwann cell;high glucose;oxidation damage;PARP-1;Jinmaitong capsule
R 2
A
1001-6325(2012)09-1059-05
2011-10-31
2011-12-26
北京市自然科学基金(7082077)
*通信作者(corresponding author):xcliang@vip.sina.com
