HIV-P24核酸适配体的筛选
2012-01-11毛爱红廖世奇张丽琼王晓清
张 宁,毛爱红,马 瑾,廖世奇*,张丽琼,王晓清,马 君
(1.兰州理工大学生命科学与工程学院,甘肃兰州730050;2.甘肃省医学科学研究院,甘肃兰州730050)
HIV-P24核酸适配体的筛选
张 宁1,毛爱红2,马 瑾2,廖世奇2*,张丽琼1,王晓清2,马 君1
(1.兰州理工大学生命科学与工程学院,甘肃兰州730050;2.甘肃省医学科学研究院,甘肃兰州730050)
目的 利用SELEX技术筛选HIV-P24的核酸适配体,为艾滋病的诊断和治疗奠定基础。方法 以重组P24为筛选靶,用SELEX技术从随机寡核苷酸库中筛选与HIV-P24结合的寡核苷酸,利用凝胶阻滞实验鉴定第12轮筛选到的寡核苷酸与HIV-P24的结合,再用Dot-blot法筛选出与HIV-P24结合的核酸适配体,并检测核酸适配体识别HIV-P24的特异性。结果 Dot-blot筛选到5条与HIV-P24有较强结合能力的核酸适配体,且均为不同的序列。特异性检测显示,18和26号配体只与HIV-P24特异性结合,而与人血清白蛋白、牛血清白蛋白和脱脂奶粉均无明显结合。结论 成功筛选到2条特异结合HIV-P24的核酸适配体,为其应用于艾滋病诊断和治疗提供了实验基础。
SELEX技术;HIV-P24;核酸适配体
P24是HIV-1的核心抗原,在病毒的包装和成熟过程起重要作用。机体感染HIV-1后,P24在血清中出现的时间较早,一般在HIV-1感染后2~3周就可以检测,可作为艾滋病窗口期检测的血清标志物。通过检测血液中的P24,可达到早期诊断和治疗的目的[1-2]。
核酸适配体是通过SELEX技术筛选得到的一类寡核苷酸分子,能与靶分子强特异、高亲和力地结合,并发挥生物学效应[3-4]。由于其筛选靶分子范围广、分子质量小、免疫原性低,且可进行化学合成、改造与标记[5],核酸适配体越来越受到人们的青睐。目前,在化学分析与检测、临床诊断与治疗及药学等领域已对其开展广泛的应用基础研究[6-9]。
本研究利用SELEX技术筛选HIV-P24特异性核酸适配体,为建立核酸适配体辅助的P24检测方法奠定基础,对艾滋病的诊断和治疗具有重要意义。
1 材料与方法
1.1 材料
HIV-P24重组蛋白(2 g/L)(北京科卫临床诊断试剂有限公司);随机寡核苷酸库(2.5 nmoles,84 bp)5'-TAGGGAATTCGTCGACGGATCC40(N)CT GCAGGTCGACGCATGCGCCG-3'(N=A,T,C,G)、引物 P9(5'-TAGGGAATTCGTCGACGGATCC-3')、P12(5'-CGGCGCATGCGTCGACCTGCAG-3')和M13-47(5'-CGCCAGGGTTTTCCCAGTCACGAC-3')(上海生物工程公司合成);NC膜(膜孔径0.45 μm)(PALL公司);大肠杆菌JM-109(甘肃省医学科学研究院提供);pMD18-T Vector系统(TaKaRa公司);[α-32P]dATP(北京福瑞生物工程公司);PCR所用试剂(上海生物工程公司);其他试剂均为国外或国产分析纯。
1.2 方法
1.2.1 HIV-P24特异性寡核苷酸筛选:1)筛选:将5 μL HIV-P24(1 g/L)点至圆形 NC膜(半径为0.2 cm)中心,待NC膜干燥后,置于0.5 mL的离心管(筛选管),加入50 μL封闭液(含5%脱脂奶粉、100 g/L鲑鱼精 DNA的 PBS溶液)37℃孵育2 h。同时设立不加P24的NC膜为反筛管。用含0.05%Tween-20的PBS溶液分别洗涤筛选管和反筛管3次,每次3 min。用50 μL 10×缓冲液溶解寡核苷酸库,95℃变性5 min,降至4℃。首先把变性后的库加入反筛管,37℃孵育1 h。吸出反筛管中的库,加入筛选管,37℃孵育1 h。筛选管和反筛管分别用含0.05%Tween-20的 PBS溶液洗涤 3次,每次3 min。然后两管中分别加入200 μL洗脱缓冲液(20 mmol/L Tris-HCl,4 mol/L 异 硫 氰 酸 胍,1 mmol/L DTT,pH 8.3),于80 ℃水浴15 min,立即降到4℃,吸取两管中的洗脱液,酚氯仿抽提、乙醇沉淀回收DNA,用50 μL超纯水溶解待用。2)PCR鉴定回收到的DNA:从上述回收产物中取10 μL为模板,配置100 μL PCR体系:10×扩增缓冲液(不含MgCl2)10 μL,Mg2+(25 mmol/L)5 μL,4 种 dNTP 混合物(每种2.5 mmol/L)8 μL,引物 P9(25 mmol/L)1 μL,引物 P12(25 mmol/L)1 μL,Taq DNA 聚合酶0.5 μL,模板10 μL,加超纯水至100 μL。进行 PCR扩增:94℃ 30 s,55 ℃ 30 s,72℃ 30 s,共21个循环。每3个循环取样10 μL,进行非变性聚丙烯酰胺凝胶电泳,对比筛选管和反筛管回收到的DNA的量,确定寡核苷酸对P24的富集情况。把筛选管回收到的ssDNA制备成dsDNA。3)不对称PCR制备ssDNA:从 dsDNA产物中取10 μL为模板,配置100 μL PCR体系:10×扩增缓冲液(不含 MgCl2)10 μL,Mg2+(25 mmol/L)5 μL,4 种 dNTP 混合物(每 种 2.5 mmol/L)8 μL,引 物 P9(25 mmol/L)2 μL,Taq DNA 聚合酶0.5 μL,模板10 μL,加超纯水至100 μL。进行 PCR 扩增:94℃ 30 s,55℃30 s,72℃ 30 s,共30个循环。每隔5个循环取样10 μL,进行变性聚丙烯酰胺凝胶电泳,确定制备ss-DNA的最佳PCR循环数,制备ssDNA。ssDNA经切胶纯化后,作为次级库,用于下一轮筛选。
1.2.2 凝胶阻滞实验鉴定P24-ssDNA复合物:最后一轮筛选得到的寡核苷酸用[α-32P]dATP标记,在10 μL 10×缓冲液中与5 μL HIV-P24 37 ℃孵育1 h结合,采用琼脂糖凝胶电泳(1.5%W/V琼脂糖,1×TAE缓冲体系,稳压80 V)分离P24-ssDNA复合物,同时设置P24和ssDNA两个参照。放射自显影和考马斯亮蓝染色后,观察P24-ssDNA复合物的阻滞条带。
1.2.3 寡核苷酸转化大肠杆菌JM-109:将筛选到的寡核苷酸制备成 dsDNA,并切胶纯化。按照pMD18-T Vector试剂盒操作,连接 dsDNA到pMD18-T Vector,转化大肠杆菌JM-109,菌液涂布在含有氨苄抗生素的LB固体培养基上。待长出克隆后,挑取单克隆培养,采用通用引物M13-47和特异性引物P9/P12交错PCR法鉴定阳性克隆。
1.2.4 Dot-blot筛选与HIV-P24结合的配体:将已鉴定的阳性克隆菌液利用不对称PCR制备成[α-32P]dATP标记的ssDNA。按方法1.2.1中1)所述,制备结合有P24的NC膜,同时设立空白对照。将32P-ssDNA加到制备好的NC膜上,37℃孵育2 h后,用含0.05%Tween-20的PBS溶液洗膜。NC膜干燥后进行放射自显影,观察32P-ssDNA与P24的结合情况。用 Image J软件对Dot-blot结果进行吸光度分析,将与P24结合程度较好的寡核苷酸测序。
1.2.5 核酸适配体特异性检测:按方法1.2.1中1)所述,制备分别结合有 HIV-P24(2 μL)、人血清白蛋白(2 μL)、牛血清白蛋白(2 μL)、脱脂奶粉(2 μL)的NC膜。不对称 PCR制备[α-32P]dATP标记的配体32P-ssDNA,Dot-blot检测配体32P-ssDNA与各种蛋白的结合情况。
2 结果
2.1 HIV-P24特异性寡核苷酸筛选结果
在筛选过程中,Dot-blot鉴定第 1、4、8、12 轮的次级库寡核苷酸对P24的富集。Image J软件分析显示,反筛管相对参照值(用 PBS为洗涤液的Dot-blot吸光度值)的结合百分比分别为18.9%、16.3%、15.1%和14.3%;筛选管相对参照值的结合百分比分别为21.4%、25.2%、38.4%和51.7%(图1),寡核苷酸对HIV-P24逐步得到富集。第12轮筛选时,电泳检测寡核苷酸对P24的富集效果见图2。
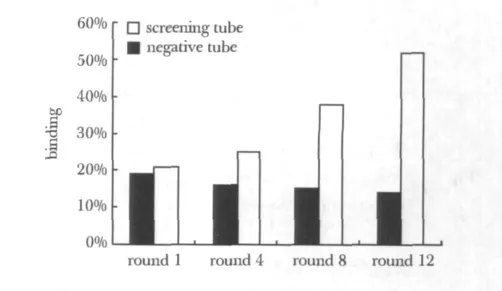
图1 寡核苷酸对P24的富集Fig 1 The enrichment of oligonucleotides to P24
2.2 凝胶阻滞实验
P24-ssDNA复合物在电泳中明显受到阻滞(图3)。
2.3 寡核苷酸转化大肠杆菌结果
鉴定结果显示,48个菌液均为阳性,目的片段有19个正向插入载体,有29个呈反向插入。
2.4 Dot-blot筛选P24核酸适配体
Image J吸光度值分析显示,8号、15号、18号、26号和33号菌液制备的32P-ssDNA与P24结合程度较好(表1,图4)。
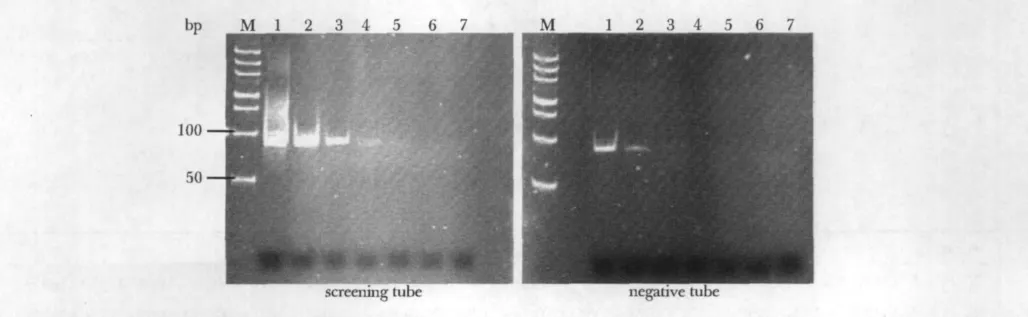
图2 寡核苷酸富集效果Fig 2 The enrichment effect of oligonucleotides
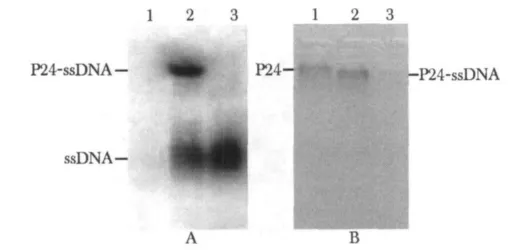
图3 凝胶阻滞实验放射自显影和考马斯亮兰染色Fig 3 EMSA assay by radioautography and Coomassie brilliant blue staining
2.5 核酸适配体测序结果
5个结合较强的候选P24核酸适配体测序结果见表2。
2.6 核酸适配体特异性检测结果
特异性结合实验显示,18和26号适配体与HIV-P24有明显结合(图5),而与其他蛋白无显著结合。

表1 Dot-blot吸光度值分析Table 1 The absorbency analysis of Dot-blot
3 讨论
1990年Gold和Ellington等提出核酸适配体技术[10-11],核酸适配体以其优良的特性在医学诊断领域的基础和应用研究备受关注。研究人员利用核酸适配体可通过PCR进行扩增的特点建立了“邻近连接法”检测技术[12],日本学者在2009年报道了immuno-aptamer PCR技术检测 VEGF[13]。最近,基于核酸适配体的激活式分子探针用于肿瘤活细胞检测和活体成像的新方法被重点报道[14]。这些检测方法因其具有高特异性和高灵敏度,为疾病相关标志物分析检测、病变细胞检测、肿瘤成像诊断提供了新的思路,具有广泛的临床前实验以及临床应用前景。
目前,国际医学界越来越重视对P24的检测,把血液中P24的测定作为艾滋病诊断和病情监控的一个重要指标,但是临床上检测P24的主要方法仍然是ELISA[15],有关核酸适配体用于P24检测的研究并未见报道。如果能够将核酸适配体应用于P24检测,作为HIV核酸检测的辅助诊断方式,对艾滋病的确诊和病情监控将具有一定临床意义。

图4 32P-ssDNA与P24的Dot blot结果Fig 4 The result of Dot blot between P24 and different32P-ssDNA

表2 测序得到的核酸适配体序列Table 2 Sequences of the aptamers after sequencing
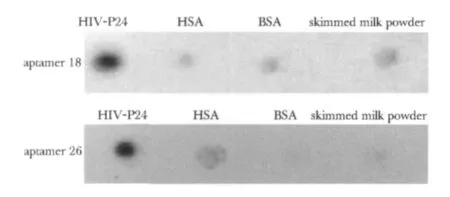
图5 适配体32P-ssDNA与不同靶标结合结果Fig 5 Binding result of the aptamer32P-ssDNA with different targets by Dot-blot
本研究以P24为筛选靶,利用经典的SELEX技术经过12轮筛选,获得了针对P24富集的寡核苷酸,凝胶阻滞实验鉴定了寡核苷酸与P24的结合。Dot-blot分析明确了寡核苷酸配体与P24的结合情况,并对配体的特异性进行了检测,最终获得了特异性识别和结合P24的核酸适配体。这为核酸适配体用于P24检测提供了实验基础,为P24的检测提供一种新思路。
[1]熊祝嘉.ELISA检测p24抗原用于诊断HIV感染的研究现状[J].实用医技杂志,2007,14:166-168.
[2]刘鱼,王憬惺,黄毅.HIV-1p24抗原检测方法及应用研究进展[J].中国输血杂志,2009,22:63-67.
[3]Kulbachinskiy AV.Methods for selection of aptamers to protein targets[J].Biochemistry,2007,72:1505 -1518.
[4]Ireson CR,Kelland LR.Discovery and development of anticancer aptamers[J].Mol Cancer Ther,2006,5:2957 -2962.
[5]Soontornworajit B,Wang Y.Nucleic acid aptamers for clinical diagnosis:cell detection and molecular imaging[J].A-nal Bioanal Chem,2011,399:1591-1599.
[6]谢海燕,陈薛钗,邓玉林.核酸适配体及其在化学领域的相关应用[J].化学进展,2007,6:1026-1033.
[7]吴崔晨,胡佳,邹远,等.核酸适体在生物医学中的应用[J].化学进展,2010,22:1518-1530.
[8]Keefe AD,Pai S,Ellington AD.Aptamers as therapeutics[J].Nat Rev Drug Discovery,2010,9:537-550.
[9]Liao SQ,Liu YQ,Zeng JY,et al.Aptamer-based sensitive detection of target molecules via RT-PCR signal amplication[J].Bioconjugate Chem,2010,21:2183-2189.
[10]Tuerk C,Gold L.Systematic evolution of ligands by exponential enrichment:RNA ligands to bacteriophage T4DNA polymerase[J].Science,1990,249:505 -510.
[11]Ellington AD,Szostak JW.In vitro selection of RNA molecules that bind specific ligands[J].Nature,1990,346:818-822.
[12]Fredriksson S,Gullberg M,Jarvius J,et al.Protein detection using proximity-dependent DNA ligation assays[J].Nat Biotechnol,2002,20:473 -477.
[13]Yoshida Y,Horii K,Sakai N,et al.Antibody-specific aptamer-based PCR analysis for sensitive protein detection[J].Anal Bioanal Chem,2009,395:1089-1096.
[14]Shi H,He XX,Wang KM,et al.Activatable aptamer probe for contrast-enhanced in vivo cancer imaging based on cell membrane protein-triggered conformation alteration[J].Proc Natl Acad Sci USA,2011,108:3900-3905.
[15]Constantine NT,Zink H.HIV testing technologies after two decodes of evolution[J].Indian J Med Res,2005,121:519-538.
Screening of aptamers to HIV-P24
ZHANG Ning1,MAO Ai-hong2,MA Jin2,LIAO Shi-qi2*,ZHANG Li-qiong1,WANG Xiao-qing2,MA Jun1
(1.College of Life Science and Engineering,Lanzhou University of Technology,Lanzhou 730050;2.Institute of Gansu Medical Science Research,Lanzhou 730050,China)
ObjectiveTo screen aptamers to HIV-P24 through SELEX technique for the diagnosis and therapy of AIDS.MethodsWith recombinant P24 for the screening target,oligonucleotides binding to HIV-P24 were screened from a random oligonucleotide library through SELEX technique.The binding capacity between oligonucleotides obtained from the 12th round of screening and HIV-P24 was identified via electrophoretic mobility shift assay(EMSA).The aptamers strongly binding to HIV-P24 were screened and the recognition specificity of aptamers for HIV-P24 was detected by Dot-blot method.ResultsFive aptamers with high affinity to HIV-P24 were obtained with different sequences.The binding specificity showed that No.18 and No.26 apatmers only bound to HIV-P24,not to human serum albumin,bovine serum albumin and skimmed milk powder.ConclusionsTwo aptamers specially binding to HIV-P24 were obtained,and thus provides an experimental basis for the diagnosis and treatment of AIDS by utilizing aptamer of HIV-P24.
SELEX technique;HIV-P24;aptamer
R 319
A
1001-6325(2012)09-0987-05
2011-08-16
2011-12-05
国家自然科学基金(30271219,30960104,81060180);国家中小企业创新基金(06C26226200591);甘肃省重大研发项目(GKSOU-B06-10,GKS031030)
*通信作者(corresponding author):lshiqi@126.com
志谢:衷心感谢甘肃省医学科学研究院医学分子生物学研究中心的全体员工和同学及兰州理工大学生命科学与工程学院。
