高效液相色谱法测定叶酸水解制备蝶酸的含量*
2012-01-11张许刘卫
张 许 刘 卫
(1.泰山医学院,山东 泰安 271016; 2.中国人民解放军第八十八医院,山东 泰安 271000)
蝶酸是叶酸结构的一部分。曹曦元等[1]曾报道蝶酸能拮抗蓖麻毒素(Ricin)A链蛋白,常作为阳性对照药研究化合物拮抗蓖麻毒素A链蛋白的作用。蓖麻毒素A链蛋白具有很强的抑制蛋白质合成的功能,是一种生化武器,目前临床没有有效的解毒剂,而其原料获得和提取、纯化工艺都不复杂[2-3]。所以,研究蓖麻毒素解毒剂具有重要的现实意义。本研究利用叶酸水解实验制备得到蝶酸粗品,初步精制后建立其含量测定方法,为今后的实验提供原料。
1 材料与方法
1.1仪器与试剂 Lablliance高效液相色谱仪,Scientific System,Inc;配有二级阵列管UV6000LP型紫外检测器,Scientific System,Inc;BT124S型电子天平,北京多利斯仪器系统有限公司;甲醇为色谱纯;盐酸、冰醋酸、三乙胺、氨水均为分析纯;蝶酸对照品(≥93%),购自Sigma公司;蝶酸供试品为本实验室用叶酸水解制得。
1.2叶酸水解试验
1.2.1试验原理 酰胺水解有两种方法,一是酸碱催化,在pH=3或者pH﹥13的条件下可以水解。二是用酰胺水解酶。本实验采用酸性条件下水解。
1.2.2试验步骤 叶酸45 g加蒸馏水300 ml,加HCl溶解成褐色澄清溶液,控制pH值3左右,搅拌加热至80~90℃,水解2.5 h。冷却至室温,抽滤得产物晾干,称重。将第一步水解产物溶于氨水,加少量活性炭煮沸10 min脱色,抽滤,滤液加HCl调pH值至弱酸性,冷却至室温。抽滤得产物,晾干。
1.3色谱条件 色谱柱:PhenomexneC18(250 mm×4.6 mm),流动相甲醇︰水(含2%醋酸、0.2%三乙胺)为25︰75,流速1 ml/min。样品溶剂为0.375%氨水。波长:285 nm。
1.4对照品及样品制备 准确称取10 mg蝶酸对照品,用0.375%氨水溶解于50 ml容量瓶并定容至刻度,摇匀得0.2 mg/ml对照品。临用前稀释至所需浓度,进样20 μl,以保留时间定性,峰面积定量。准确称取样品50 mg。用0.375%氨水溶解于50 ml容量瓶并定容至刻度,摇匀得1 mg/ml。临用前稀释至所需浓度,进样20 μl,以保留时间定性,峰面积定量。
1.5计算方法 采用外标法测定蝶酸含量,根据公式:m待测物=A待测物×m标准物/A标准物。所以其含量为:m待测物/m样品进样量×100%。A为峰面积,m为药物质量。
2 结果与计算
2.1色谱分离 二极管阵列检测器检测谱图显示在285 nm处有最大吸收,选用本色谱条件,分析效果和保留时间都比较理想(图1~3)。

图1 二极管阵列全波长扫描图

图2 蝶酸粗品

图3 蝶酸标准品
2.2线性试验 精密量取对照品0.4,0.8,1.2,1.6,2.0,2.4 ml, 置50 ml量瓶中,用0.375%氨水溶解并定容, 摇匀,得1.6,3.2,4.8,6.4,8,9.6 μg/ml溶液。在上述色谱条件下分别进样测定, 记录色谱图。以进样量(μg)为横坐标,峰面积A为纵坐标绘制标准曲线,得回归方程,结果见图4。

图4 蝶酸线性方程标准曲线
回归方程为:y=463589x + 52911,相关系数为r=0.9991,表明蝶酸在1.6~9.6 μg浓度范围内呈良好线性关系。
2.3精密度试验 吸取对照品溶液8 μg/ml和4 μg/ml按上述色谱条件连续进样6次,每次20 μl,结果见表1,RSD分别为1.15%和1.73%。
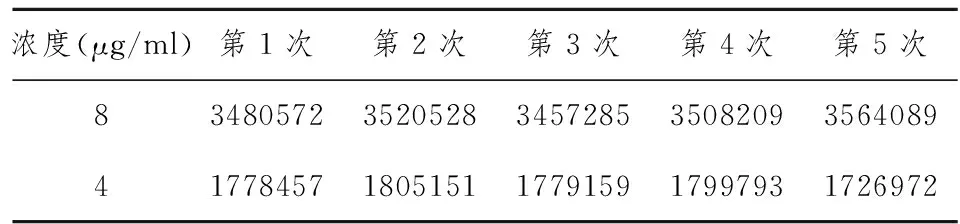
表1 精密度实验结果
2.4稳定性试验 取供试品配制成浓度为20 μg/ml的溶液按上述色谱条件分别在0,2,4,6,8,10,12小时进样,结果见表2,RSD= 0.42%,结果表明蝶酸在12小时内基本稳定。

表2 稳定性试验结果
2.5含量测定 取8 μg/ml和4 μg/ml的蝶酸标准液,各自峰面积平均值为A1标准物和A2标准物,20 μg/ml的样品稳定性试验平均值为A待测物,根据公式测得蝶酸含量为72.5%和73.5%。取平均值73%。
2.6加样回收率试验 称取粗品6份,分别加入3 mg蝶酸标准品,按样品溶液制备方法操作得加样回收溶液,按上述色谱条件操作进样,结果见表3,平均回收率为98.9%,结果表明本方法回收率较高。

表3 加样回收试验结果
3 讨 论
蝶酸由于其溶解性不好,限制了其开发利用[4],所以现在多用于做对照品,目前也没有报道改变其溶解度的研究,可能因为蝶酸在市面上难以购买。本实验用叶酸水解制备蝶酸得到的粗品,操作步骤简单,试剂成本低,适用于实验室小量合成,虽然纯度不高,根据需要再进一步纯化基本能满足下一步实验的要求。含量测定方法参考叶酸的标准,但大部分叶酸的测定标准都采用磷酸盐为流动相,其配置和冲洗色谱柱的过程繁琐,且对色谱柱的损害也比不含盐的流动相损害严重,本实验采用的流动相简单易配置,省时省力又延长了色谱柱的使用寿命。经过多次实验证实灵敏度高,选择性好,无干扰,结果令人满意。
[1] 曹曦元,赵青,黎燕,等. 蝶酸对天然蓖麻毒素及重组蓖麻毒素A链蛋白的拮抗作用研究[J].军事医学科学院院刊,2010,34(1):12-15.
[2] 郑成,雷德柱,雷雨,等. 蓖麻毒蛋白提取[J].广东化工,2003(5):1-4.
[3] 余涛,唐吉军,郝兰群,等. 一种纯化蓖麻毒素的新方法[J].生物技术,2005,15(5):53-55.
[4] Yan X, Hollis T, Svinth M, et al. Structure-based identification of a ricin inhibitor[J]. J Mol Biol, 1997, 266(5):1043-1049.
