MIF对子痫前期氧化应激机制的影响*
2012-01-11谢晓芳叶元华
谢晓芳 张 静 詹 瑛 叶元华
(1.菏泽医学专科学校妇产科,山东 菏泽 274000; 2.沧州医学高等专科学校妇产科,河北 沧州 061001;3.青岛大学医学院附属医院产科,山东 青岛 266003)
子痫前期(preeclampsia,PE) 是人类妊娠期特有的原因不明的多系统疾病,也是导致孕妇及围生儿病死率和死亡率的主要原因之一,其发病机制始终是产科领域的研究热点。目前认为,子痫前期存在明显的氧化应激(oxidative stress,OS),氧化应激水平增高可能是子痫前期的重要发病因素之一[1]。巨噬细胞移动抑制因子(macrophage migration inhibition factor,MIF)是在活化的T淋巴细胞中发现的一种集细胞因子、生长因子、激素和酶特性于一身的多效能蛋白分子,具有多种生物活性,是缺氧及其信号通路的下游效应分子之一[2]。研究[3]发现,MIF在胎盘组织中有表达,并参与全部妊娠过程,在维护母胎间的免疫赦免机制中起重要作用。为此,本研究通过检测MIF在子痫前期及正常晚期孕妇胎盘组织中的表达,同期检测子痫前期及正常晚期孕妇胎盘组织中超氧化物歧化酶(SOD)、丙二醛(MDA)、过氧化氢(H2O2)等氧化应激指标,初步探讨MIF与子痫前期发病的关系。现报道如下。
1 资料与方法
1.1 研究对象
选取2010年3~10月在青岛大学医学院附属医院产科住院分娩的孕妇71例,其中子痫前期孕妇38例(子痫前期组),平均年龄(28±4)岁,平均孕周(36±3)周。同期行剖宫产的正常晚期孕妇(对照组)33例,平均年龄(29±3)岁,平均孕周(37±4)周。两组孕妇年龄及孕周比较差异无统计学意义(P>0.05)。子痫前期的诊断标准参照乐杰主编的《妇产科学》(第7版)[4]。两组孕妇均无慢性高血压、糖尿病、感染、肾炎和系统性红斑狼疮等病史,无其他妊娠合并症及并发症。此次妊娠也无胎膜早破及感染征象。
1.2 研究方法
1.2.1标本采集 各组孕妇胎盘娩出后30 min内,在无菌状态下于胎盘母体面中央(避开坏死及钙化区)取一块胎盘组织约1 cm×1 cm×1 cm,生理盐水漂洗至洗液清澈,放置于-70℃冰箱保存,用于提取RNA。
1.2.2RT-PCR技术检测胎盘组织中MIF mRNA的表达 采用逆转录RT-PCR方法进行检测,总RNA提取试剂盒由武汉博士德生物工程有限公司提供,MIF引物由上海生工生物工程技术服务有限公司合成。MIF上游引物:5′-GCCCGGACAGGGTCTACA-3′,下游引物:5′-CTTAGGCGAAGGTGGAGTTGTT-3′,目的片段为125 bp;内参照磷酸甘油醛脱氧酶(GAPDH)正向引物:5′-CAGGGCTGCTTTTAACTCTGG-3′,反向引物:5′-TGGGTGGAATCATATTGGAACA-3′,扩增产物片段为102 bp。cDNA的合成按试剂盒操作步骤,MIF扩增反应条件:94℃预变性2 min,然后按94℃ 30 s,52℃ 60 s,72℃ 30 s,共35个循环,最后72℃延伸10 min。取5 μl反应物进行琼脂糖凝胶电泳分析扩增产物,电泳结果用计算机扫描分析,以各检测标本中MIF与GAPDH扩增条带的实际灰度值的比值表示MIF mRNA的表达水平。
1.2.3测定氧化应激指标 组织裂解、离心后得组织匀浆。扫描及分析系统检测各条带相对吸光度值。采用南京建成生物工程所提供的SOD、MDA、H2O2试剂盒,测定胎盘组织匀浆液各指标。以上操作均按试剂盒指导步骤完成操作,按公式计算相应SOD活力及MDA、H2O2含量。
1.3 统计学方法
采用SPSS 13.0统计软件进行数据处理和统计学分析。子痫前期组孕妇与对照组孕妇一般资料比较及实验结果数据统计用t检验,对胎盘组织中的H2O2含量与MIF mRNA表达水平进行简单直线相关分析。
2 结 果
2.1 两组胎盘组织中MIF mRNA的表达
逆转录RT-PCR检测结果显示,两组孕妇胎盘组织中均有MIF mRNA的表达,子痫前期组孕妇胎盘组织中MIF mRNA的表达明显高于对照组孕妇,两组比较,差异有统计学意义(P﹤0.01)。见表1,图1。

表1 两组胎盘组织中MIF mRNA表达水平、SOD活力、MDA及H2O2含量比较
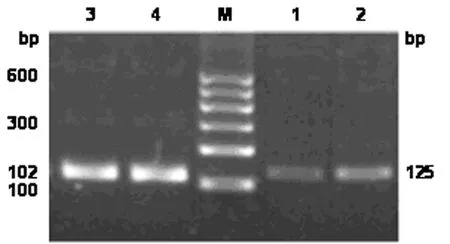
M:标志物 1:对照组 2:子痫前期组 3~4:内参照
2.2 两组孕妇胎盘组织中SOD活力、MDA及H2O2含量比较
子痫前期组孕妇胎盘组织中SOD活力较对照组孕妇明显下降,差异有统计学意义(P﹤0.01)。子痫前期组孕妇胎盘组织中MDA含量较对照组孕妇显著增高,差异有统计学意义(P﹤0.05)。H2O2含量在子痫前期组孕妇胎盘组织中也显著增高,差异有统计学意义(P﹤0.01)。见表1。
2.3 MIF mRNA与H2O2含量相关性分析
对照组孕妇胎盘组织中MIF mRNA表达水平与H2O2含量呈明显正相关关系(r=0.65,P﹤0.01);子痫前期组孕妇胎盘组织中MIF mRNA表达水平与H2O2含量也呈明显正相关关系(r=0.74,P﹤0.01)。
3 讨 论
3.1 MIF在子痫前期孕妇胎盘组织中表达的变化及意义
氧化应激是指体内氧化与抗氧化作用失衡,倾向于氧化,进而激活或损伤内皮细胞。MIF是含有115个氨基酸的蛋白质,相对分子质量12.5 kD,具有由α链和β链组成的三维结构。目前认为,MIF分子不属于目前已发现的任何细胞因子家族,是集细胞因子、生长因子、激素和酶特性于一身的多效能蛋白分子,具有多种生物活性。MIF广泛表达于多种系统、组织的细胞中,参与机体多种生理、生化过程,在炎症、免疫、细胞凋亡和增殖中起中心枢纽作用。有研究表明,MIF与冠心病、糖尿病、动脉粥样硬化等多种疾病的发生发展密切相关,但其与子痫前期发病关系的研究报道较少。目前虽已有研究证实,子痫前期患者血浆中MIF水平较正常妊娠妇女明显增高,但引起增高的原因尚未明了。本研究结果显示,子痫前期组孕妇胎盘组织中MIF水平均明显高于正常孕妇,提示胎盘组织中的MIF 在子痫前期的发生发展过程中起重要作用。
目前研究发现,MIF在整个妊娠的绒毛膜外细胞滋养层以及蜕膜组织中的滋养层细胞均可表达[5]。最近的体外研究显示,氧气可调节MIF在胎盘绒毛组织的表达,低氧条件下,MIF在绒毛外滋养细胞中表达明显增多,表明MIF是缺氧及其信号通路的下游效应分子之一[2]。与正常孕妇相比,子痫前期患者因遗传及免疫因素造成子宫胎盘血管重构障碍,滋养层侵入子宫肌层过浅,胎盘血流灌注减少,局部处于缺血缺氧状态,释放大量MIF进入体循环,可进一步诱导巨噬细胞和活化的 T细胞分泌更大量细胞因子如肿瘤坏死因子(TNF)-α、白细胞介素(IL)-1β、IL-2、IL-6。TNF-α可激活线粒体电子传递回路辅酶Q中的超氧化物,导致脂质过氧化反应显著增强,而活化的巨噬细胞、T淋巴细胞在吞噬和免疫过程中都能产生大量氧自由基,激活氧化酶系统,而抗氧化能力未能相应提高[5]。过多氧自由基超出机体清除能力,造成氧化应激状态,致血管内皮细胞损伤,血管痉挛,从而表现为子痫前期的各种临床症状。
3.2 SOD、MDA及H2O2在子痫前期孕妇胎盘组织中表达的变化及意义
自Stark首次提出氧化应激在子痫前期的病理生理发展中存在潜在作用以来,越来越多的学者开始关注氧化应激与子痫前期发病的关系。氧化应激过程中生成的大量自由基、活性氧簇、脂质过氧化产物可参与疾病的发生发展。自由基可引起生物膜多价不饱和脂肪酸过氧化生成过氧化脂质,其代谢产物丙二醛(MDA)可与磷脂类物质DNA、RNA上碱基交联,使蛋白质变性,遗传信息突变,导致细胞膜广泛损伤[7]。超氧化物歧化酶(SOD)可催化氧自由基至H2O2的歧化转换成O2和H2O2起抗氧化作用,并可阻断MDA与核酸碱基的交联,阻止蛋白质变性失活[8]。二者均是常用的氧化应激指标。
研究显示,子痫前期患者外周血中抗氧化酶SOD含量减少,MDA含量增高[9]。Vanderlelie等[10]对子痫前期患者与正常妊娠妇女胎盘组织的氧化应激指标检测后发现,SOD、硫氧还蛋白还原酶、硫氧还蛋白等抗氧化酶及还原性谷胱甘肽等具还原性物质在子痫前期胎盘组织中显著减少;脂质过氧化指标MDA、4-HNE等含量明显增多,提示胎盘组织中抗氧化酶含量降低及氧化反应增强,与子痫前期的发生发展密切相关。
本研究结果也显示,子痫前期孕妇胎盘组织中SOD活力较对照组孕妇明显下降,MDA含量较正常妊娠组明显增高,与目前文献报道一致。SOD/MDA降低,表明子痫前期胎盘组织内自由基产生过多,超过体内抗氧化系统的代偿能力。同时,胎盘组织抗氧化能力降低,加重了氧化与抗氧化失衡。脂质过氧化过强,可改变细胞的流动性、通透性和抗原性,使细胞丧失正常生理功能,从而造成内皮细胞损伤,引起一系列临床病理表现。
3.3 子痫前期孕妇胎盘组织中H2O2含量变化与MIF水平的相关性
本研究采用RT-PCR技术检测MIF在子痫前期孕妇胎盘组织中的表达,发现其表达量显著高于对照组孕妇,同期检测到H2O2高于对照组孕妇,且MIF与H2O2的量存在正相关,表明MIF的增加导致机体清除H2O2能力下降。H2O2是氧化反应的产物,其含量增高进一步证实子痫前期局部组织氧化反应增强,且因H2O2作为信号分子的特殊身份,可能进一步影响细胞信号传导。本研究结果提示在子痫前期的发病过程中,MIF可能是通过调节H2O2的浓度在疾病发生发展过程中发挥作用。
子痫前期胎盘组织中MIF表达量的显著增加为子痫前期的发病机制氧化应激学说提供了新的证据,深入研究MIF在子痫前期中的作用机制及信号传导将有助于子痫前期疾病的防治。
[1] 钱中清,曾耀英,朱斌,等.子痫前期患者系统性氧化应激反应的检测[J].基础医学与临床,2010,30(4):343-347.
[2] 胡晓琳,潘平喜,杨丽,等.缺氧对大鼠血管平滑肌细胞表达巨噬细胞游走抑制因子的影响[J].四川大学学报(医学版)2009,40(2):260-262.
[3] Viganò P, Cintorino M, Schatz F, et al.The role of macrophage migration inhibitory factor in maintaining the immune privilege at the fetal-maternal interface[J]. Semin Immunopathol, 2007, 29:135-150.
[4] 乐杰.妇产科学[M].第7版.北京:人民卫生出版社,2009:92-99.
[5] Arcuri F, Buchwalder L, Toti P, et al.Differential regulation of colony stimulating factor 1 and macrophage migration inhibitory factor expression by inflammatory cytokines in term human decidua: implications for macrophage trafficking at the fetal-maternal interface[J]. Biol Reprod, 2007,76:433-439.
[6] Sankaralingam S,Arenas IA,Lalu MM,et a1.Preeclampsia:current understanding of the molecular basis of vascular dysfunction[J].Expert Rev Mol Med,2006,8(3):1-20.
[7] Lykkesfeldt J.Malondialdehyde as biomarker of oxidative damage to lipids caused by smoking[J].Clin Chim Acta,2007,380:50-58.
[8] Johnson F,GiuIivi C.Superoxide dismutases and their impact upon human health[J].Mol Aspects Med,2005,26:340-352.
[9] Zhou JF,Wang XY,Shangguan XJ,et a1.Increased oxidative stress in women with pregnancy-induced hypertension[J].Biomed Environ Sci,2005,18:419-426.
[10] Vanderlelie J,Venardos K,Clifton VL,et a1.Increased biological oxidation and reduced anti-oxidant enzyme activity in pre-eclamptic placentae[J].Placenta,2005,26:53-58.
