小鼠Reelin 基因启动子克隆鉴定及生物信息学分析*
2012-01-11张建军姜树原张颜波吴松泉牛敬忠
张建军 姜树原 张颜波 吴松泉 牛敬忠 邵 国
(1. 鄂尔多斯市康巴什新区医疗急救中心,内蒙古 鄂尔多斯 017000;2.包头医学院生物医学研究中心,内蒙古 包头 014010; 3.包头医学院基础医学院,内蒙古 包头 014010;4. 泰山医学院附属医院神经内科,山东 泰安 271000;5.丽水学院医学院,浙江 丽水 323000)
Reelin是与细胞外基质相关的巨大的糖蛋白,它在诱导海马突触可塑性中具有独特的作用,正常水平的Reelin对于成熟大脑的记忆形成是必需的[1],因此Reelin被众多的研究小组作为研究学习记忆的重要指标[2-3]。Reelin基因于1995年被克隆,鼠Reelin是非常大的一个基因,它有65个外显子,在基因组上跨度达到450 kb,Reelin的mRNA有12 kb长,其全长的表达产物有400 KDa大小[4],它还有300 KDa和180 KDa两种断裂产物[5-6]。Reelin的转录起始位点的上游的promoter区(G+C)含量非常之高,达到75%[4],而Reelin的promoter区甲基化的改变可以影响其表达[7-8]。本研究利用高保真PCR克隆了小鼠Reelin基因的启 动子区并分析了其甲基化情况及潜在的转录因子结合位点,为进一步构建特异表达载体及进一步研究甲基化对其转录表达调控奠定了基础。
1 材料与方法
1.1实验材料 昆明小鼠,Expand High Fidelity PCR System(Roche公司),EZ DNA Methylation-Gold Kit(zymo公司),rTaq(Takara公司),基因组DNA提取试剂盒(康为世纪),TA clone kit(invitrogen),DH5α 菌种等。
1.2引物设计 根据小鼠Reelin基因上游序列设计引物,Reelin-F: GGCCTGACTGGAAAGGGCTCG;Reelin-R: AAAGTGCCCGCCCCCTCC。预期扩增产物为450 bp。
1.3提取基因组DNA,PCR 扩增、T-A 克隆及测序 根据基因组提取试剂盒说明提取小鼠大脑中基因组DNA,将提取的基因组DNA用RNA酶消化后冻存备用。取0.5 μg基因组DNA作为模板,利用Expand High Fidelity PCR System进行扩增,扩增条件为94℃变性5 min; 94℃、30 s, 52℃、30 s, 72℃、30 s, 30个循环; 72℃延伸8 min。扩增结束后,加入rTaq及dNTP,72℃保温10 min,使PCR产物加上A。取1 μl PCR 产物,2 μl PCR-2.1载体在T4 DNA连接酶作用下连接16 h。转化感受态DH 5α细菌,通过蓝白斑筛选阳性克隆,提取质粒,经酶切鉴定质粒,对含正确插入片断的质粒测序。
1.4Reelin启动子区DNA甲基化情况分析 如1.3方法提取基因组DNA,使用EZ DNA Methylation-Gold Kit将5-mC转变成T,取1 μl产物为模板,正向引物:ATTACAACCRATATAAACAAAAAACAA;反向引物:AAGTTAGTGGGAGATYGAGGTTTT,扩增区域为转录起始点(-636bp~-135bp)区域。加入rTaq及dNTP进行PCR扩增。PCR产物如1.3进行TA克隆和测序。
1.5Reelin启动子区DNA甲基化位点及转录因子结合位点分析 利用ABI公司的Methyl Primer Express software V1.0软件,对克隆的序列进行CpG位点分析。利用转录因子结合位点预测软件TFSEARCH对Reelin启动子序列的特征性分析。
2 结 果
2.1小鼠Reelin启动子克隆及鉴定 以人基因组为模板,通过特异性上游引物和下游引物进行PCR扩增,扩增后加上A后与PCR 2.1载体经T4 DNA连接酶连接,连接产物转化感受态细菌。蓝白斑筛选挑取单克隆,扩大培养,提取质粒,经EcoRI酶切,琼脂糖凝胶电泳检查片段大小,可获得0.45 kb左右和3.9 kb 左右2个目的片段(图1)。表明目的片段已插入到表达载体。将酶切正确克隆送公司测序,测得序列与Genbank登记的人Reelin基因启动区完全相同即为正确的质粒(图2)。
2.2小鼠Reelin启动子区(-636 bp~-135 bp)DNA 甲基化状态 通过Bisulfite处理基因组后使5-mC转换成T,通过测序分析发现在PP1启动子区(-636 bp~-135 bp)没有CpG二核苷酸被甲基化,结果显示小鼠Reelin启动子区(-636 bp~-135 bp)处于非甲基化状态。
2.3小鼠Reelin启动子DNA甲基化位点分析 Methyl Primer Express software V1.0软件分析结果显示(图3),在小鼠启动起始点上游450 bp,G+C含量高达78.71%,CpG含量为14.44%,符合CpG岛特征,是潜在的DNA甲基化位点。
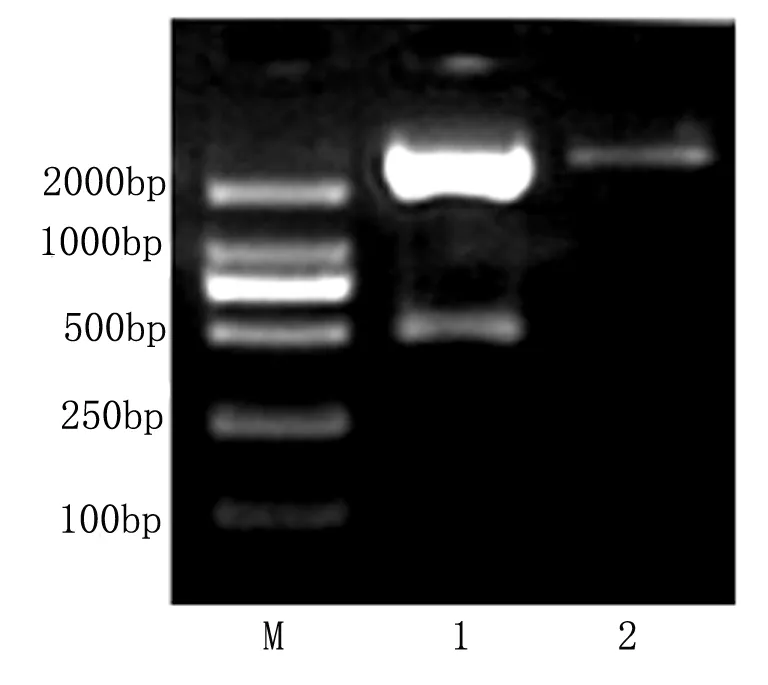
图1 PCR2.1-小鼠Reelin启动子区质粒EcoRI酶切电泳图

图2 PCR2.1-小鼠PP1启动子区质粒Blast结果
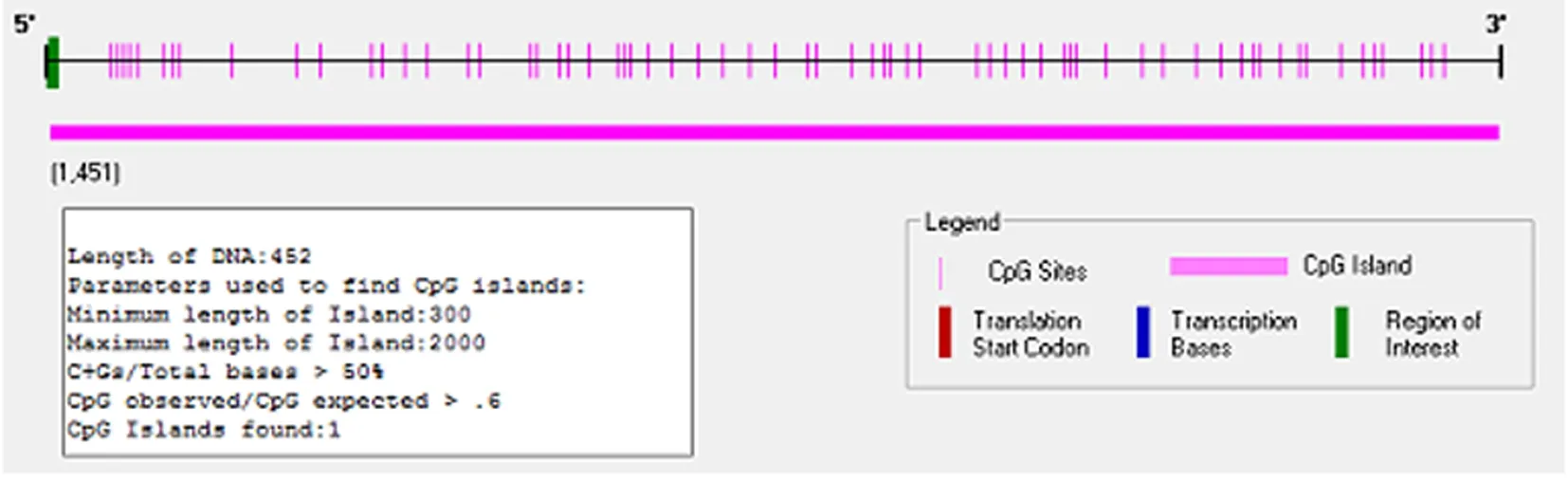
图3 Methyl Primer Express software V1.0分析Reelin启动子区
2.4小鼠Reelin启动子转录因子结合位点分析 启动子区转录因子结合位点预测发现,转录起始位点上游的450 bp 区域内含有大量的顺式调控元件,启动子附近可能结合的转录因子主要有: ADR1、 HSF、MZF1等。其中以ADR1 的结合频率最高,含有36个潜在结合位点。
3 讨 论
Reelin 蛋白在大脑发育过程中有着关键作用,Reelin基因表达异常与人类精神分裂有关,其5'非翻译区与其转录表达调控有密切关系[9]。小鼠ATG上游280 nt和298-299 nt有两个转录起始点,ATG上游500 nt的G+C含量相当高[4]。启动子区的甲基化可以影响基因表达调控,精神分裂症患者Reelin启动子高甲基化使得其表达下降[8]。作为哺乳动物大脑中具双重角色的可分泌丝氨酸蛋白酶的糖蛋白Reelin:胚胎发育过程中,引导神经原和神经胶质细胞到达正确位置;在成人的大脑,Reelin的信号通路参与神经传导的基础,记忆的形成和突触可塑性。通过突变和选择性的高甲基化Reelin基因启动子干扰Reelin的信号转导通路可能会导致神经精神障碍,如自闭症或精神分裂症的认知功能障碍[10]。
本研究克隆了小鼠Reelin基因启动子区上游450 bp 的片段,该区域富含G+C,G+C高达79%以上,同时CpG含量达到14%以上,软件分析其符合CpG岛特征。我们将该片段克隆到了PCR2.1载体上,该载体上有多克隆位点,容易将该片段亚克隆到pGL-3 basic中,为体外进一步研究其功能奠定了基础。在Reelin起始密码上游-636 bp~-135 bp范围内,没有CpG二核苷酸被甲基化,表明常氧情况下该区段是处于非甲基化的。在Reelin启动区上游450 bp范围内,有潜在的转录因子107个,其中ADR1的频率最高,达到了36个。USF结合位点为16个,SP1结合位点为13个,HSF结合位点为10个。我们克隆了该翻译起始点上游450 bp片段,并且分析了转录因子位点,为进一步通过定点删除来研究功能等奠定了基础。
Reelin是与学习记忆密切相关的蛋白,其表达与学习记忆能力相关。有报道低氧可以改变DNA甲基化状态[11],我们先前研究低氧预适应可以提高小鼠学习记忆能力[12],本工作为进一步探讨低氧预适应提高小鼠学习记忆能力的研究奠定了基础。
[1] Levenson JM, Qiu S, Weeber EJ. The role of reelin in adult synaptic function and the genetic and epigenetic regulation of the reelin gene[J]. Biochimica et biophysica acta,2008, 1779:422-431.
[2] Weeber EJ, Beffert U, Jones C, et al. Reelin and ApoE receptors cooperate to enhance hippocampal synaptic plasticity and learning[J]. The Journal of Biological Chemistry,2002, 277:39944-39952.
[3] Herz J, Chen Y. Reelin, lipoprotein receptors and synaptic plasticity[J]. Nature Reviews,2006, 7:850-859.
[4] Royaux I, Lambert de Rouvroit C, D'Arcangelo G, et al. Genomic organization of the mouse reelin gene[J]. Genomics,1997, 46:240-250.
[5] Haramati O, Mane R, Molczadzki G, et al. Magnesium sulfate treatment alters fetal cerebellar gene expression responses to hypoxia[J]. Int J Dev Neurosci,2010, 28:207-216.
[6] Golan MH, Mane R, Molczadzki G, et al. Impaired migration signaling in the hippocampus following prenatal hypoxia[J]. Neuropharmacology,2009, 57:511-522.
[7] Miller CA, Sweatt JD. Covalent modification of DNA regulates memory formation[J]. Neuron,2007, 53:857-869.
[8] Grayson DR, Jia X, Chen Y, et al. Reelin promoter hypermethylation in schizophrenia[J]. Proceedings of the National Academy of Sciences of the United States of America,2005, 102:9341-9346.
[9] Chen ML, Chen SY, Huang CH, et al. Identification of a single nucleotide polymorphism at the 5' promoter region of human reelin gene and association study with schizophrenia[J]. Molecular Psychiatry,2002, 7:447-448.
[10] Abdolmaleky HM, Cheng KH, Russo A, et al. Hypermethylation of the reelin (RELN) promoter in the brain of schizophrenic patients: a preliminary report[J]. Am J Med Genet B Neuropsychiatr Genet,2005, 134B:60-66.
[11] Shahrzad S, Bertrand K, Minhas K, et al. Induction of DNA hypomethylation by tumor hypoxia[J]. Epigenetics,2007, 2:119-125.
[12] Shao G, Zhang R, Wang ZL, et al. Hypoxic preconditioning improves spatial cognitive ability in mice[J]. Neuro-Signals,2006, 15:314-321.
