采用熔点曲线法研究乙肝病毒准种与拉米夫定临床耐药相关性
2012-01-11温志立王艳华张华张海明谭德明李庆安吴平邓乐
温志立,王艳华,张华,张海明,谭德明,李庆安,吴平,邓乐
(1.南昌市第九医院,江西南昌330008;2.南昌大学第三附属医院感染科,江西南昌330008;3.南昌市卫生学校,江西南昌330008;4.中南大学湘雅医院感染科,湖南长沙410008;5.中国人民解放军第163医院感染科,湖南长沙410008)
据世界卫生组织(WHO)报道,全球约20亿人曾感染过乙肝病毒(hepatitis B virus,HBV),其中3.5亿人为慢性感染者,每年约有100万人死于HBV感染所致的肝衰竭、肝硬化和原发性肝细胞癌[1]。近年来,由于拉米夫定等核苷类抗病毒药物的不断应用,一度给慢性乙型肝炎(chronic hepatitis B,CHB)的治疗带来曙光,但是由于在抗病毒治疗过程中不断出现的病毒耐药、停药后反弹等问题,给临床医师及患者带来许多困惑。2005年《慢性乙型肝炎防治指南》提出了HBV准种的概念,即将HBV感染者体内形成以一个优势株为主的相关突变株病毒群称为HBV准种[2]。国内外已有研究表明,HBV感染的慢性化、疾病转归及药物治疗耐受等都可能与HBV准种密切相关[3],例如拉米夫定等核苷类似物耐药的产生就与HBV P基因准种的变异有关,而且HBV P基因变异是多位点的,以YMDD基因的变异最为重要。因此,通过监测HBV P基因准种的变化有助于预测HBV对拉米夫定等核苷类似物的耐药。熔点曲线是通过动态检测双链DNA分子的熔点温度(Tm)进行单核苷多态性分析的一种分子生物学方法。当同一样本中存在不同的基因变异(或称准种)时,由于G/C含量变化导致Tm值可能改变,便可出现与准种数量相对应的几个波峰,该法操作简便,用于病毒准种检测准确可靠,之前已用熔点曲线分析了HBV准种和临床病情的相关性[4],取得了较好结果。为此,准备在之前基础上,采用熔点曲线技术从准种的角度来探索HBV对拉米夫定耐药机制,从而为临床抗病毒治疗提供指导。
1 材料与方法
1.1 材料
1.1.1 研究对象采用查随机数字表方法,从2008年3月至2009年11月期间在南昌大学第三附属医院感染科住院及门诊就诊的CHB患者中,随机选择30例接受拉米夫定抗病毒治疗后发生YMDD病毒变异的患者和30例停用拉米夫定后发生病毒学反弹的患者作为研究对象,同时随机选择30例没有接受拉米夫定抗病毒治疗的患者作为对照。在这90例病人中有男性73例,女性17例,年龄22~65岁,平均年龄(38.1±12.5)岁。为避免患者病情轻重不一给实验带来的干扰,所有病例均为CHB中度病例,均按照2010年全国肝炎会议最新修订的《慢性乙肝防治指南》[5]标准选择,而且血清HBsAg阳性至少6个月,剔除重叠HIV、HCV或HDV感染、自身抗体阳性、失代偿期肝病、甲亢患者、精神病患者及妊娠妇女,近6个月无抗病治疗史,甲状腺功能正常。病毒变异组和病毒反弹组患者均口服拉米夫定(葛兰素史克制药有限公司)抗病毒治疗,每次100 mg,每日1次,疗程均在1 a以上。所有患者均理解研究内容并签署知情同意书。收集所有90例患者的血清标本,保存于-70℃。
1.1.2 主要试剂DNA抽提试剂盒由上海达安基因公司提供;dNTPs(10 mmol/L,北京全式金公司);Taq DNA Polymerase(5 U/μL,美国NBI公司产品);Mg2+(10 mmol/L,美国NBI公司产品);10×Buffer缓冲液购自Fermantas公司;2%SYBR Green I荧光染料(美国Molecular proble公司提供);1 mmol/L的纯荧光素校准染料(Fluorescein Calibration Dye,美国BIO-RAD公司产品);用纯荧光素校准染料稀释缓冲液将其稀释1 000倍,配成1 μmol/L的稀释液。
1.1.3 引物参照温志立等[4,6]文献设计引物,其中引物P1、P2扩增P基因长片段(1 058 bp),引物C1、C2扩增C基因长片段(639 bp),引物S1、S2扩增S基因长片段(1 178 bp),均由上海生物工程科技公司合成(表1)。

表1 扩增HBV P基因、C基因和S基因的引物序列Table 1 Primer sequences for amplifying HBV P gene,C gene and S gene
1.1.4 主要仪器实时荧光PCR仪器(7300,美国ABI公司);金属干浴器(K30,深圳威斯比生物科技发展公司);低速台式离心机(TD5A-WS,长沙湘仪离心机仪器有限公司);超净化工作台(SW-CJ-IF型,苏州净化设备厂);-20℃冰箱(日本三洋公司);-70℃超低温冰箱(MDF-u208bs,日本三洋公司)。
1.2 方法
1.2.1 HBV-DNA提取取1.5 mL PCR管加入50 μL DNA提取液,再加入待测血清50 μL,震荡后混匀,置入金属干浴器,100℃10 min后取出,放置,待冷却至室温后置入离心机中,12 000 r/min离心10 min,取上清2 μL做为PCR反应模板。
1.2.2 荧光实时PCR及熔点曲线分析参照文献[7]进行。取0.2 mL PCR管,按下列体系加入:P1/C1/S1(50 pmol/L)0.5 μL,P2/C2/S2(50 pmol/L)0.5 μL,dNTPs(10 mmol/L)0.5 μL,Pulas Taq 0.5 U,Mg2+(25 mmol/L)2.0 μL,10×Buffer 2.5 μL,DNA模板0.5 μL,2%SYBR Green I 0.5 μL,自制荧光染料缓冲液0.5 μL,加DDW定容至25 μL。置入ABI7300实时荧光PCR仪中,按下列条件进行扩增:95℃预变性5 min,94℃60 s,58℃60 s,72℃60 s,共35个循环,最后72℃延伸7 min。扩增结束后按ABI7300PCR反应仪设定的条件进行熔点曲线分析,55℃开始收集荧光信号,直到95℃后结束。
1.2.3 统计学处理全部数据应用SPSS 13.0统计软件包处理,数据用¯χ±S表示,组间比较采用配对t检验,P<0.05表示有统计学意义。
2 结果与分析
拉米夫定治疗后病毒变异组患者体内HBV P区准种数量为2.50±0.86个,病毒反弹组为5.30±0.95个,未治疗组为8.37±0.93个。3组准种数量两两比较,P均小于0.05,有统计学意义。HBV C区病毒变异组准种数量为6.10±1.86个,病毒反弹组为6.37±1.81个,未治疗组为6.33±1.64个。3组准种数量两两比较,P均大于0.05,无统计学意义。HBV S区病毒变异组准种数量为5.23±1.85个,病毒反弹组为6.17±1.93个,未治疗组为5.77±2.11个。3组准种数量两两比较,P均大于0.05,无统计学意义(表2)。
表2 不同组别熔点曲线波峰数量比较(±S)Table 2 comparison of wave peak amounts among different groups
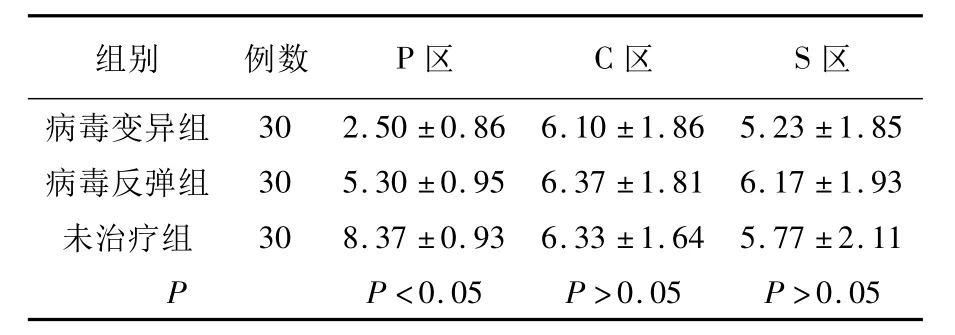
表2 不同组别熔点曲线波峰数量比较(±S)Table 2 comparison of wave peak amounts among different groups
组别例数P区C区S区302.50±0.866.10±1.865.23±1.85病毒反弹组305.30±0.956.37±1.816.17±1.93未治疗组308.37±0.936.33±1.645.77±2.11 P P<0.05P>0.05P>0.05病毒变异组
从3组患者的HBV P区熔点曲线图(图1~3)中还可以清晰地看到,病毒变异组优势病毒群的熔点与病毒反弹组和未治疗组相比,已发生明显的偏移,病毒反弹组和未治疗组优势病毒群的熔点均在75~80℃之间,而病毒变异组优势病毒群的熔点却在75℃以下。在3组患者的HBV C区和S区熔点曲线图中,3组的波峰数和优势病毒群的熔点均没有明显变化。
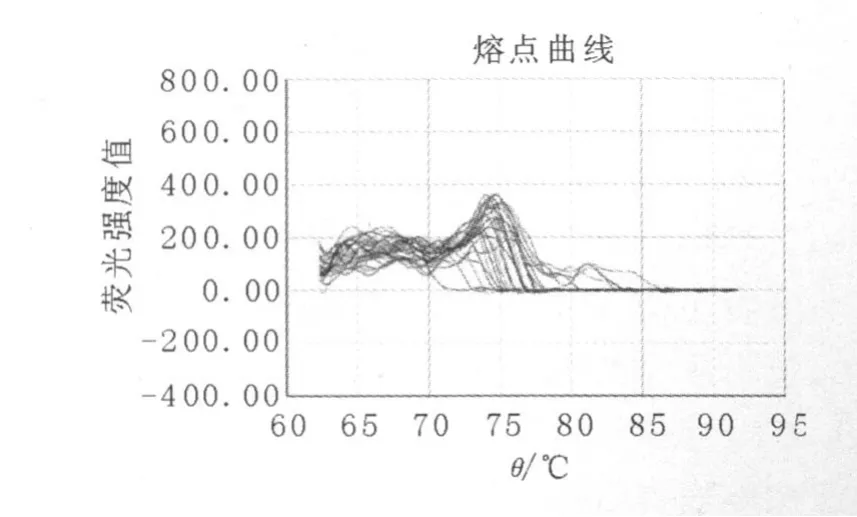
图1 病毒变异组HBV P区熔点曲线图Fig.1 Melt curve plot of HBV P gene in virus variation group
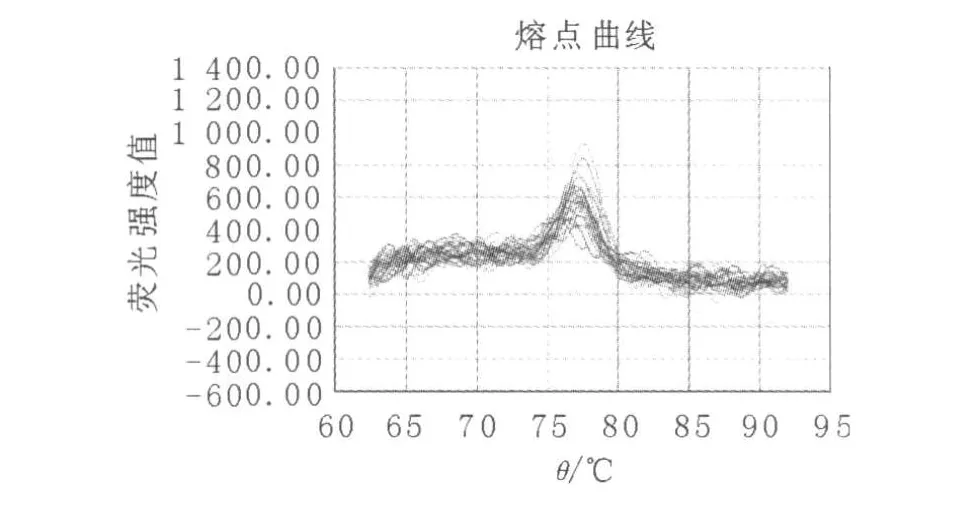
图2 病毒反弹组HBV P区熔点曲线图Fig.2 Melt curve plot of HBV P gene in virus rebound group
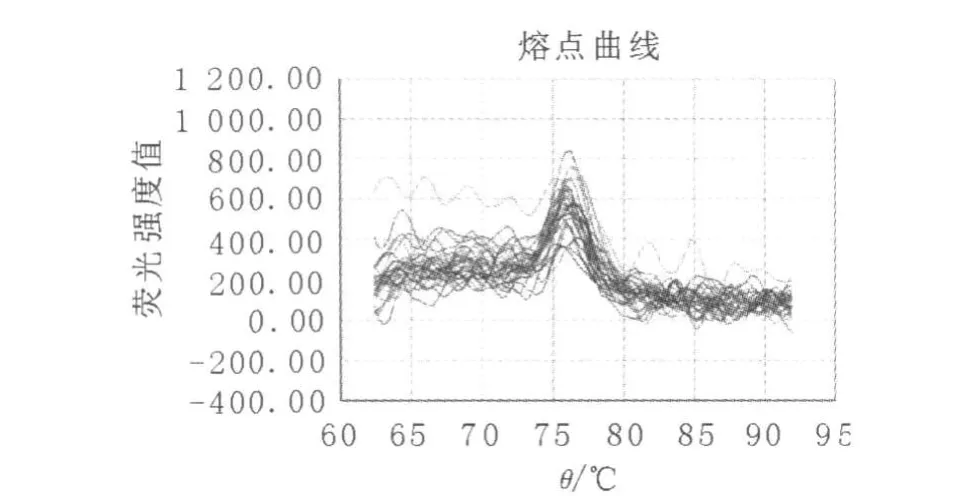
图3 未治疗组HBV P区熔点曲线图Fig.3 Melt curve plot of HBV P gene in non-treatment group
3 讨论
准种现象普遍存在于RNA病毒中,HBV虽属DNA病毒科,但同样存在准种现象,而且准种是乙型肝炎病毒存在的基本方式,其各编码区均存在准种。近年来研究发现,HBV准种与核苷类似物的耐药密切相关。2000年Richman[8]认为,HBV对某一抗病毒药物表现耐受其实是一个逐渐发展的过程。在未接受过核苷类药物治疗的患者中,HBV野生株占HBV准种的绝大多数,但耐药变异株在患者用药前就可能存在,也有可能在用药过程中产生。患者用药后,对药物敏感的病毒野生株受到抑制,含有耐药突变的准株得以有更多空间进行复制。当对某一药物有耐药性的病毒株成为准种中的优势病毒株时,药物就失去疗效。耐药株的复制能力和适应能力虽然较野生株弱,但在药物选择压力持续存在的情况下,产生许多代偿性突变株,使其复制能力增强,辅助耐药株成为准种的优势株[9]。由此可知HBV耐药株的产生过程其实就是耐药株从逆势种群向优势种群变迁的过程。
乙肝病毒准种可采用不同的方法来进行鉴定和分析,如聚合酶链反应-限制性内切酶切片段长度多态性分析(Polymerase Chain Reaction-Restriction Fragment Length Polymorphism,PCR-RFLP)法[10]、单链构象多态性(Single-Strand Conformation Polymorphism,SSCP)法[11]等。PCR-RFLP法对于限制性酶切点发生突变的检测十分有效,但对某些靶序列并不适合。SSCP是目前准种分析的主要手段之一,具有快速、简便、灵敏等特点,其原理基于点突变引起单链DNA分子立体构象的改变,通过电泳分离可鉴别,它可以检测各种点突变、短核苷酸序列的缺失或插入,但其工作量大,操作步骤烦琐,电泳条件要求较严格,而且当某些位置的点突变对单链DNA分子立体构象的改变不起作用或作用很小时,电泳就无法分辨。同SSCP相比,熔点曲线法是一种比较简便、实用的检测准种的方法,是通过动态检测双链DNA分子的熔点温度(Tm)进行单核苷多态性分析的一种分子生物学方法,其主要原理在于SYBR Green I是不对称腈类荧光素,一般不与单链DNA结合,但能非特异嵌合于DNA双螺旋结构中的小沟内,结合状态的荧光强度较之游离状态的荧光增加数千[7]。因此,只需要在扩增体系中直接加入SYBR Green I即可实时PCR定量及基因变异分析。当同一样本中存在不同的基因变异(或准种)时,由于G/C含量变化导致Tm值改变,便可出现与准种数量相对应的几个波峰。国外学者已经研究证实,溶点曲线方法操作简便,准确可靠,很好解决了其他准种鉴定方法所遇到的问题[12]。
本实验采用熔点曲线法分析了3种CHB患者体内HBV准种情况,包括HBV基因突变导致耐药患者、停药后发生病毒反弹患者和未经拉米夫定治疗患者,结果发现3组HBV P区准种数量有显著性差异(P<0.05),从小到大依次为病毒变异组、病毒反弹组和未治疗组,而且病毒变异组优势病毒群的熔点与病毒反弹组、未治疗组相比,已发生明显的偏移,这说明在拉米夫定压力下,HBV发生变异,不仅P区的准种数量明显减少,而且准种的性质也发生了明显的变化,这可能是由于一些耐药的劣势准种随着优势准种逐渐被杀灭,趁势大量繁殖而成为优势准种所致。黄燕萍等[11]应用SSCP/异源双链分析法研究了拉米夫定与HBV准种及变异特点的关系,发现拉米夫定治疗前HBV P区准种数量为7~14(平均9.8),高于治疗后准种数量4~8(平均5.7),并认为在拉米夫定药物筛选下HBV准种改变,同时出现YMDD序列变异,与本研究结果相似。Ohishi[13]用PCR-肽核酸钳法检测了CHB患者使用拉米夫定治疗前后的HBV准株,发现治疗前患者体内HBV准株数高于治疗后,但治疗后的优势准株数却高于治疗前。在长期使用拉米夫定过程中,当耐药突变株成为准种的优势株时,不仅可引起耐药,同时还可增加不良事件的发生概率。Lok[14]通过回顾性分析一项拉米夫定耐药安全性3期临床实验的数据后发现,相比于没有拉米夫定耐药的患者,耐药者有更高的肝炎复发比率。另外,经过对S区、C区准种进行分析,结果显示3组病人的HBV C区和S区准种数量均无显著性差异(P>0.05),优势准种的熔点也无明显变化,这说明拉米夫定对HBV S区、C区基本上没有作用,与国内外关于拉米夫定耐药位点的报道相符。
[1] Rybicka M,Stalke P,Charmuszko U,et al.The influence of hepatitis B virus polymorphism on the progression of chronic liver disease[J].Postepy Hig Med Dosw(online),2011,21(65):244-254.
[2] 中华医学会肝病学分会、感染病学分会.慢性乙型肝炎防治指南[J].中华肝脏病杂志,2005,13(12):881-891.
[3] 陈恩强,雷秉钧,唐红.乙型肝炎病毒准种的临床应用及其研究进展[J].世界华人消化杂志,2008,16(10):1086-1091.
[4] 温志立,谭德明,彭仕芳,等.熔点曲线法研究乙型肝炎病毒准种和临床表现的关系[J].中华肝脏病杂志,2006,14(1):19-22.
[5] 中华医学会肝病学分会、中华医学会感染病学分会.慢性乙型肝炎防治指南[J].中国病原生物学杂志,2011,6(1):67-77.
[6] 温志立,谭德明.多对型特异性引物巢式PCR检测湖南省乙肝病毒基因型[J].世界华人消化杂志,2004,12(2):332-335.
[7] Wang CY,Giambrone JJ,Smith BF.Detection of duck hepatitis B virus DNA on filter paper by PCR and SYBR green dyebased quantitative PCR[J].J Clin Microbiol,2002,40(7):2584-2590.
[8] Richman DD.The impact of drug resistance on the effectiveness of chemotherapy for chronic hepatitis B[J].Hepatology,2000,32(4):866-867.
[9] Locarnini S.慢性乙型肝炎抗病毒耐药及其处理[J].肝脏,2007,12(3):161-163.
[10] 刘妍,董箐,皇甫竞坤,等.乙型肝炎病毒核心启动子区基因异质性及对其转录活性的影响[J].解放军医学杂志,2002,27(2):128-130.
[11] 黄燕萍,王宇明,兰林,等.拉米夫定与乙型肝炎病毒准种及变异特点的关系[J].中华肝脏病杂志,2003,11(4):235-238.
[12] Hewson KA,Browning GF,Devlin JM,et al.Application of high-resolution melt curve analysis for classification of infectious bronchitis viruses in field specimens[J].Aust Vet J,2010,88(10):408-413.
[13] Ohishi W,Shirakawa H,Kawakami Y,et al.Identification of rare polymerase variants of hepatitis B virus using a two-stage PCR with peptide nucleic acid clamping[J].J Med Virol,2004,72(4):558-565.
[14] Lok AS,Lai CL,Leung N,et al.Long-term safety of lamivudine treatment in patients with chronic hepatitis B[J].Gastroenterology,2003,125(6):1714-1722.
