美伐他汀发酵菌种筛选和发酵条件优化
2012-01-11胡一峰曹一岚黄俊龙
胡一峰 曹一岚 黄俊龙
(浙江震元制药有限公司,浙江 绍兴 312000)
胆固醇是甾醇类激素和胆汁酸的前体,对维持细胞膜的完整性和生物体的健康至关重要。然而,低密度脂蛋白(LDL)胆固醇含量过高时,可沉淀在动脉血管壁导致心血管病的发生,心血管病疾病是发达国家导致死亡的两大疾病之一。人体有两种胆固醇来源,一是膳食胆固醇在肠胃道经酰基CoA-胆固醇酰基转移酶(ACAT)酯化生成,二是由酰基CoA经甲基戊酸途径在肝中合成。肝中生物合成的胆固醇约占总胆固醇的60%~70%,所以它是降脂治疗的首选目标。他汀类药物是20世纪80年代后期国外上市的调血脂治疗药,是调节高胆固醇血症、降低低密度脂蛋白、降低甘油三酯、提升高密度脂蛋白最有效的药物[1-4]。从1987年首次面市以来,其市场销售保持强劲增长势头。90年代以来,他汀类药物的年销售额都以20%的年平均增长率高速增长。90年代中期以后,每年都有三种他汀类药物进入世界十大最畅销的治疗心血管药物行列。据不完全统计,全球开发的他汀类药物已有12个品种,在我国市场上已有8个品种,分别是阿托伐他汀、辛伐他汀、普伐他汀、氟伐他汀、洛伐他汀、美伐他汀、瑞舒伐他汀和匹伐他汀[4-5]。
美伐他汀是桔青霉在发酵过程中的一种代谢产物,存在于菌丝中,属HMG-CoA还原酶抑制剂,其作用是竞争性抑制HMG-CoA还原酶,该酶是胆固醇生物合成的限速酶,对哺乳动物和动物培养细胞的甾醇生物合成都有明显的抑制作用[6]。美伐他汀于1976年由Akira Endo从真菌Penicillium Citrinum发现,并于1976年由A.G.Brown从Penicillium brvicompactum中单独分离出来,其分子式为C23H24O5,分子量为390.52。作为第1个被发现的他汀类药物,美伐他汀在该类药物的研究开发上占有极其重要的地位。对美伐他汀产生菌的研究可以有效地提高美伐他汀的产量。我们对本公司保藏的美伐他汀生产菌进行了系统地筛选和诱变,获得了传代稳定的高产菌株,并对该菌株的培养条件进行了研究。
1 材料和方法
1.1 菌株
出发菌株桔青霉NS-3-16,为本公司所收集和保藏。
1.2 培养基
斜面培养基:蛋白胨1.0,黄豆粉1.0,硝酸钠0.2,硫酸镁0.1,葡萄糖4.0,琼脂2.0,pH 6.0,121℃蒸汽灭菌30min;
摇瓶培养基:蛋白胨1.0,黄豆粉2.0,硝酸钠0.2,硫酸镁0.1,蔗糖10,pH 6.0,121℃蒸汽灭菌30min;
发酵培养基:蛋白胨1.0,黄豆粉2.5,硝酸钠0.2,硫酸镁0.1,蔗糖20,泡敌0.1,pH 6.0,121℃蒸汽灭菌30min;
1.3 培养条件
1.3.1 斜面培养条件
24±1℃恒温培养培养箱9~11d。
1.3.2 摇瓶发酵培养条件
转速230~250r/min的摇床上培养,24±1℃培养3~4d。
1.3.3 50L发酵罐发酵培养条件
装量(消后体积):20L;接种量:1L(5%);培养温度:24±1℃;通风量:1:1~1.2;罐压:50kPa;转速:100~300r/min,若溶氧低于40%,则小幅度提高转速,并注意泡沫情况;发酵前期注意泡沫情况,及时滴加泡敌,防止逃液。
1.4 筛选方法
取出发菌株冷冻管,置室温融化,在无菌条件下,取0.1mL冷冻菌液至斜面,涂布均匀。于24±1℃恒温培养箱中培养9~11d,即得母斜面种子。
在母斜面中加入5mL生理盐水,将菌丝体洗下,搅匀,取0.1mL菌悬液至子斜面,涂布均匀。于24±1℃恒温培养箱中培养9~11d,即得子斜面种子。
在子斜面中加入5mL无菌蒸馏水,将菌丝体洗下,震荡均匀,并逐步稀释到10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8。
(1)自然筛选
每个稀释度涂6~10块平板(¢9cm,加30mL培养基/只),每块平板加0.1mL菌悬液,涂布均匀后贴上菌种标签,于24±1℃恒温培养箱中培养9~11d。
24±1℃培养9~11d后,典型的单菌落具有以下特征:
直径:1~5mm
形状:菌落丰满,有较多皱凸,黄色。
用无菌接种环挑取符合要求的单菌落接种到已配制好的空白斜面培养基上,用"之"型均匀涂布,盖紧塞子,用一层纱布包扎,并贴上菌种标签,于24±1℃恒温培养箱中培养9~11d。
斜面种子质量要求:斜面菌层丰满,有较多皱凸,黄色,无杂菌。
每支斜面种子做摇瓶考察,生产能力高的埋冷冻管,再做复筛。
(2)紫外筛选
取各稀释度菌悬液4mL置于培养皿,无菌条件下以紫外灯30cm距离照射30s,照射后的菌悬液涂筛选平板,24±1℃恒温培养箱中培养9~11d后,挑选单菌落进行筛选。
1.5 分析方法
1.5.1 菌浓测定:
取10mL发酵液离心,4000r/min,15~30min测上清液体积V,计算公式如下:菌浓(%)=(10-V)/10×100%。
1.5.2 总糖测定(DNS法)
(1)水解:取1mL发酵上清液,加入0.2mL 6mol/L的HCl,沸水浴5min,将发酵液中的糖分充分水解成还原糖;
(2)中和:取5mol/L NaOH逐滴加入,用中性pH试纸检测,显示中性偏碱即可。
(3)定容:粗略估计发酵液含糖量,用蒸馏水稀释成相应倍数,待测;
(4)还原糖测定:取带测样液1mL(含糖3~4mg),分别置于25mL容量瓶中,各加入DNS试剂2mL,置于沸水浴中煮两分钟进行显色,然后以流水迅速冷却,用水定容到25mL,摇匀;以空白调零,在540nm处测定吸光度,据标准曲线计算样品中总糖含量。
1.5.3 美伐他汀测定
1.5.3.1 萃取
方法1:发酵液搅拌均匀,取5mL于250mL三角瓶中,加入20mL甲醇,密封瓶口,震摇15min,静置5min。
方法2:发酵液搅拌均匀,取10mL于250mL三角瓶中,加入40mL醋酸乙酯,密封瓶口,磁力搅拌2h。
1.5.3.2 稀释定容
取上清液1mL,用乙腈定容到10mL容量瓶;如有浑浊,HPLC进样前用膜过滤。
1.5.3.3 HPLC测含量
色谱柱:C18,5u(4.6×250mm)
流动相:CAN:0.1%磷酸(70:30)
检测器:UV237nm
流速:1.0mL/min
标准溶液:准确称取美伐他汀标准品,加乙腈溶解,浓度0.1mg/mL左右。
2 结果与讨论
2.1 美伐他汀生产菌的选育
以桔青霉NS-3-16为出发菌株,经紫外诱变及平板筛选后,共得121株变异菌株,经摇瓶筛选、复筛,共得27株高产菌株,其中9株MV产量9g/L以上,与出发菌株的对照见表1。
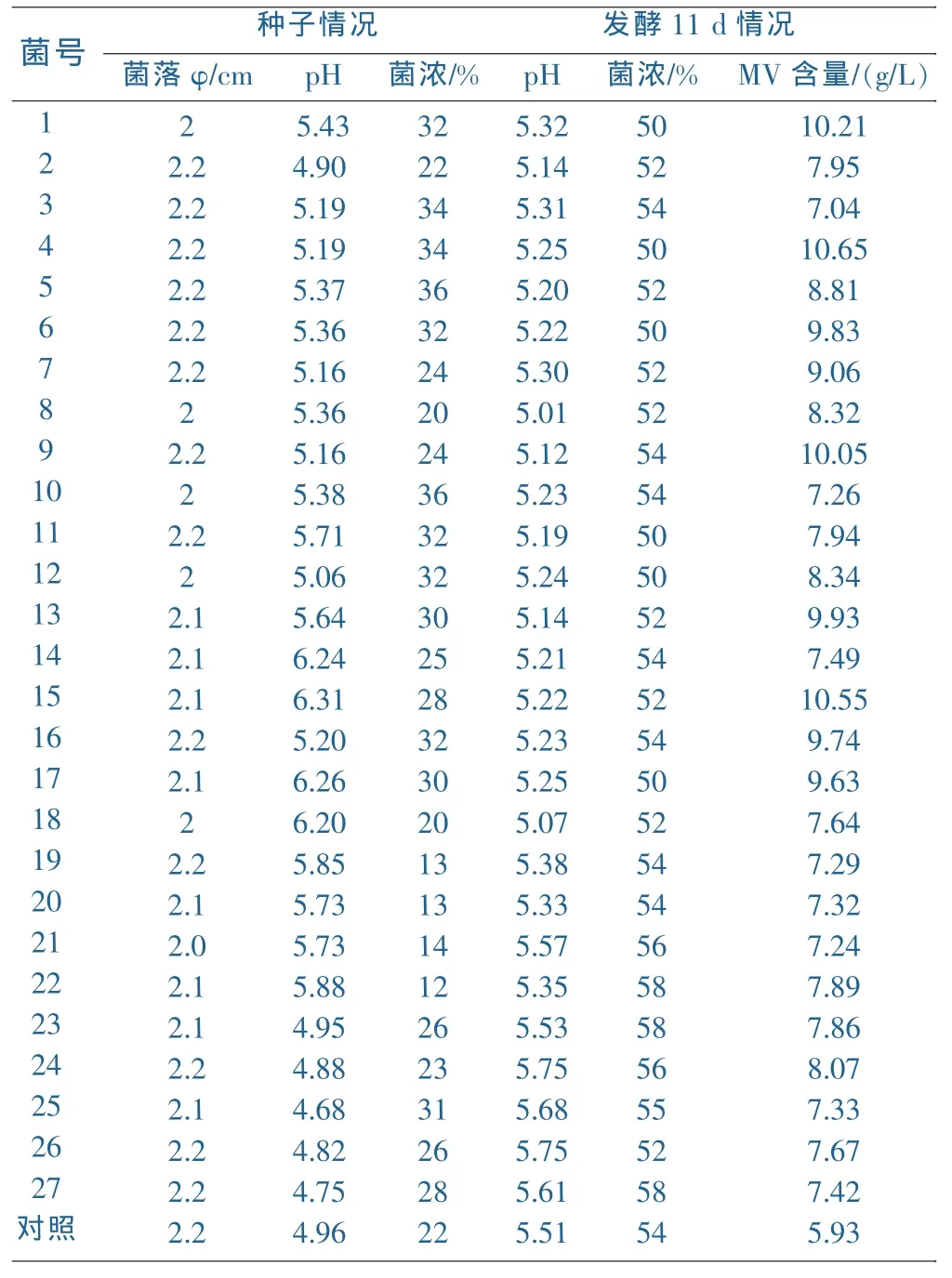
表1 复筛后斜面种子摇瓶考察结果
选出NS-7-04作为进一步研究的试验菌,NS-7-04菌株的选育谱系图见图1。

图1 NS-7-04菌株的选育谱系图
2.2 50L发酵罐发酵试验
在50L自控发酵罐上对NS-7-04菌株发酵过程进行了初步观察,结果如表2和图2~图4。

表2 50L发酵罐发酵试验

图2 第一批50L发酵罐发酵全过程

图3 第二批50L发酵罐发酵全过程

图4 第三批50L发酵罐发酵全过程
3 结论
(1)以桔青霉NS-3-16为出发菌株,经紫外诱变及平板筛选后,经摇瓶筛选、复筛,选育出高产菌株NS-7-04,与出发菌株NS-3-16相比较,其美伐他汀产率提高了52%。
(2)根据对培养条件的初步研究结果,得出较优培养条件为:培养基初始pH 6.0,培养温度24℃,每分钟通风量1:1(体积比),罐压50kPa,发酵时间9~11d,发酵液中的美伐他汀含量最高可达9.25g/L。传代试验表明该菌株产美伐他汀能力和性状较稳定。
[1]张文琦,胡昌华.美伐他汀产生菌橘青霉原生质体的制备与再生[J].西南大学学报(自然科学版),2009,31(5):117-120.
[2]程文娟,杨大鹏,顾丰颖,等.微生物发酵产生他汀类化合物的研究进展[J].农产品加工(学刊),2011,(2):76-80.
[3]郄丽萍,张玉莲,陈丽华,等.美伐他汀产生菌的原生质体诱变育种[J].河北化工,2007,(4):32-33.
[4]吴惠芳.他汀类药物整装待发[N].医药经济报,2004-05-24(B2).
[5]倪文昊.他汀类原料药出口百花齐放[N].医药经济报,2005-04-20(C4).
