利用5-氨基乙酰丙酸脱水酶缺失的重组大肠杆菌合成5-氨基乙酰丙酸
2012-01-10郭小飞陈久洲张莉露贾士儒
郭小飞,陈久洲,张莉露,贾士儒,郑 平
(1. 天津科技大学生物工程学院,天津 300457;2. 中国科学院系统微生物工程重点实验室,天津 300308;3. 中国科学院天津工业生物技术研究所,天津 300308)
利用5-氨基乙酰丙酸脱水酶缺失的重组大肠杆菌合成5-氨基乙酰丙酸
郭小飞1,2,3,陈久洲2,3,张莉露2,3,贾士儒1,郑 平2,3
(1. 天津科技大学生物工程学院,天津 300457;2. 中国科学院系统微生物工程重点实验室,天津 300308;3. 中国科学院天津工业生物技术研究所,天津 300308)
生物法合成 5-氨基乙酰丙酸(5-ALA)大多通过添加 5-ALA脱水酶(ALAD)的抑制剂乙酰丙酸(LA)减少 5-ALA的降解,造成生产成本增高,发酵工艺复杂.本文利用ALAD缺失的大肠杆菌ZSEc2作为出发菌株,通过紫外诱变的方法,获得可利用外源血红素恢复正常生长的大肠杆菌突变株 ZGEc1,并过表达来自沼泽红假单胞菌的 5-ALA合成酶(ALAS)基因,最终建立一条不需要添加ALAD抑制剂的5-ALA的生物合成新路线.经过培养基初步优化,重组菌可在胞外积累约1,g/L的5-ALA.
5-氨基乙酰丙酸;5-ALA脱水酶;5-ALA合成酶;沼泽红假单胞菌
5-氨基乙酰丙酸(5-aminolevulinic acid,5-ALA)是生物体合成血红素、叶绿素、VB12等四吡咯化合物的必需前体,广泛存在于动物、植物和微生物中[1-2].近年来,5-ALA不但在医药领域可以作为光动力试剂治疗浅表型癌症[3],而且在农业上可以用作无公害的杀虫剂、除草剂和植物生长促进剂[4],因而引起了人们的广泛关注.目前,5-ALA生产主要依赖化学合成,成本高,收率低,也使得 5-ALA的价格高居不下(工业级5-ALA 600美元/千克,医药级最高达800美元/克),并且存在严重的环境问题.近年来,研究者们把目光纷纷投向生物法合成5-ALA.
生物体内5-ALA的合成途径有两种,分别是C4途径和 C5途径[5–6].目前生物法生产 5-ALA 大多利用重组外源 C4途径的大肠杆菌(Escherichia coli)来实现.C4途径主要存在于动物、真菌和一些紫色光合细菌中,以琥珀酰辅酶 A和甘氨酸为底物,通过 5-ALA 合成酶(5-aminolevulinic acid synthase,ALAS)一步催化合成 5-ALA.生物体中 5-ALA向下代谢的第一个酶是hemB编码的 5-ALA脱水酶(5-aminolevulinic acid dehydratase,ALAD),催化两分子5-ALA脱水形成一分子胆色素原(porphobilinogen,PBG)[7].目前生物法合成 5-ALA大多采用添加ALAD抑制剂乙酰丙酸(levulinic acid,LA)的策略来降低 5-ALA 的代谢[8–9],但 LA 价格昂贵,且主要通过化学合成法制备,造成5-ALA生产成本增加,发酵工艺复杂.近期 Liu等[8]尝试添加廉价的葡萄糖作为ALAD抑制剂替代 LA,但葡萄糖既是菌体生长的碳源,又是 5-ALA合成酶的抑制剂,作用机理复杂,难以精确控制.降低 5-ALA在胞内继续代谢的另一条策略来敲除ALAD的编码基因hemB,但以往的知识认为该基因是必需基因不能完全缺失,而且野生型大肠杆菌不具备摄入外源血红素的能力,不能通过直接添加终产物血红素的方式维持生长[10].但本研究室的前期工作显示 hemB缺失的大肠杆菌 ZSEc2可以在普通LB培养基上生长,但是与野生菌相比生长显著变慢[11].而 McConville等[12]的研究表明通过诱变可以使大肠杆菌获得摄入外源血红素的能力,这就使得利用ALAD缺失突变株生产5-ALA成为可能.
基于以上设想,本文探索了一种利用 ALAD缺失的重组大肠杆菌合成 5-ALA的方法.首先通过对hemB缺失的大肠杆菌 ZSEc2紫外诱变获得了在外加血红素的条件下能够正常生长的大肠杆菌突变株,并以此为基础过表达来自沼泽红假单胞菌(Rhodopseudomonas palustris)ATCC 17001的ALAS基因,构建的工程菌通过正交实验对培养基进行优化后,胞外 5-ALA积累量明显提高,为生物法合成 5-ALA提供了一条新路线.
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
大肠杆菌 MG1655、ZSEc2(MG1655ΔhemB)和沼泽红假单胞菌 ATCC 17001菌株以及表达载体pET21a和pTrc99A均为实验室保存.pEasy-Blunt购自北京全式金生物技术有限公司.
1.1.2 培养基
LB 培养基:酵母提取物 5,g/L,蛋白胨 10,g/L,氯化钠10,g/L(固体培养基额外加2,g/L的琼脂粉).氨苄青霉素(Amp)终质量浓度为100,mg/L,异丙基硫代-β-D-半乳糖苷(IPTG)终浓度为 0.1,mmol/L,没有特别说明时氯化血红素(hemin)终浓度为40,µmol/L,正交实验优化前发酵培养基中琥珀酸终质量浓度10,g/L,甘氨酸终质量浓度2,g/L.发酵培养基主成分为LB培养基成分.1.1.3 工具酶及试剂
DNA聚合酶,北京全式金生物技术有限公司;限制性内切酶、DNA 连接酶,Fermentas公司;质粒小提试剂盒及DNA胶回收试剂盒,Biomiga公司;蛋白定量试剂盒(Pieree’s BCA Assay Kit),Pierce 公司;基因组提取试剂盒,北京索莱宝科技有限公司.酵母浸出物和胰蛋白胨,英国 Oxoid公司;甘氨酸和IPTG,Promega公司;5-ALA、酰基-CoA、对二甲氨基苯甲醛等,Sigma公司;氯化血红素,上海生工生物工程有限公司;琥珀酸钠、葡萄糖、冰醋酸、高氯酸、三氯乙酸、乙酰丙酮、氯仿以及其他常用化学试剂,国药集团化学试剂有限公司.
1.2 实验方法
1.2.1 ZSEc2紫外诱变和突变株的筛选
紫外诱变方法参考文献[13].出发菌株为hemB缺失的大肠杆菌 ZSEc2,一级种子液过夜培养,以1∶100比例转接,收集生长对数前期菌液,生理盐水洗 2次,并用生理盐水制备成菌悬液(A600=0.2).将菌悬液注入直径为 9,cm无菌培养皿中,每个平皿4,mL,紫外灯功率为 8,W,将平皿固定于紫外灯下40,cm 处,紫外照射时间分别为 0、10、20、30、40、50,s,然后采用 10倍逐级稀释的方法在 LB平板涂布,进行菌落计数,选择致死率为 80%左右的诱变剂量进行操作.诱变菌液稀释后,涂布血红素浓度为40,µmol/L的 LB平板,选择生长变快的菌落进行PCR验证和生长比较[14].将诱变菌株分别接种添加不同浓度血红素(10~70,µmol/L)的 LB 培养基中,37,℃培养,测定生长曲线,比较不同血红素浓度对突变株生长的影响.
1.2.2 沼泽红假单胞菌基因组DNA的提取
沼泽红假单胞菌基因组的提取方法参照索莱宝试剂盒说明书.
1.2.3 沼泽红假单胞菌 ATCC17001的,ALAS基因PCR扩增
通过已发表的同属的ALAS基因及其上下游序列的比对,设计并合成以下通用引物,上游引物序列为5′-TC(T)AACGGGAGGACA(G/T)TCATGAA-3′,下游引物序列为 5′-CAGCAACGAGACCATCAAGCA-3′.DNA 聚合酶为北京全式金公司的 Fastpfu,PCR扩增参数为 94,℃ 2,min;94,℃ 20,s,60,℃ 20,s,72,℃1,min,循环 30次;72,℃延伸 5,min.PCR产物经 1%琼脂糖凝胶电泳检测并用胶回收试剂盒回收后,连接载体 pEASY-Blunt,转化大肠杆菌 DH5α,涂布在含Amp的 LB固体培养基上,蓝白斑筛选后,挑选阳性克隆接于 5,mL LB培养基中过夜培养,质粒提取验证并测序.
1.2.4 ALAS表达载体构建及其在大肠杆菌中表达
根据测序所得基因序列,重新设计引物扩增ALAS编码基因,上游引物 5′-GCGCATATG AAT TACGAAGCCTATTTCCGCCGT-3′(下划线为 NdeI酶切位点),下游引物 5′-CTTAAGCTT TCAGTGG TGGTGGTGGTGGTGGGCCGCCTTGGCGAGACC GAC-3′(下划线为 HindⅢ酶切位点).PCR 扩增参数为 95,℃ 2,min;95,℃ 20,s,65,℃ 20,s,72,℃ 1,min,循环 30次;72,℃延伸 5,min.PCR产物回收后用 NdeI和HindⅢ双酶切并纯化,以适当比例与NdeI和HindⅢ双酶切的pET21a载体连接,转化DH5α感受态细胞,涂布含有Amp的LB平板,挑取阳性克隆提取质粒并进行 PCR和酶切验证.测序正确的重组载体命名为 pET21a-ALAS.用 XbaI和 HindⅢ对 pET21a-ALAS双酶切,纯化回收 ALAS基因片段,以适当比例与XbaI和HindⅢ双酶切的pTrc99A载体连接,转化DH5α,涂布含有Amp的固体LB平板,验证正确载体命名为 pTrc99A-ALAS并分别转入大肠杆菌MG1655、ZSEc2和诱变所得菌株.
1.2.5 蛋白电泳及酶活测定
重组菌株挑单菌落过夜培养,再按初始接种量为A600=0.05转接新鲜的LB培养基,当吸光度约为0.5时,加入终浓度为 0.1,mmol/L的 IPTG,28,℃诱导过夜,离心收集菌体.菌体用50,mmol/L pH 7.0磷酸钾缓冲液冲洗 2次,悬浮超声破碎,冷冻离心后取上清液用于 SDS-PAGE和酶活分析.蛋白定量方案参见 BCA蛋白定量试剂盒说明书.酶活分析参考文献[6],酶反应液包括 50,mmol/L Tris-HCl、20,mmol/L MgCl2、0.1,mol/L琥珀酸钠、0.1,mol/L甘氨酸、0.1,mmol/L磷酸吡哆醛、15,mmol/L ATP、0.2,mmol/L辅酶 A,pH 为 7.5,加入一定量的粗酶液,37,℃反应10,min,加入 1/2体积 10%的三氯乙酸终止反应,离心取上清液进行5-ALA定量,1个酶活力单位(U)定义为每分钟产生1,nmol/L 5-ALA所需要的酶量.
5-ALA 含量分析按照文献[15].200,μL 样液加入100,μL pH 4.6乙酸缓冲液,加入5,μL乙酰丙酮,100,℃水浴 15,min,冷却至室温加等体积的 Ehrlish’s试剂(42,mL冰醋酸,8,mL 70%高氯酸,1,g二甲氨基苯甲醛),显色 10,min后测 553,nm 波长下的吸光度.
1.2.6 血红素浓度对突变株胞外5-ALA含量的影响
含有 pTrc99A-ALAS的突变株挑单克隆过夜培养,再按初始接种量为A600=0.05转接含琥珀酸和甘氨酸以及不同浓度血红素(10~60,µmol/L)的 LB 培养基中,37,℃培养至菌体生长前对数期添加 IPTG,28,℃诱导 16,h,测定发酵液中 5-ALA 的含量,比较不同血红素浓度对5-ALA产量的影响.
1.2.7 发酵培养基成分优化
为了改善重组菌在发酵培养基中的生长状况,进一步提高胞外 5-ALA的积累量,确定底物以及碳源的最适添加浓度,本研究参考近几年生物发酵合成5-ALA的文献[16-19],确定了对菌体生长和 5-ALA合成影响较大的3个因素:甘氨酸、琥珀酸、葡萄糖,并设计正交实验对各因素进行评价.在 LB培养基中,添加琥珀酸、甘氨酸以及葡萄糖.以甘氨酸、琥珀酸和葡萄糖质量浓度为考察因素,选取 3个水平,做 3因素3水平正交实验.
2 结果与分析
2.1 突变株的验证及培养条件确定
实验室前期获得的hemB结构基因缺失的ZSEc2菌株,在 LB培养基中可以生长,但与野生型相比非常弱,不能直接用于合成 5-ALA,因此首先对该菌株进行优化改造,使其获得摄入外源血红素的能力,能够利用外源血红素恢复生长.首先对ZSEc2菌株进行紫外诱变,将紫外照射的菌体涂布含氯化血红素的LB平板,大肠杆菌K12菌株不能利用外源血红素,在筛选平板上不能恢复正常生长,而获得摄入外源血红素能力的突变株可以恢复生长.在平板上挑取 4个生长明显加快的单克隆,分别编号为ZGEc1~ZGEc4进行菌落 PCR验证,结果如图 1所示.核酸凝胶电泳结果显示获得的 4株突变菌株ZGEc1~ZGEc4的目的片段大小为 600,bp,与hemB缺失菌株ZSEc2结果一致,而含有完整hemB基因的MG1655片段大小为1,410,bp,说明 4个生长变快的诱变菌株仍然为hemB基因缺失突变株.
对 ZGEc1~ZGEc4进行生长比较,发现 4个菌株都基本恢复正常生长,本研究选取生长最好的ZGEc1作为后续实验的出发菌株.对诱变获得的突变株 ZGEc1以及对照菌株 MG1655和 ZSEc2进行生长状态的比较,结果如图 2所示.与出发菌株ZSEc2相比,ZGEc1在含有血红素的LB培养基中生长明显加快,而图 3显示外源血红素浓度在20,µmol/L以上即可使菌体生长恢复,以上结果说明诱变使得 ZGEc1获得摄入外源血红素的能力,在外源血红素存在的条件下生长良好,可以用于后续5-ALA工程菌的构建.

图1 菌落PCR验证核酸电泳图Fig. 1 Electrophoresis of colony PCR confirmation

图2 MG1655、ZGEc1和ZSEc2在LB与LB添加血红素培养基中生长比较Fig. 2 Growth comparison of MG1655,ZGEc1 and ZSEc2 incubated in LB or LB with hemin
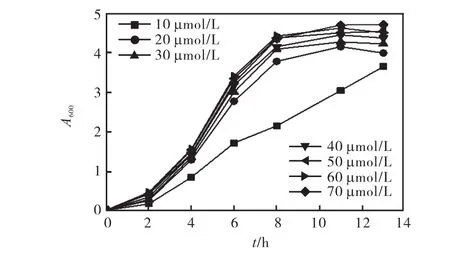
图3 血红素浓度对ZGEc1生长的影响Fig. 3 Effect of hemin concentration on the growth of ZGEc1
2.2 沼泽红假单胞菌ALAS基因的克隆及表达
通过 NCBI数据库搜索,设计简并引物,以沼泽红假单胞菌ATCC 17001基因组DNA为模板,PCR扩增得到与预期大小相近的片段(图 4).测序发现ATCC 17001的,ALAS基因的核酸序列(GenBank登陆号:JQ048720)与沼泽红假单胞菌 BisB5,hemA基因的核酸序列相似性为 99%,氨基酸序列完全一致.将获得片段插入表达载体 pTrc99A,构建了带有沼泽红假单胞菌ATCC 17001的ALAS基因的重组载体pTrc99A-ALAS.

图4 沼泽红假单胞菌ALAS基因片段PCR扩增电泳图Fig. 4 Electrophoresis of the amplified ALAS encoding gene product
重组载体pTrc99A-ALAS转化大肠杆菌MG1655和ZGEc1.验证正确后诱导表达,结果如图5所示.
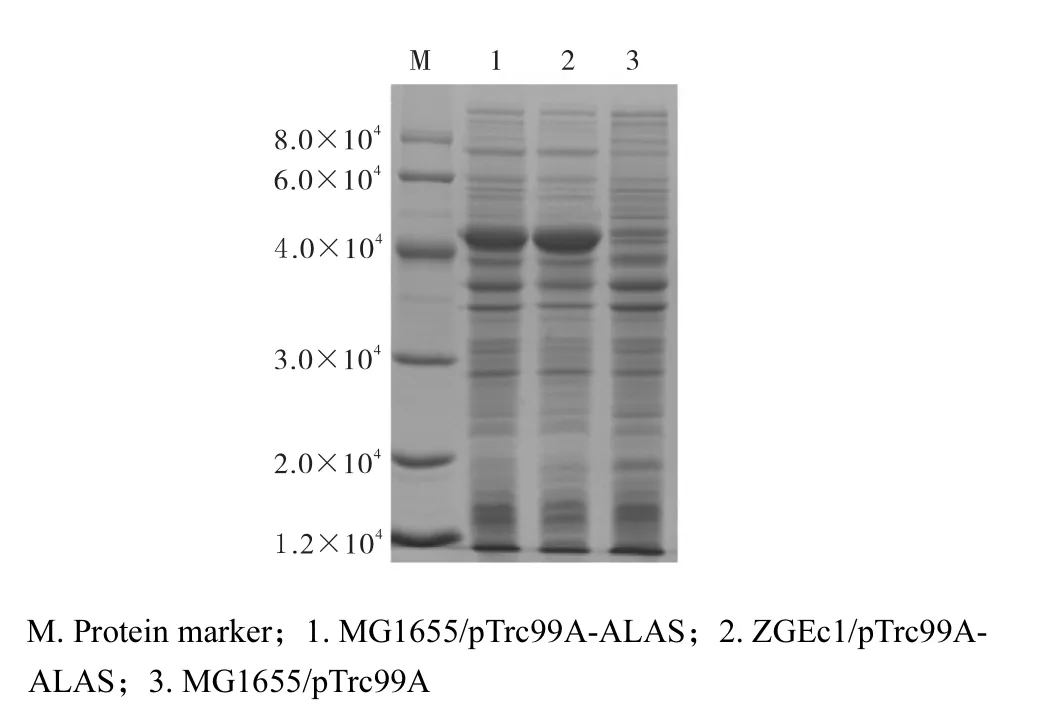
图5 ALAS在MG1655及ZGEc1中表达的SDS-PAGE图谱Fig. 5 SDS-PAGE of ALAS expressed in MG1655 and ZGEc1
从SDS-PAGE结果(图 5)可以看出ALAS在ZGEc1和MG1655中都能表达,且表达强度基本一致,粗酶液中ALAS的酶活分别为14.6、13,U/mg,表明hemB缺失及后续的紫外诱变对外源 ALAS的表达和活性没有太大影响.
2.3 外源血红素浓度对胞外5-ALA积累的影响
由于 ALAS受代谢终产物血红素的反馈调控,因此首先检测 ZGEc1/pTrc99A-ALAS在含有不同浓度血红素的发酵培养基中胞外 5-ALA的积累量,结果如图 6所示.在血红素浓度低于 40,μmol/L时,随着血红素浓度增加,发酵液中 5-ALA的产量不断增加,当血红素浓度为40,μmol/L时,胞外5-ALA的积累量达到最大值,之后随着血红素浓度的提高,胞外5-ALA的积累量逐渐减少,出现这种现象的原因可能是高浓度的血红素对 ALAS的活性产生了抑制作用,为了避免外源血红素对5-ALA积累的不利影响,将胞外血红素的添加量确定为 40,μmol/L.同时,结果显示在添加底物和诱导剂 IPTG的培养基中,重组菌的生长明显受限,最终在 600,nm的吸光度只有2.2,远低于在普通 LB培养基中的最终吸光度,受菌体量的影响,胞外5-ALA的积累量也只有0.313,g/L.
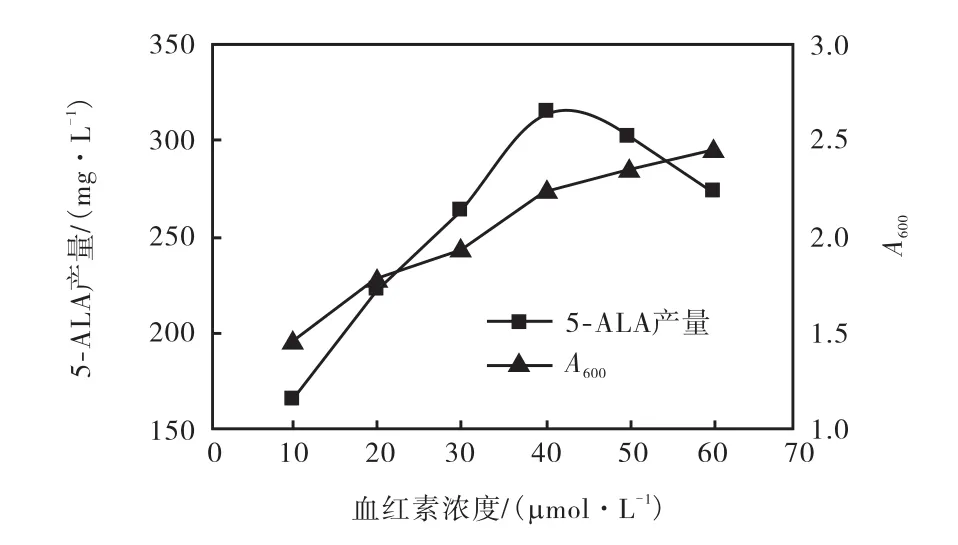
图6 血红素浓度对重组菌胞外5-ALA积累的影响Fig. 6 Effect of hemin on cell growth and 5-ALA accumulation of the recombined strain ZGEc1/pTrc99AALAS
2.4 培养基的正交实验优化
从正交实验结果表1的数据分析,可以首先确定实验因素的优水平和最优水平组合,优水平分别为甘氨酸 4,g/L、琥珀酸 10,g/L、葡萄糖 5,g/L,3个因素的优水平组合也是本实验的最优组合.对实验因素进行极差R分析发现,3因素对实验指标影响的主次顺序是葡萄糖>琥珀酸>甘氨酸.通过 SPSS软件处理,得到方差分析和显著性检验结果见表 2.当置信度为 95%(P=0.05)时,因素临界值为 F0.05(2,8)=4.46,F葡萄糖>F0.05(2,8),说明葡萄糖为置信度 95%的显著性影响因素.
最优培养基条件下胞外 5-ALA产量达到0.987,g/L,是未优化的基础发酵培养基产量0.313,g/L的 3.3倍,发酵液最终在 600,nm 的吸光度也达到5.5,是未优化之前的2.5倍,菌体生长和胞外5-ALA的产量均达到较高的水平.
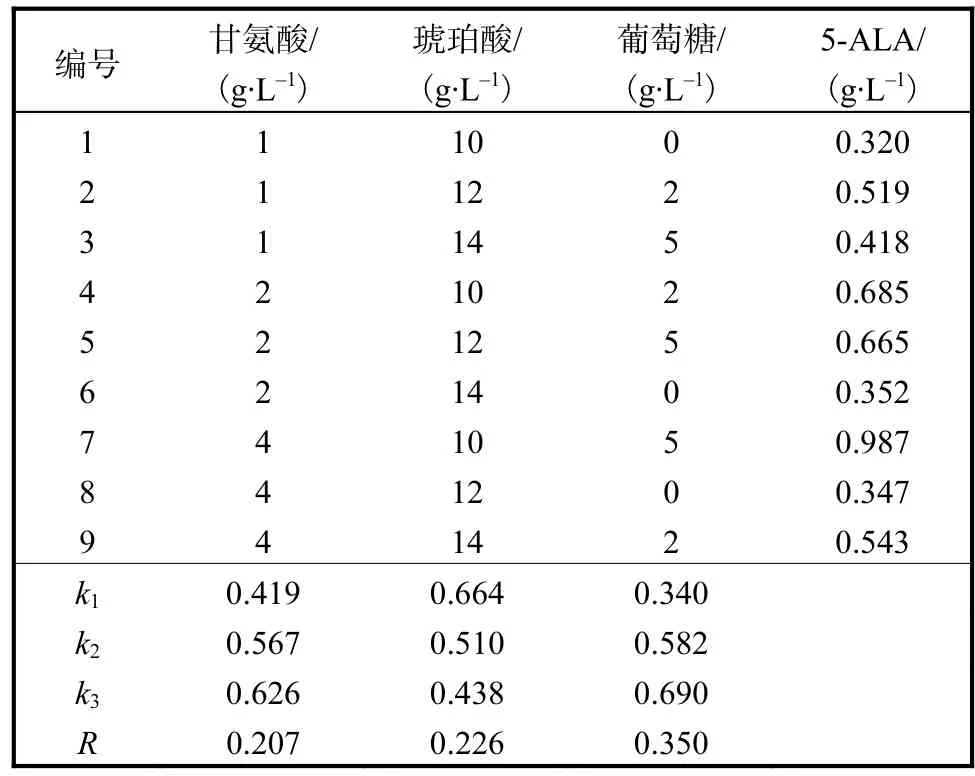
表1 正交实验设计及结果极差分析Tab. 1 Design and results of orthogonal experiment
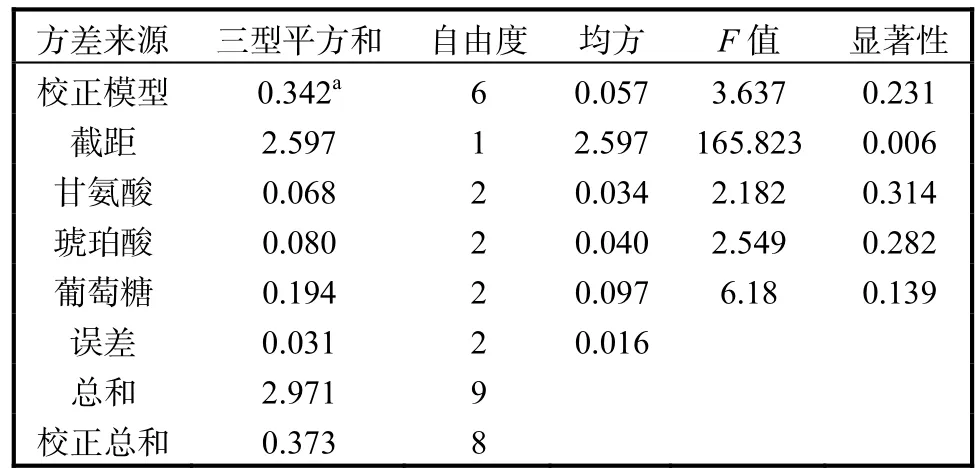
表2 正交实验方差分析Tab. 2 Variance analysis of orthogonal experiment
3 结 语
本研究以 ALAD缺失突变株为出发菌株完全阻断5-ALA的代谢途径,避免了添加昂贵的ALAD抑制剂;通过诱变获得能够摄入外源血红素的突变株,依靠添加少量血红素即可部分恢复 ALAD缺失菌株的生长,结合外源 ALAS的表达,保证了 5-ALA的积累,建立了一条新的构建 5-ALA工程菌的途径.利用更廉价的、来源更为广泛的动物血制品作为血红素替代品的研究有望进一步降低生产成本,为5-ALA的工业化应用奠定了基础.
[1]Choorit W,Saikeur A,Chodok P,et al. Production of biomass and extracellular 5-aminolevulinic acid byRhodopseudomonas palustrisKG31 under light and dark conditions using volatile fatty acid[J]. Journal of Bioscience Bioengineering,2011,111(6):658-664.
[2]傅维琦,林建平,岑沛霖. 生物法合成5-氨基乙酰丙酸的研究进展[J]. 现代化工,2008,28(S2):190-193.
[3]Kennedy J C,Pottier R H,Pross D C. Photodynamic therapy with endogenous protoporphyrin IX:Basic principles and present clinical experience[J]. Journal of Photochemistry and Photobiology B:Biology,1990,6(1/2):143-148.
[4]Sasaki K,Watanabe M,Tanaka T,et al. Biosynthesis,biotechnological production and applications of 5-aminolevulinic acid[J]. Applied Microbiology and Biotechnology,2002,58(1):23-29.
[5]Lin J,Fu W ,Cen P. Characterization of 5-aminolevulinate synthase fromAgrobacterium radiobacter,screening new inhibitors for 5-aminolevulinate dehydratase fromEscherichia coliand their potential use for high 5-aminolevulinate production[J]. Bioresource Technology,2009,100(7):2293-2297.
[6]Van Der Werf M J,Zeikus J G. 5-Aminolevulinate production byEscherichia colicontaining theRhodobacter sphaeroides hemAgene[J]. Applied Environmental Microbiology,1996,62(10):3560-3566.
[7]Erskine P T,Senior N,Maignan S,et al. Crystallization of 5-aminolaevulinic acid dehydratase fromEscherichia coliandSaccharomyces cerevisiaeand preliminary X-ray characterization of the crystals[J]. Protein Science,1997,6(8):1774-1776.
[8]Liu X X,Wang L,Wang Y J,et al. D-glucose enhanced 5-aminolevulinic acid production in recombinant Escherichia coliculture[J]. Applied Biochemistry and Biotechnology,2010,160(3):822-830.
[9]何晓梅,周静,程郢,等. 表达酿酒酵母 ALAS的重组大肠杆菌胞外 5-氨基乙酰丙酸的产量和纯化[J]. 生物工程学报,2007,23(3):520-524.
[10]Stojiljkovic I,Hantke K. Hemin uptake system ofYersinia enterocolitica:Similarities with other TonB-dependent systems in gram-negative bacteria[J]. EMBO J,1992,11(12):4359-4367.
[11]尚柯,郭小飞,王艳萍,等. 5-氨基乙酰丙酸脱水酶缺失对大肠杆菌生长的影响[J]. 现代食品科技,2011,27(7):742-746.
[12]McConville M L,Charles H P. Mutants ofEscherichia coliK12 permeable to haemin[J]. Journal of General Microbiology,1979,113(1):165-168.
[13]蔡婉玲,田宝玉,郭菁,等. 蛋白酶产生菌的筛选和紫外诱变育种[J]. 生物技术,2011,21(1):73-76.
[14]Letoffe S,Delepelaire P,Wandersman C. The housekeeping dipeptide permease is theEscherichia coliheme transporter and functions with two optional peptide binding proteins[J]. Proceeding of the National Academy of Science of the United States of America,2006,103(34):12891-12896.
[15]Mauzerall D,Granick S. The occurrence and determination of delta-amino-levulinic acid and porphobilinogen in urine[J]. Journal of Biological Chemisty,1956,219(1):435-446.
[16]Choi H P,Lee Y M,Yun C W,et al. Extracellular 5-aminolevulinic acid production byEscherichia colicontaining theRhodopseudomonas palustrisKUGB306hemAgene[J]. Journal of Microbiology Biotechnology,2008,18(6):1136-1140.
[17]Fu W,Lin J,Cen P. 5-Aminolevulinate production with recombinantEscherichia coliusing a rare codon optimizer host strain[J]. Applied Microbiology and Biotechnology,2007,75(4):777-782.
[18]Xie L,Eiteman M A,Altman E. Production of 5-aminolevulinic acid by anEscherichia coliaminolevulinate dehydratase mutant that overproducesRhodobacter sphaeroidesaminolevulinate synthase[J]. Biotechnology Letters,2003,25(20):1751-1755.
[19]Xie L,Hall D,Eiteman M A,et al. Optimization of recombinant aminolevulinate synthase production inEscherichia coliusing factorial design[J]. Applied Microbiology and Biotechnology,2003,63(3):267-273.
Production of 5-aminolevulinic Acid with 5-aminolevulinic Acid Dehydratase DeficientEscherichia coliMutant
GUO Xiaofei1,2,3,CHEN Jiuzhou2,3,ZHANG Lilu2,3,JIA Shiru1,ZHENG Ping2,3
(1. College of Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China;2. Key Laboratory of Systems Microbial Biotechnology,Chinese Academy of Sciences,Tianjin 300308,China;3. Tianjin Institutes of Industrial Biotechnology,Chinese Academy of Sciences,Tianjin 300308,China)
5-aminolevulinic acid(5-ALA) is most often biosynthesized by adding 5-ALA dehydratase(ALAD)inhibitorlevulinic acid(LA)to reduce 5-ALA degradation,which leads to the increase of cost and makes the fermentation technology complicated. In this study,we used a 5-ALA dehydratase deficientE. colimutant ZSEc2,as the starting strain. By applying UV mutagenesis,the mutant ZGEc1,was bred and the strain could retrieve normal growth via consumption of extracellular hemin. Then the 5-ALA synthase fromRhodopseudomonas palustriswas over-expressed in the mutant ZGEc1,and a new biosysthesis process of 5-ALA was developed without adding 5-ALA dehydratase inhibiton. After medium optimization,the resultant recombined strain produced about 1,g/L 5-ALA.
5-aminolevulinic acid;5-ALA dehydratase;5-ALA synthase;Rhodopseudomonas palustris
Q815
A
1672-6510(2012)04-0001-06
2012-02-14;
2012-04-16
国家自然科学基金资助项目(31070037);中国科学院知识创新工程项目(KSCX2-EW-Q-13)
郭小飞(1986—),女,山西大同人,硕士研究生;通信作者:郑 平,副研究员,zheng_p@tib.cas.cn.
郎婧
