胃癌组织中Ezrin和nm-23的表达及临床意义
2012-01-09刘换新梁敏燕
刘换新 彭 娟 陈 娟 梁敏燕
胃癌是消化道常见的恶性肿瘤,其术后5年生存率较低,浸润转移是影响其疗效及导致患者死亡的主要原因[1]。近年研究发现,Ezrin蛋白在许多恶性肿瘤如卵巢癌、骨肉瘤、恶性黑色素瘤等中呈高表达[2,3],与肿瘤的转移有高度的相关性[4~6]。nm-23基因是公认的肿瘤转移抑制基因,其编码的蛋白质具有维持细胞正常分裂,并抑制肿瘤细胞转移的功能[7~10]。Ezrin蛋白在胃癌中的表达及意义国内少见报道[1],也有学者探讨了nm-23在胃癌中的表达[7],但两者的相关性未见报道。本研究旨在探讨胃癌组织中Ezrin和nm-23在胃癌及癌旁组织中表达情况及两者相关性,为胃癌的临床治疗及预后判断提供依据。
1 材料与方法
1.1 标本来源
收集武警广东总队医院病理科2004年3月~2006年6月胃癌手术切除标本164例,其中男性110例,女性54例;138例为无病生存(Disease-free survival,DFS)小于5年(出现远处器官转移)或已经死亡的病例,26例DFS大于5年的病例;年龄最大78岁,最小36岁,中位年龄47.8岁。按WHO2003年胃肿瘤组织学分类,其中高分化腺癌99例,中分化腺癌41例,低分化腺癌20例,未分化癌4例;pTNM 分期,Ⅰ期6例(3.7%)、Ⅱ期59例(35.9%) 、Ⅲ期55例(33.5%) 、Ⅳ期44 例(26.8%) ;有淋巴结转移108例(65.9%),无淋巴结转移56例(34.1%)。对每1例标本经常规HE染色后,进行组织病理学观察并做出诊断,同时取相应癌旁组织作为对照。
1.2 试剂
鼠抗人Ezrin和nm-23单克隆抗体和阳性对照片购自北京中杉生物技术有限公司,一抗工作浓度1∶200;Envision法检测试剂盒购自基因生物技术有限公司。
1.3 免疫组织化学染色
采用Envision法,切片脱蜡至水,置入0.01/枸椽酸原修复液中,微波高温修复10 min,然后按照公司提供的标准方法进行操作,进行显色,常规脱水,透明,封片,用公司提供的阳性对照片为对照,用PBS替代一抗为阴性对照。
1.4 免疫组化检测结果评定标准
光学显微镜下对染色情况进行评估,取5个高倍视野各计数100个细胞,Ezrin的评定标准按照Yu等[4]的分级标准分为阴性(无表达);阳性(<50%细胞阳性表达或染色较浅);强阳性(>50%细胞阳性表达且深染)。nm-23阳性标准参照Terada 等[7]的分级标准:以细胞质内出现均匀棕黄色颗粒为阳性染色细胞,阳性细胞数<20%为阴性表达,20%~30%为阳性表达,阳性细胞数>30%为强阳性。
1.5 统计学分析
用统计分析软件SPSS13.0进行统计学分析,分别对各指标结果进行Wilcoxon秩和检;采用Spearman秩相关分析对Ezrin和nm-23的相关性进行检验。
2 结果
2.1 Ezrin及 nm-23在胃组织中的表达
在胃癌癌旁组织中两者均有表达,阳性信号分布于癌细胞胞膜。Ezrin和 nm-23在胃癌癌旁组织中的表达分别为21.3%(35/164),86.6%(142/164);在癌组织中的表达分别为48.2%(79/164),35.4%(58/164)。癌组织中Ezrin及 nm-23的表达与癌旁组织比较,差异均有统计学意义(P<0.05)。
2.2 Ezrin和nm-23在胃癌中的表达
淋巴结转移组与无淋巴结转移组之间、临床分期Ⅰ~Ⅱ期与Ⅲ~Ⅳ期之间以及DFS<5年与>5年组之间比较,Ezrin和nm-23表达差异均有统计学意义(P<0.05),见表1。Ezrin和nm-23表达和患者年龄、性别以及肿块大小无明显相关性(P>0.05)。
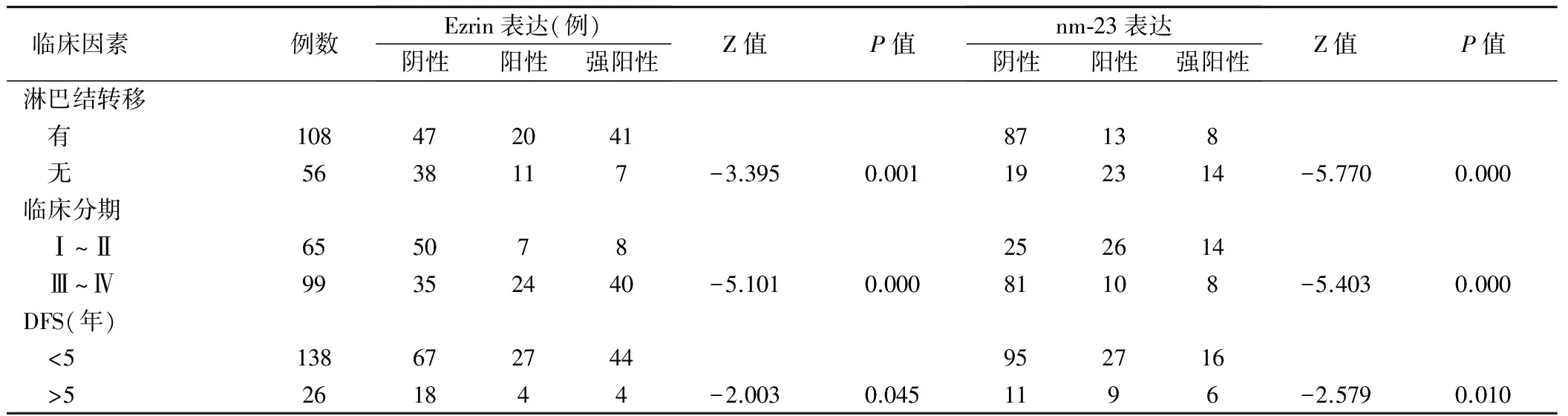
表1 Ezrin和nm-23在胃癌中表达及其与临床病理参数的关系(例)
2.3 Ezrin和nm-23在胃癌组织中表达的关系
分析发现,Ezrin表达高的病例,其nm-23阳性率低,而Ezrin表达低的病例,其nm-23表达率偏高,经Spearman等级相关性统计分析发现,它们之间呈负相关性(γ=-0.359,P<0.001),见表2。

表2 胃癌组织中 Ezrin和nm-23表达间的关系(例)
3 讨论
大量临床实践表明,肿瘤的浸润和转移是肿瘤患者死亡的最重要的原因。作为最常见的肿瘤之一,胃癌的5年生存率一直较低,这与胃癌的发生比较隐匿,出现临床症状时已经到了中晚期有较大关系。另外,胃癌转移的早晚存在较大个体差异,其中的原因比较复杂,诸多环节尚不清楚,但是研究人员通过大量的实验研究发现,Ezrin蛋白与肿瘤的生长、侵袭、转移直接相关[2,3]。Ezrin是ERM(ezrin-radixin-moesin)细胞骨架相关蛋白家族成员之一,参与细胞骨架组建,并通过MEK/ERK信号传导途径,诱导瘤细胞侵袭表型发生,参与细胞迁移和转移相关的细胞内相关信号传导。通过对骨肉瘤、黑色素瘤以及卵巢癌的研究发现,有淋巴结转移的癌组织中Ezrin异常高表达,没有淋巴结转移的癌组织Ezrin表达较低,而且Ezrin的表达与患者的预后明显相关[4~6]。研究发现,用RNAi 技术抑制Ezrin高表达的细胞株使Ezrin 表达下调后,肿瘤转移能力明显下降[4]。
本研究通过对2004年3月~2006年6月在我院手术的胃癌患者的资料的回顾和总结,并应用免疫组化的方法检测胃癌组织中Ezrin的表达,结果发现,淋巴结转移为4枚或多于4枚的患者和淋巴结转移少于4枚的患者相比,Ezrin表达率明显偏高,差异有统计学意义,提示Ezrin可能在胃癌淋巴结转移过程中担任重要的角色,Ezrin过度表达或过度活化可以促进肿瘤细胞的转移。从实验数据中还可以观察到,随着临床分期的不断升高(Ⅲ~Ⅳ期),Ezrin表达率有显著性上升,提示Ezrin过度表达的患者预后不良。另外,从数据中还可以发现,对于那些无病生存时间为5年以上的患者,Ezrin表达明显低于那些无病生存时间小于5年的患者,这说明Ezrin对于判断胃癌预后具有一定意义。本实验还发现在胃癌癌旁组织以及胃良性肿瘤中均有表达,但它们的表达分布很规则,主要分布在腺上皮细胞胞膜,是1种生理性表达,与在胃癌中的表达相比有明显的不同。
nm-23 基因表达于正常细胞,位于人类染色体17q22,包括nm-23H1 及nm-23H2 2个亚型,两者有88% 的同源性。其突变见于多种人类肿瘤[7~10],突变方式最常见的nm-23H1 等位基因丢失。乳腺癌和大肠癌的突变率分别为64% 和52.14%[8],而卵巢癌的突变率更高,达76%[9]。目前大多数文献报道肯定nm-23H1 基因突变与肿瘤转移存在相关关系。nm23抑制转移比较有力的证据是在乳腺癌中得到证实[8],研究表明,nm-23蛋白与包括胃癌在内的人类多种肿瘤浸润有关。但近年来有研究显示,nm-23基因并不象抑癌基因p53那样稳定,它在某些癌症中表现比较混乱,原因是多方面的,推测改变nm-23H1的调节可能是转移的起点,而nm-23H1位点丧失在不同肿瘤中的发生率各不相同,因而会出现不同的研究结果。但在本研究过程中,我们发现nm-23蛋白在癌旁组织中显示高表达,在癌旁组织中,nm-23的表达率明显高于癌组织,并有显著性差异。在伴有淋巴结转移的病例中,nm-23的表达率很低,另外,临床分期早的胃癌患者,nm-23表达明显高于分期晚的患者;而淋巴结转移少于4枚的患者,nm-23的表达也显著高于淋巴结转移大于4枚的患者。从其5年无病生存率和nm-23表达相关性分析,预后佳的患者的nm-23表达阳性率比预后差的高,差异有统计学意义,表明nm-23表达水平与胃癌预后呈正相关,提示nm-23可以抑制胃癌的转移,与其他作者的报道一致[7],提示nm-23可作为判断胃癌转移和预后的参考指标。同时,检测nm-23在癌组织中的表达可能还有助于从胃癌患者中筛选出转移高危险者进行治疗。
本研究还对Ezrin和nm-23在胃癌组织中表达进行比较,发现Ezrin表达高的患者,nm-23表达低,预后差;Ezrin而表达低的患者,nm-23表达高,患者的预后相对较好,两者之间具有负相关性(P<0.01),提示两者可能通过多种信号通路共同参与了胃癌浸润和转移,参与其中的有多种因素,有学者认为[4]Ezrin过度表达或过度活化可以使细胞之间连接松散,细胞之间的信号传递异常,进而促进肿瘤细胞的转移。我们推测由于Ezrin是细胞骨架连接蛋白,Ezrin的过表达干扰了其它相关基因的功能,有可能影响到nm-23的表达。异常表达的nm-23基因可以编码1种类似二磷酸核苷激酶(NDPK)的蛋白,参与微管的集合和分解,影响细胞的结构和细胞之间的相互关系,从而也影响了细胞的正常的生理活动,促进了癌细胞的转移,同时也说明,nm-23的异常表达有助于新生瘤细胞的扩散。Ezrin 和nm-23两者间相互作用的机制需要进一步的研究加以证实。
总之,我们发现Ezrin和nm-23在胃癌组织中表达高、低与胃癌的分期、转移及预后有相关性,可作为判断预后并用于治疗的有用的参考指标。我们的研究表明,检测Ezrin及nm-23在胃癌中的表达并综合分析,有助于对患者预后的判断,对指导临床治疗具有一定参考价值。
[1]刘 晔,杨 静,李 辉,等.Ezrin 和CD44v6 在胃癌中的表达及其临床意义〔J〕.临床和实验病理学杂志,2009,2:143.
[2]Moilanen J ,Lassus H ,Leminen A ,et al.Ezrin immunoreactivity in relation to survival in serous ovarian carcinoma patients〔J〕.Gynecol Oncol,2003,90(2):273.
[3]Makitie T,Carpen O,Vaheri A,et al.Ezrin as a prognostic indicator and its relationship to tumor characteristics in uveal malignant melanoma〔J〕.Invest Ophthalmol Vis Sci,2001,42(11):2442.
[4]Yu Y,Khan J,Khanna C,et al.Expression profiling identifies the cytoskeletal organizer Ezrin and the developmental homeoprotein Six-1 as key metastatic regulators 〔J〕.Nal Med,2004,10(2):175.
[5]屈洪波,李汉贤.Ezrin蛋白与肿瘤侵袭转移的研究进展〔J〕.实用癌症杂志,2009,24(1):93.
[6]Zhou B,Leng J,Hu M.Ezrin is a key molecule in the metastasis of MOLT4 cells induced by CCL25/CCR9〔J〕.Leuk Res,2010,34(6):769.
[7]Terada R,Yasutake T,Nakamura S,et al.Clinical significalce of nm23 expression and chromosome 17 numerical aberrations in primary gastric cancer〔J〕.Med Oncol,2002,19(4):239.
[8]王兴武,方晋平,国 前,等.食管癌组织中nm23-H1、CD44V6蛋白表达与区域淋巴结转移的关系〔J〕.实用癌症杂志,2002,17(1):10.
[9]Liu YJ,Yan PS,Li J,et al.Expression and significance of CD44s,CD44v6,and nm23 mRNA in human cancer〔J〕.World J Gastroenterol,2005,11(4):6601.
[10]Andolfo I,De Martino D,Liguori L,et al.Correlation of NM23-H1 cytoplasmic expression with metastatic stage in human prostate cancer tissue〔J〕.Arch Pharmacol,2011,384 (4-5):489.
