邻苯二酚和对苯二酚在钴氢氧化物膜修饰玻碳电极上的选择性测定*
2012-01-08谭庆军侯宏卫唐纲岭胡清源
谭庆军,侯宏卫,唐纲岭,胡清源
(国家烟草质量监督检验中心,郑州 450001)
邻苯二酚和对苯二酚在钴氢氧化物膜修饰玻碳电极上的选择性测定*
谭庆军,侯宏卫,唐纲岭,胡清源
(国家烟草质量监督检验中心,郑州 450001)
通过镀膜/循环伏安法制备了钴氢氧化物膜修饰的玻碳电极。该修饰电极对邻苯二酚(CA)和对苯二酚(HQ)具有较强的电催化活性。考察了支持电解质酸度对邻苯二酚和对苯二酚电化学响应的影响,选用0.1 mol/L PBS (pH 10.0)作为支持电解质。利用差示脉冲伏安法(DPV)对邻苯二酚和对苯二酚进行选择性检测,当两者浓度同时改变时,邻苯二酚和对苯二酚在6~100 μmol/L范围内氧化峰电流与其浓度呈良好的线性关系,检出限分别为2×10-7,5×10-7mol/L(S/N=3)。钴氢氧化物膜电极具有较好的稳定性、重现性及较强的抗干扰能力,将此修饰电极应用于模拟水样中邻苯二酚和对苯二酚的测定,回收率为95.4%~100.4%。
钴氢氧化物膜;邻苯二酚;对苯二酚;电催化
金属氧/氢氧化物薄膜如镍、钴、铁、铜可应用于电催化、电池、电色显示系统、金属的防腐及钝化等许多领域[1-3]。在碱性条件下,钴氢氧化物膜对某些小分子具有优良的电催化活性[4-6],这吸引了电化学工作者的广泛关注。钴氢氧化物膜修饰电极的制备方法是在合成钴氢氧化物材料基础上[7],采用涂抹的方式制备修饰电极。该方法与电沉积方法相比,膜的薄厚程度及均一性难以掌控。目前已有文献报道电沉积方法制备钴氢氧化物膜修饰电极[6,8-10]并对其制备过程、影响因素进行了研究。
邻苯二酚(CA)和对苯二酚(HQ)是苯二酚的两种同分异构体,在医药、食品及环境中是重要的环境污染物[11],它们在自然条件下难以降解。因此对二者进行快速、准确、痕量分析检测十分重要。近年来,对邻苯二酚和对苯二酚的测定方法主要有紫外光谱法[12]、气相色谱法[13]、液相色谱法[14]和电化学方法[15,16],其中电化学方法由于其仪器简单、灵敏度高、检测快速而受到普遍关注。目前,采用钴氢氧化物膜修饰电极对苯二酚的研究较少[17,18],并未见对两者进行同时检测的报道。
笔者采用镀膜/循环伏安法制备了钴氢氧化物膜修饰的玻碳电极。利用该修饰电极对邻苯二酚和对苯二酚进行了同时分析检测,并采用循环伏安(CV)法和差示微分脉冲伏安(DPV)法考察了两种物质在此修饰电极上的电化学行为。对实验条件进行了优化,两种物质均获得良好的线性范围,该法灵敏度高,测量结果准确。
1 实验部分
1.1 主要仪器与试剂
电化学分析仪:CHl660D型,上海辰华仪器公司;
三电极体系:玻碳电极(GCE)和钴氢氧化物膜修饰玻碳电极(CoOOH/GC)为工作电极,饱和甘汞电极(SCE)为参比电极,CHI115铂丝为对电极;
超声波清洗器:KQ-3200型,昆山市超声仪器公司;
酸度计:pHS-25型,上海雷磁仪器厂;
CoCl2·6H2O,NaH2PO4,Na2HPO4,Na3PO4,KCl :天津科密欧化学品有限公司;
邻苯二酚和对苯二酚:美国Aldrich公司;
磷酸缓冲溶液(PBS):用0.1 mol/L NaH2PO4,Na2HPO4,Na3PO4配制而成 (pH 10.0);
所用试剂均为分析纯,所有溶液均用二次蒸馏水配制;
DPV实验参数:振幅50 mV,脉冲宽度60 ms,脉冲周期200 ms。
1.2 钴氢氧化物膜电极的制备
将玻碳电极分别用 1.0,0.3,0.05 μm Al2O3粉末抛光成镜面,水冲洗后,依次在无水乙醇和二次蒸馏水中超声清洗1~2 min。为获得干净的玻碳电极表面,将其置于1.0 mol/L H2SO4溶液中在-0.3~1.5 V电位窗口下扫描 12 圈 (扫描速率 50 mV/S)[19],然后在氮气下吹干备用。将上述处理好的玻碳电极浸入含Co2+的1.0 mol/L氯化钾溶液中,在-1.0 V的电位下富集4 min,采用循环伏安法在-1.4~0.6 V的电位范围内以50 mV/s的扫描速率扫描3圈。然后将电极移至0.1 mol/L NaOH溶液中,在-0.2~0.6 V电位范围内,以100 mV/s的扫描速率进行循环伏安扫描直至曲线稳定[18]。将钴氢氧化物膜电极取出,用二次蒸馏水清洗干净备用。
1.3 实验方法
电化学实验采用三电极系统,玻碳电极(GCE)和钴氢氧化物膜电极(CoOOH/GC)为工作电极,SCE为参比电极,CHI115铂丝为对电极;选取0.1 mol/L PBS为支持电解质,在一定电位窗口内,用CV和DPV方法进行测试,记录其伏安曲线。
2 结果与讨论
2.1 钴氢氧化物膜在玻碳电极表面上的电沉积
图1为玻碳电极在1 mmol/L Co2+的氯化钾溶液(1.0 mol/L)中,扫描速率为50 mV/s 时的循环伏安图及钴氢氧化物膜电极在0.1 mol/L氢氧化钠溶液中的循环伏安图[17],扫速速率为100 mV/s。

图1 钴氢氧化物膜在玻碳电极表面上成膜的CV图
从图1a可见,在第一圈扫描时所得的CV曲线上出现了1个阴极峰和2个阳极峰,这是由于在负向扫描时,已富集的Co2+快速被还原成钴膜沉积在玻碳电极表面,当电位回扫时,钴膜被氧化与溶液中存在的Cl-形成不同配位数的钴(Ⅱ)氯配合物,对应2个不同的阳极峰[17]。图1b为钴氢氧化物膜电极在0.1 mol/L NaOH溶液中沉积的循环伏安图,从图中看出,在连续的循环伏安扫描中,曲线轮廓在不断变化,这表明电极表面的钴氢氧化物膜在沉积过程中可能涉入了不同的化学反应。首先是电极上的钴(Ⅱ)氯配合物向更稳定的钴氢氧化物转变,钴氢氧化物进一步被氧化为三价钴羟基氧化物[18],相应的反应过程可表示如下:

在连续循环扫描30圈后,曲线稳定,表明均匀稳定的钴氢氧化物膜沉积在玻碳电极表面。
2.2 对苯二酚在不同修饰电极上的循环伏安行为
图2为裸玻碳电极和钴氢氧化物膜电极在含有 8×10-5mol/L 对苯二酚的 0.1 mol/L PBS (pH 10.0)溶液及钴氢氧化物膜电极在0.1 mol/L PBS(pH 10.0)溶液的循环伏安图,扫描速率为100 mV/s。对苯二酚在裸玻碳电极(图2b)上发生准可逆氧化还原反应,而相同浓度的对苯二酚在CoOOH/GCE上出现一对峰形更好的氧化还原峰(图2c),其氧化峰电流明显大于裸玻碳电极上的氧化峰电流。这表明钴氢氧化物膜电极对对苯二酚具有较强催化作用。从图2a得出,CoOOH/GCE在0.1 mol/L PBS (pH 10.0)电位窗口-0.6~0.3 V内没有氧化还原峰,这进一步证实图2c中的氧化还原峰归属于对苯二酚的氧化还原过程。

图2 对苯二酚在不同电极上的循环伏安图
2.3 邻苯二酚和对苯二酚混合溶液的循环伏安行为
采用循环伏安法进一步研究了8×10-5mol/L对苯二酚 和8×10-5mol/L邻苯二酚混合溶液在GCE和CoOOH/GCE上的电化学行为,如图3所示。扫描速率为100 mV/S。
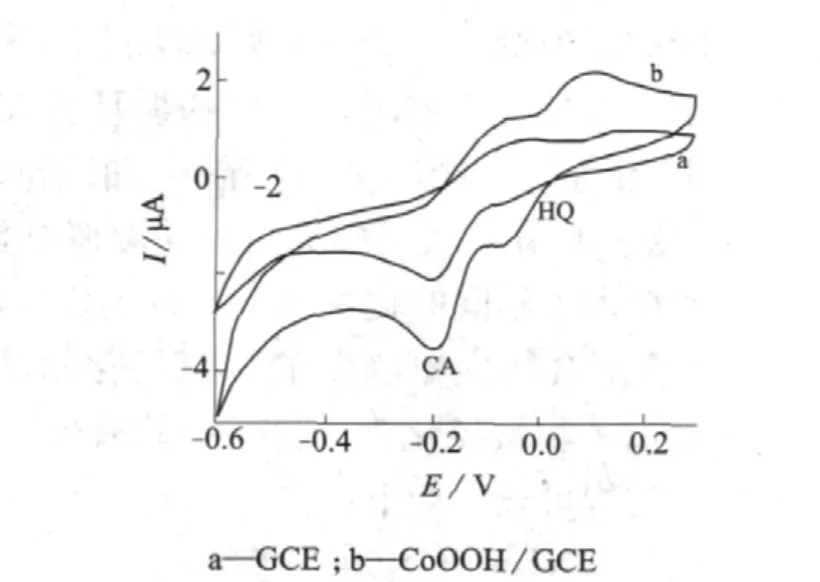
图3 对苯二酚和邻苯二酚混合溶液在PBS (pH 10.0)溶液中的循环伏安图
由图3可知,在裸玻碳电极上(图3a),邻苯二酚和对苯二酚虽然能够较弱地分开,但其峰电流较弱,灵敏度较低;而在CoOOH/GCE上(图3b),邻苯二酚和对苯二酚能够较好地分开,且峰电流与裸玻碳电极相比明显提高,表明CoOOH对邻苯二酚和对苯二酚具有较强的电催化活性。这是因为在一定的碱性条件下,含有高价态钴离子的氧化物对大量的电化学活性分子具有较强的电化学催化活性[20,21]。
2.4 缓冲溶液pH值的影响
利用DPV法考察了在0.1 mol/L PBS中不同pH条件下,邻苯二酚和对苯二酚在CoOOH/GCE上的电化学行为。考虑到羟基氧化钴在碱性条件对邻苯二酚和对苯二酚具有较好的电催化活性,实验选择的pH值均在碱性条件下。在pH 8.5~11范围内,对苯二酚(图4a)和邻苯二酚(图4b)均有较好的电化学响应。
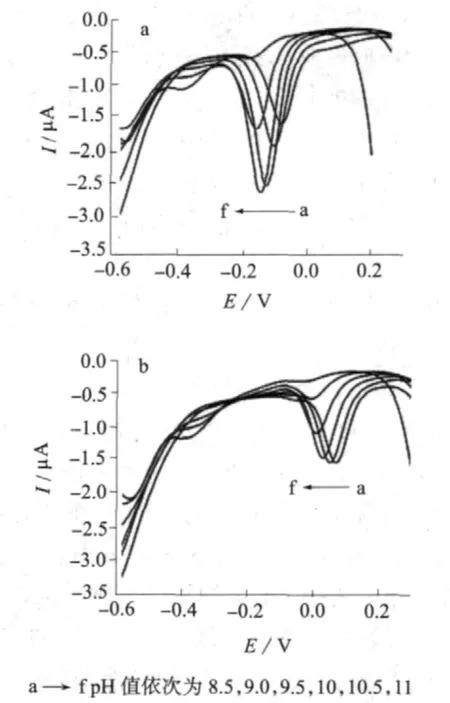
图4 对苯二酚(a)和邻苯二酚(b)在不同pH值的PBS中,于CoOOH/GCE上的DPV响应
由图4可知,对苯二酚和邻苯二酚的氧化峰电位随着pH值的升高而负移,说明高pH值有利于二者电化学反应的进行,并且Epa与pH值呈线性关系。对苯二酚和邻苯二酚的线性回归方程分别为Epa1=0.293 4-0.042 7pH,r1=0.994 7和Epa2=0.410 5-0.041 1pH,r2=0.999 5,方程斜率分别为-42.7,-41.1 mV/pH,接近理论的能斯特斜率(25℃时为-59 mV/pH),说明二者的氧化还原是等电子等质子过程[22,23]。对苯二酚 (图 4 a)的Ipa随 pH 值的升高先增加后减小,并且在pH 10.0时达到最大值。邻苯二酚(图4 b)的Ipa在pH为8.5,9.0,10.0时峰电流基本没有变化,而当pH大于10.0后,峰电流明显降低。当pH为10.0时,8×10-5mol/L对苯二酚和8×10-5mol/L邻苯二酚混合溶液的DPV响应峰电位差(ΔEpa)为130.6 mV,pH对两者的氧化峰电位差基本没有影响。为了获得更高的电流响应,选择pH=10.0的PBS作为支持电解质。
2.5 邻苯二酚和对苯二酚的选择性测定
在优化的实验条件下,采用DPV法考察了邻苯二酚和对苯二酚浓度与峰电流的关系。图5为向0.1 mol/L PBS (pH 10.0)溶液中加入等体积,同浓度的邻苯二酚和对苯二酚所得到的DPV图。对苯二酚的氧化峰电流Ipa(μA)与其浓度在5~90 μmol/L范围内呈良好的线性关系,线性回归方程Ipa=-0.016c-0.202 8,r=0.994 2,检出限为 8×10-7mol/L (S/N=3);邻苯二酚的氧化峰电流Ipa(μA)与其浓度在5~90 μmol/L范围内呈良好的线性关系,线性回归方程Ipa=-0.029 5c-0.345 6,r=0.998 4,检出限为 9×10-7mol/L (S/N=3)。

图5 对苯二酚和邻苯二酚共存体系在CoOOH/GCE上的差示脉冲伏安图
2.6 稳定性、重现性与干扰试验
对 8×10-5mol/L 对苯二酚和 8×10-5mol/L邻苯二酚的混合溶液连续平行测定7次,其氧化峰电流测定值的相对标准偏差分别为3.11%,2.00%。在相同条件下对电极修饰5次,在8×10-5mol/L对苯二酚和8×10-5mol/L邻苯二酚混合溶液中进行测定,测定结果的相对标准偏差分别为3.74%,2.40%。将CoOOH/GC电极置于0.1 mol/L PBS(pH 10.0)中在4℃冰箱中保存7天,峰电流仍能够保持初始值的93.7%。上述结果表明,CoOOH/GCE具有良好的稳定性和重现性。
在0.1 mol/L PBS (pH 10.0)中用DPV方法研究了一些常见离子和小分子等物质对对苯二酚和邻苯二酚共同测定的干扰试验。试验结果表明,低于 1×10-2mol/L 的 K+,Na+,Ca2+,NH4+,Cl-,Br-,,EDTA及低于 6×10-4mol/L的苯酚不干扰二者的测定。由于Cu2+,Mg2+,Al3+,Fe3+与溶液中大量存在的OH-存在相互作用,对测定产生不同程度的干扰,在测试前加入少量的EDTA即可去除这些离子的干扰。
2.7 样品测定
从实验室自来水管中取水,过滤,并且以0.1 mol/L PBS(pH 10.0)稀释10倍后用于配制模拟水样,为消除 Cu2+,Mg2+,Al3+,Fe3+等的干扰,测试前加入适量的EDTA,实验结果见表1。由表1可见,利用CoOOH/GC电极对样品中邻苯二酚和对苯二酚测定的回收率分别为95.6%~99.3%,97.7%~100.4%,该法可用于实际样品的测定。

表1 模拟水样中邻苯二酚和对苯二酚回收试验结果
3 结语
通过镀膜/循环伏安法制备了钴氢氧化物膜修饰的玻碳电极,该修饰电极在碱性条件下对邻苯二酚和对苯二酚具有较强的电催化活性。通过试验证明,该电极具有较强的稳定性、重现性,以此建立了邻苯二酚和对苯二酚的电化学选择性测定方法,结果准确可靠。
[1]Zhu W H, Ke J J, Yu H M, et al. A study of the electrochemistry of nickel-hydroxide electrodes with various additives[J]. Journal of Power Sources,1995,56(1): 75-79.
[2]Barbero C, Planes G A, Miras M C. Redox coupled ion exchange in cobalt oxidefilms[J]. Electrochemistry Communications,2001,3(3): 113-116.
[3]Srinivasan V, Weidner J W. Capacitance studies of cobalt oxide films formed via electrochemical precipitation[J]. Journal of Power Sources,2002,108(1-2): 15-20.
[4]Das D, Das K. Cobalt hydroxide film on Pt as co-catalyst for oxidation of polyhydric alcohols in alkaline medium[J].Materials Chemistry and Physics,2010,123(2-3): 719-722.
[5]Chari M A, Shobha D, Sasaki T. Room temperature synthesis of benzimidazole derivatives using reusable cobalt hydroxide (Ⅱ)and cobalt oxide (Ⅱ) as efficient solid catalysts[J]. Tetrahedron Letters,2011,52(43): 5 575-5 580.
[6]Yang J, Zhang W D, Gunasekaran S. A low-potential H2O2-assisted electrodeposition of cobalt oxide/hydroxide nanostructures onto vertically-aligned multi-walled carbon nanotube arrays for glucose sensing[J]. Electrochimica Acta,2011,56(16): 5 538-5 544.
[7]Wang B X, Lin H, Yin Z G. Hydrothermal synthesis of beta-cobalt hydroxide with various morphologies in water/ethanol solutions[J].Materials Letters,2011,65(1): 41-43.
[8]Zhao T, Jiang H, Ma J. Surfactant-assisted electrochemical deposition of alpha-cobalt hydroxide for supercapacitors[J].Journal of Power Sources,2011,196(2): 860-864.
[9]Kong L B, Kong L B, Liu M C, et al. Porous cobalt hydroxidefilm electrodeposited on nickel foam with excellent electrochemical capacitive behavior[J]. Journal of Solid State Electrochemistry,2011,15(3): 571-577.
[10]Jafarian M, Mahjani M G, Heli H. A study of the electro-catalytic oxidation of methanol on a cobalt hydroxide modified glassy carbon electrode[J]. Electrochimica Acta,2003,48(23):3 423-3 429.
[11]Zhao D M, Zhang X H, Feng L J. Simultaneous determination of hydroquinone and catechol at PASA/MWNTs composite film modified glassy carbon electrode[J]. Colloids and Surfaces B-Biointerfaces,2009,74(1): 317-321.
[12]闫琰,叶芝祥,闫军,等.紫外光谱法同时测定水中苯酚、邻苯二酚和间苯二酚[J].化学分析计量,2008,17(2): 22-23.
[13]Moldoveanu S C, Kiser M. Gas chromatography/mass spectrometry versus liquid chromatography/fluorescence detection in the analysis of phenols in mainstream cigarette smoke[J]. Journal of Chromatography A,2007,1141(1): 90-97.
[14]鲁萍,孔黎明,吴俊.高效液相色谱法同时分析水中酚类混合物[J].扬州大学学报(自然科学版),2004,7(4):24-26.
[15]Bai P F, Fan G L, Li F. Novel Zn-Al layered double hydroxide/carbon nanotube nanocomposite for electrochemical determination of catechol and hydroquinone[J]. Materials Letters,2011,65(15-16): 2 330-2 332.
[16]Ahammad A J S, Rahman M M, Xu G R, et al. Highly sensitive and simultaneous determination of hydroquinone and catechol at poly(thionine)modified glassy carbon electrode[J].Electrochimica Acta,2011,56(14): 5 266-5 271.
[17]尹志芬,尉景瑞,郭满栋.钴氢氧化物膜电极对儿茶酚的电化学催化氧化[J].武汉大学学报(理学版),2008,54(4): 391-395.
[18]Fan L F, Wu X Q, Guo M D, et al. Cobalt hydroxidefilm deposited on glassy carbon electrode for electrocatalytic oxidation of hydroquinone[J]. Electrochimica Acta,2007,52(11): 3 654-3 659.
[19]Huo Z H,Zhou Y L, Liu Q. Sensitive simultaneous determination of catechol and hydroquinone using a gold electrode modified with carbon nanofibers and gold nanoparticles[J]. Microchimica Acta,2011,173(1-2): 119-125.
[20]Casella I G,Guascito M R. Electrochemical preparation of a composite gold-cobalt electrode and its electrocatalytic activity in alkaline medium[J]. Electrochimica Acta,1999,45(7):1 113-1 120.
[21]Cox P,Pletcher D. Electroaynthesis at oxide coated electrodes part 2: the oxidation of alcohols and amines at spinel anodes in aqueous base[J]. Journal of Applied Electrochemistry,1991,21(1): 11-13.
[22]孙进高,王广凤,焦守峰,等.纳米La(OH)3修饰电极对邻苯二酚和对苯二酚的同时测定[J].分析化学,2007,35(3): 335-359.
[23]孙进高,王广凤,焦守峰,等. 纳米La(OH)3修饰电极对邻苯二酚和对苯二酚的同时测定[J]. 分析化学, 2007, 35(3): 335-359.
Selective Simultaneous Determination of Catechol and Hydroquinone at Cobalt Hydroxide Modified Glassy Carbon Electrode
Tan Qingjun, Hou Hongwei, Tang Gangling, Hu Qingyuan
(China National Tobacco Quality Supervision & Test Center, Zhengzhou 450001, China)
Cobalt hydroxide modified glassy carbon electrode (CoOOH/GCE) was prepared byfilm plating/cyclic voltammetry method. CoOOH/GCE exhibited excellent electrocatalytic activities towards catechol (CA) and hydroquinone(HQ). The effects of pH value on the oxidation peak current and potential of catechol and hydroquinone were studied by differential pulse vohammetry (DPV),and 0.1 mol/L PBS (pH 10.0) was selected as the supporting electrolyte. Under the optimized conditions,when the concentrations of CA and HQ were simultaneously changed,the oxidation peak current of CA and HQ was linear with concentration repectively in the range of 6-100 μmol/L with the detection limit of 2×10-7,5×10-7mol/L (S/N=3) repectively. Furthermore,the modified electrode exhibited good reproducibility,stability and selectivity,which was used for the determination of CA and HQ in imitative water samples with recoveries of 95.4%-100.4%.
cobalt hydroxidefilm; catechol; hydroquinone; electrocatalytic oxidation
O657.1
A
1008-6145(2012)04-0022-05
10.3969/j.issn.1008-6145.2012.04.007
*国家自然科学基金项目(20701040)
联系人:唐纲岭;E-mail: tanggl@ztri.com.cn
胡清源;E-mail: huqy@ztri.com.cn
2012-03-22
