卫生经济学评价及其在新生儿学科中的应用
2012-01-08刘丽娟钱莉玲
刘丽娟 钱莉玲
20世纪50年代,卫生经济学成为经济学领域的一门新兴独立学科,之后的60年代美国和WHO召开的几次卫生经济学研讨会标志着卫生经济学正式形成。随后,进入快速发展时期,开展了卫生经济学理论、卫生资源配置、医疗保障、公共卫生服务、疾病经济负担、成本效果分析(cost-effectiveness analysis,CEA)和药物经济等诸多领域的研究,而且研究成果应用于宏观卫生决策、新技术和药物审批以及个体临床治疗。中国卫生经济学起步较晚,1980年初才开展对医疗成本和收费标准的研究与测算,1983年卫生经济学会成立标志着中国卫生经济学诞生。20世纪90年代后卫生经济学领域对外交流加强,卫生经济学理论和方法开始被应用于医药卫生的各个方面。但目前国内许多医学研究仍只重视卫生决策的社会价值和临床治疗的安全性有效性,很少考虑卫生经济学方面。为数不多的卫生经济学研究也存在诸多问题,如研究内容多限于药物经济、成本分析,且仅计算直接成本,缺乏规范的卫生经济学研究指南,研究成果尚未应用于中国医药卫生的决策过程等,而且目前成人领域研究居多,儿科方面的卫生经济学研究甚少[1]。
国际上将平均期望寿命、孕产妇死亡率和5岁以下儿童死亡率作为最基础的卫生发展和人群健康指标。全世界范围内,新生儿死亡率占5岁以下儿童死亡率的38%[2]。近30年来,随着医疗技术和药物快速发展,新生儿治疗相关费用也大幅提升。美国每年用于早产儿治疗费用高达262亿美元[3],其中尚未包括婴儿期治疗费用以及新生儿智力落后、脑瘫、失明和聋哑等疾病治疗费用。美国等发达国家拥有丰富的卫生资源、完善的医疗保险制度,仍然非常重视对新生儿治疗手段进行卫生经济学评价,开展了肺表面活性物质(PS)、吸入NO(iNO)、新生儿疾病筛查等卫生经济学评价。中国大陆相对发达地区的三级医院相继建立了新生儿重症监护中心(NICU),新生儿学科进入了快速发展阶段,机械通气、PS、iNO等治疗手段陆续进入临床应用,2011年新生儿死亡率为7.8‰,较1990和2000年都有大幅下降。但中国大陆卫生总费用占GDP比重仅为5.1%,远低于世界平均水平(9.7%),而且东西部、城乡差距巨大,而新生儿救治手段花费极高,很多新生儿的预后与经济状况息息相关[4~6]。有限的投入使得优化资源以保证提供更有效的医疗卫生保障成为必要,成本和结局之间的平衡需要通过卫生经济学评价的方法实现。公共卫生专家与临床研究者在进行临床流行病学或多中心RCT时,采用卫生经济学研究理念和分析方法,评估临床干预措施的成本效果,并将其结果用于指导关键技术的转化推广、干预策略的改进以及资源的合理配置[7]。本文将综述新生儿治疗领域中卫生经济学评价方法的应用。
1 卫生经济学评价的定义与特点
简单的归纳卫生经济学评价,即通过分析卫生规划的经济效果(成本、效果,或投入、产出),对备选方案进行评价和优选。
卫生经济学评价具有两大特征:①评价时既考虑被评价项目的投入(成本)又考虑项目的效果(或效益);②要在两个或以上方案之间进行比较。其最基本任务是确认、衡量、比较和评价各备选方案的成本和效果,解决技术方案的优选问题[1,8]。
2 常用卫生经济学评价方法
卫生领域中常用的经济学评价方法主要有4种,即最小成本分析(cost minimization analysis,CMA)、CEA、成本效用分析(cost-utility analysis,CUA)和成本效益分析(cost-benefit analysis,CBA)。
2.1 CMA 是在假定2个或多个临床干预方案的结果相同的情况下,通过分析和比较每个干预方案的成本进行选择,成本最小的方案为最佳方案。CMA的优点是易于应用,操作性强,缺点是只能比较同一种疾病相同结果时的成本,故使用范围狭窄。Lee等[9]对加拿大11个地区NICU 3种不同的婴儿转运体系,包括急救技术员(emergency medical technicians,EMT)、注册护士(registered nurses,RN)和联合团队(combined teams,CT)进行分析。以生理稳定转运危险系数(transport risk index of physiologic stability,TRIPS)为转运结局,经统计学检验得知,3组转运前后TRIPS差异无统计学意义。该研究进一步使用决策树模型,用CMA方法比较3组费用,显示RN转运体系较EMT和CT转运体系更加节省费用。
2.2 CEA 是RCT中最常用的经济学评价方法,通过比较不同项目的成本与健康效果,以成本效果比(cost-effectiveness ratio,CER)的形式为决策者选择最佳的健康干预方案提供依据。CEA的基本思想是以最低的成本实现确定的计划目标,或消耗一定卫生资源应该获得的最大的服务效果,即从成本和效果两方面对备选方案之间的经济效果进行评价。其方法有3种:①各方案的成本基本相同时比较效果的大小,选择效果最大的方案;②各方案的效果基本相同时比较成本的高低,选择成本最小的方案;③当不受预算约束时,成本、效果均可变化,则通过计算增量成本和增量效果的比值,将其与预期标准相比较。Dukhovny等[10]对应用咖啡因治疗早产儿呼吸暂停进行CEA的研究中,将结果表示为存活不伴神经发育损害,成本为直接支付费用,不包含机会成本。咖啡因组平均成本为124 466美元/存活不伴神经损害,而对照组则为133 505美元/存活不伴神经损害,从而提示咖啡因治疗出生体重低于1 250 g的早产儿呼吸暂停时不仅可以得到更好的临床结局,平均费用也更低,是一种“双赢”治疗。CEA的局限性是只能用于在同一种疾病下比较不同的干预措施,或结果表达为同一指标时所采用不同措施的比较。
2.3 CUA 是CEA的一种发展。在干预方案的效果评价中,不仅要注意健康状况的改善,而且要注意生命质量的变化。CUA中,成本用货币单位表示,采用较复杂的综合指标如质量调整生命年(quality-adjusted life year, QALY)、失能调整生命年(disability-adjusted life year, DALY)等来反映疾病防治措施的效果,其中以QALY应用最广,将不同生活质量的生存年数换算成生活质量相当于完全健康人的生存年数。既往有研究提示在呼吸道合胞病毒(RSV)流行季节每月应用帕利珠单抗进行免疫预防,可以显著降低高危儿(如早产儿伴/不伴支气管肺发育不良、先天性心脏病婴儿等)的住院率[11,12]。Nuijten等[13]对英国应用帕利珠单抗预防RSV感染进行CUA,显示帕利珠单抗预防较不预防的增量成本效用比为16 720英镑/QALY,在英国的意愿支付价格(30 000英镑/QALY)范围内,提示帕利珠单抗预防高危儿RSV严重感染具有成本-效用,在美国和澳大利亚进行的同类研究结论也与此一致[14,15]。该方法的优点在于使用单一的成本指标(货币)、单一的效用指标(如QALY),可广泛用于所有健康干预,且综合考虑了干预措施对生存时间和生存质量的影响。缺点是应该由谁来估价不同健康状态的质量权重,特别是在新生儿科中,新生儿不能对健康状况的质量进行评价,而监护人的评价则缺乏效力,目前仍存在争议,即对测定效用值尚缺乏金标准。
2.4 CBA 是通过比较备选方案的全部预期效益和全部预计成本的现值来评价备选方案,即成本和效益均以货币来表达,由此可以直接说明某项措施带来的效益是否大于成本。如Kostinov等[16]对俄罗斯实施新生儿轮状病毒感染免疫接种计划进行CBA,每年接种总投入为17亿卢布,预防接种可以避免0~5岁儿童轮状病毒感染148 114例,每例治疗费用为17 394卢布,则新生儿免疫接种的净效益则为8.66亿卢布,提示具有成本效益。CBA的缺点与CUA相类似,即对效益的测量存在争议,缺乏金标准;且方案制定时需要考虑到各种可能的收益,以及期间产生的新成本,存在很多尚未解决的技术难题,操作难度大。
3 卫生经济学评价方法的基本步骤
卫生经济学评价可以采用计算机模拟(如决策分析)分析,也可以利用临床研究(观察性研究或大规模RCT)数据进行分析。与临床研究同时开展具有如下好处:①能收集到所有相关的数据,由此减少不必要的推测;②能够在患者层面进行分析,从而使数据的不确定性得到恰当处理;③利用临床研究强大体系减少偏倚,优化结论的有效性[7]。
临床研究相关卫生经济学评价的设计步骤,适用于4种卫生经济学评价方法。
3.1 形成研究问题 研究问题需要在经济学方面有重要意义,并与决策者面对的选择有关。而卫生经济学分析与临床研究最大的不同是强调评价角度的选择,如从患者、医疗卫生保健系统、医疗保险部门、政府或全社会角度进行评价,分析角度的不同会测算出不同的成本和结果。美国医药卫生成本-效果研究小组建议从全社会角度进行分析,可以包含医疗服务过程中产生的所有成本,是目前为止最全面的方法[17]。而且该方法一是避免了由于支付方之间费用转移产生的误差,二是可以在国家层面上分析政策对社会产生的经济影响。当家庭、医院的决策者要平衡收支,则从个人角度进行CEA更为有用。
3.2 确定干预及对照 卫生经济学评价的结果表示为两个方案成本和效果的比较,作为对照的选择就格外重要。选择一个不常用的方案作为对照会导致结果与临床实践无关;同样,忽视了成本低、效果理想的方案也会导致结论受到误导。因此,对照的选择建议采用适应证相同的常规治疗或标准治疗方案,如果某些疾病目前尚无有效医疗措施,可以将安慰剂作为对照。
3.3 确定分析方法 需要根据研究目的及目标受众选择合适的研究方法。例如,CUA最适用于决策者在项目中比较不同干预措施,在这种情况下,应用常用的效果表示方法(如QALY)会使比较更为方便。CMA则适用于某个医院或机构在预算受限时评价引入一项新技术的可行性。此外,还应根据研究中干预措施的特点、数据的可获得性以及评价的要求选择适当的评价方法。表1列出了4种卫生经济学评价方法在新生儿科的应用。
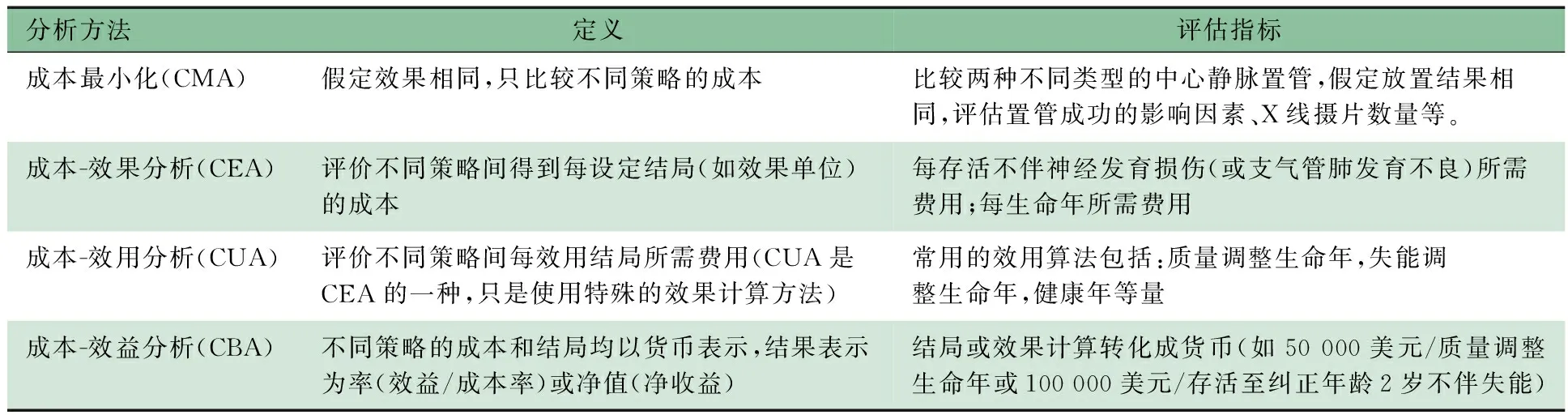
表1 卫生经济学评价方法应用
3.4 健康结果评估 健康结果数据可以来自单个临床研究或多个研究的系统性回顾,其中基于RCT得到的效果,内部效力高,偏倚小。CEA效果最简单的表达为某个临床参数的改变,如不伴支气管肺发育不良或神经发育损伤的存活率,但当研究中效果参数不同时则难以比较分析的结果。CUA将结局表示为“效用”。效用是个人对特定健康状态或临床结局的评价,在一个范围内打分,0代表死亡,1代表完全健康。一个健康状态的效用与个体在此健康状态的存活时间相乘,结果则表达为QALY。QALY可以将有不同效果参数的研究进行比较。CBA则使用货币来表达健康产出,通常通过询问个体为了避免该结局“愿意支付”多少货币。这种分析较少用于儿科,部分原因是这种评估方法存在概念上的困难[18]。
一旦健康结果资料收集完成,两个试验组平均效果差计算公式为:
ΔE=E干预-E对照
其中E干预为干预组的效果,E对照为对照组的效果。
3.5 成本计算 资源利用和成本可以分成多种。直接医疗成本指直接用于个体医疗护理的成本,如住院天数、医生查房次数、用药或家庭医疗设备。在某些情况下,其中会混杂一些间接成本,如照明或经营一家医院所需的人力资源;直接非医疗成本是指没有纳入医疗范畴的疾病护理费用,如家庭为饮食、泊车或照顾患儿所付的成本。另外,患病及治疗过程对患者或其家人工作也会产生影响,由于误工或雇佣受限所付出的成本称为“生产力损失”。如前所述,卫生经济学分析中采用的成本分析方法取决于研究的角度。例如,全社会角度要求考虑到与疾病和治疗相关的所有费用;医院角度则不考虑家庭成本和生产力损失[19]。
在研究中需要计算所用的资源,如住院天数、用药剂量等,并将其转化为成本,其中确定医疗服务过程中各项资源成本的来源非常重要。以门诊药物为例,某些门诊药物的市场批发价格可以作为成本,而有些药物(如院内制剂)的生产成本可作为成本。对于住院患者,费用通常直接由医院财务系统输出,不能够反映所用资源的真正成本。因此,医院收费应转化为医疗服务成本。在美国,通常根据医疗与辅助中心从各个医院得到的“成本-收费比”来进行换算。
当明确了各项资源的成本后,患者所用到的资源数乘以相应成本后即为成本量,不同资源成本量求和即得到该患者的医疗服务成本,并据此计算试验中干预组和对照组患者的平均成本。两组成本的差值即为增量成本:
ΔC=C干预-C对照
其中C干预为干预组的成本,C对照为干预组的成本。
3.6 增量CER(ICER)计算 CEA采用增量分析,计算干预组与对照组的相对成本和效果的比值,即ICER。
3.7 确定研究时限(time horizon) 卫生经济学评价中,研究时限指成本和效果数据计算的时间范围。进行卫生经济学评价时必须要精确限定时间范围,因为不同时点的选择会对结果有重要影响。一个直接成本高的治疗方案可能在患者刚出院时花费较高,但是如果该治疗能避免因重大疾病所产生的费用,则从长期来讲,该治疗是具有成本效果的。因此,在卫生经济学分析中建议设定研究时限。研究时限设定取决于研究中疾病的种类、治疗目标和预期产出等。RCT研究数据收集取决于所研究的治疗方法,由于资金及随访等限制,资料通常是有限的。一般来讲,样本观察时间应足够长以获得干预所产生的主要成本和产出。如果希望在经过这个时间点后成本效果差异仍然存在,计算机模型可以延长结果的适用性,在这种情况下,除了应列出长期治疗模拟时间及依据外,还应列出短期治疗的原始数据及研究时限。
3.8 不确定性分析(uncertainty analysis)与贴现(discount) 卫生经济学评价方法中不确定性存在3个原因:①卫生经济学评价方法的许多方面尚存在争议,如研究设计,设计角度,成本与治疗结果的测量,估价,贴现,统计分析和结果表述等不确定因素都会影响评价结果的可比性。②数据存在相当大的不确定性,由抽样误差引起的,如样本大小、样本的代表性;由假设引起,如针对模型的各种数据假设。③在报告和解释卫生经济学评价结果时存在大量的主观性[20,21]。
对于抽样误差引起的不确定性,可以采用Bootstrap法和Fieller准则计算ICER 95%CI。卫生经济学研究中,一般采用敏感性分析来研究数据收集和研究假定的不确定性,在参数较少时可以采用单因素、多因素或极值分析法,在参数较多和模型设计时采用Monte Carlo法进行概率敏感性分析。在条件许可时,可以使用成本效果可接受曲线(cost-effectiveness acceptability curve, CEAC)表示不确定性分析的结果。
对于绝大多数个体,现在有机会获得金钱或效益,将来也更有机会获得金钱或健康效益。为了解决这种“时间偏好”,当研究时间范围长,一般超过1年时,会采用贴现来分析将来的成本和效益。贴现率(discount rate)一般为市场利率,建议采用一年期的国家指导利率或国债利率进行贴现。贴现率应该进行敏感性分析,波动范围在0~8%[22]。对于健康产出,建议采用与成本相同的贴现率进行贴现和敏感性分析[23]。
3.9 结果分析与报告 最常用的方法是通过比较点估计值进行效果的确定性分析。图1即是描述这种差异的分析图,横轴代表干预组与对照组间治疗效果的差值ΔE,纵轴代表干预组与对照组间治疗成本的差值ΔC,如果ΔC/ΔE比值在第四象限(图1A),说明与对照组相比,干预组成本小且效果很好,这是最好的一种结果;而如果ΔC/ΔE比值落在第二象限(图1A),则说明干预组成本很高,效果很差,要尽量避免这种情况。医学研究中多数是图1B这种情况,点估计值在第一象限,说明成本越大,效果越好。从原点伸展至点估计值,可作出一条直线(图1C),该线的斜率表示与对照组比较,干预组增加成本-效果的程度,斜率越大,表示与对照组比较,干预组在增加的单位效果下增加的成本越大,由此可得出干预组的作用越小[24]。
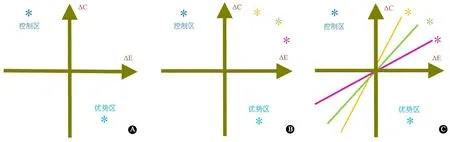
图1 成本-效果分析图
注 横轴代表干预组与对照组间治疗效果的差值ΔE,纵轴代表干预组与对照组间治疗成本的差值ΔC
卫生经济学评价结果报告除了需要陈述主要结果、结论及其原因或意义、本研究结果与其他类似相关研究或评价结果的异同点外,还应特别关注评价结果的内部效度(真实性)和外部效度(外推性),包括证据的真实性(是否反映了该治疗干预措施的真实经济学价值,即该经济学研究的质量)和对当地背景或其他国家的适用程度,特别是这种不同经济学分析的综合结果[25]。
4 卫生经济学评价在新生儿医学的应用
4.1 卫生经济学评价在新技术开展中的应用 新生儿重症救护技术一直是新生儿治疗中昂贵的部分,占NICU患儿直接住院医疗费用的比例高达35%[26],近年来新技术开展是新生儿重症监护医疗费用大幅度上升的重要影响因素,在既定的医疗资源条件下,评价一项新技术是否具有临床应用价值,卫生经济学研究是主要的评价方法。
临床试验证实表面活性物质替代疗法(SRT)可以降低RDS的发生率和病死率[27~29]。国外早期对SRT的卫生经济学评价集中于对“SRT治疗”与“无SRT治疗”进行成本效果比较,发现PS能降低RDS病死率,减少新生儿治疗费用,但由于研究当时不清楚PS价格或该产品尚未上市,PS费用未被纳入。Tubman等[30]研究发现应用猪PS每获得一个生命的增量成本为13 720英镑,每QALY的成本为710英镑,同其他NRDS的治疗手段相比,具有成本效用。随着临床应用的增加,SRT已成为常规治疗手段,对SRT具体应用策略,如早期预防应用与治疗应用,不同PS应用次数间等进行卫生经济学评价具有更大的临床和科研意义[31],有研究发现PS应用于多个患者、多种剂型会显著降低药物治疗费用(最高可达30%),而效果不变,即存在着药物治疗的规模效应[32]。
自2000年以来,发达国家采用iNO技术显著改善了新生儿危重呼吸疾病救治结果[33~35],但是NO的价格成为影响其广泛应用的一个障碍。iNO目前公认的适应证为新生儿低氧性呼吸衰竭(NRF)和新生儿持续性肺动脉高压(PPHN)。Angus等[36]发现应用iNO治疗足月儿/近足月儿NRF,当最大支付意愿为10万美元/QALY时,在拥有体外膜肺技术(ECMO)的三级医院,iNO有84.6%的可能有成本效用优势,在转运前的基层医院,iNO有71.6%的可能有成本效用优势。而该课题组[37]对iNO治疗NRF的早产儿进行经济学评价时,则发现体重500~749 g的早产儿生后48 h内给予预防性iNO,在矫正年龄1岁时与对照组相比,费用接近,而iNO增加了氧依赖,并不具有成本效果优势。这两项研究结果迥异可能是因为足月儿及近足月儿应用iNO治疗会降低ECMO的使用率,而早产儿iNO并不能避免更昂贵治疗手段应用,机械通气时间及住院天数不能缩短,iNO的住院费用超过普通住院费用的25倍。Lorch等[38]从社会角度对足月儿PPHN治疗方案中加入iNO进行CEA,发现iNO用于新生儿PPHN较常规治疗方法,ICER为19 022美元/QALY和33 234美元/挽救生命,较5万美元/QALY和10万美元/挽救生命,具有成本效果优势,但并不会节省费用。Zupancic等[39]则从患者角度对出生体重低于1 250 g的新生儿应用iNO预防支气管肺发育不良进行CBA,发现应用iNO治疗的患儿与对照组所花费用相近,因为iNO增加的药物费用被机械通气天数和住院天数缩短而抵消。对于7~14 d的新生儿,iNO在改善预后的同时节约了费用。
ECMO是一项复杂的心肺支持技术。当常规治疗如机械通气、PS、高频通气和iNO等治疗无效时,ECMO是严重呼吸、循环衰竭的最终治疗手段。尽管符合ECMO应用条件的新生儿数量不多,ECMO为有创操作,且价格昂贵,但其临床应用价值很高[40,41]。英国ECMO试验协作组开展了一项关于新生儿ECMO应用的RCT,并将经济学评价纳入研究内容。该研究对足月儿NRF应用ECMO进行CEA,显示应用ECMO在第1、4与7年随访时均能有效降低病死率和严重失能发生率,而且ECMO与其他常用的重症呼吸支持技术相比,具有更好的成本效果比[42~44]。
4.2 卫生经济学评价在新生儿疾病筛查的应用 据WHO报道,在全球范围内,出生缺陷发生数占每年出生人口的2%~3%[45]。出生缺陷疾病表现多样,病因复杂,社会和家长都承担着严重的疾病负担。20世纪90年代以来,DNA检测技术和质谱技术应用到新生儿筛查领域,使筛查病种迅猛增加,一些氨基酸、有机酸和脂肪酸代谢性疾病,以及听力障碍逐步纳入新生儿筛查范围[44]。
针对一项筛查项目的CEA主要基于2个关键因素。患者的平均筛查费用是模型的主要影响因素,高收费则导致高CER,而疾病的发病率也会影响结果。Huang等[47]应用CEA方法比较了国内新生儿听力普遍筛查和目标人群筛查,前者为对所有新生儿在出院前均接受电生理学检测方法进行听力筛查,后者为对有听力损失高危因素的新生儿进行筛查。研究发现,普遍筛查策略适用于那些筛查、诊断和干预措施好的经济发达省份,可以使更多聋哑儿童受益;而在经济欠发达省份,目标人群筛查则暂时更为现实。该研究还提出从长期来看,两种方案特别是普遍筛查项目具有良好的成本效果优势。
技术进步推动了新生儿筛查工作的迅速发展,然而,考虑到经济条件的限制,需要对各种筛查手段进行相应的经济学评价,以判断哪种筛查手段更具成本-效果优势。Jackson等[48]应用决策树模型对诊断和治疗早产儿视网膜病(ROP)眼底镜检查和远程医疗进行CUA,前者是由经验丰富的眼科医生进行眼底镜检查,后者由非眼科人士使用广角拍照装置进行眼底拍照,然后由远程眼科专家进行解读。研究发现,对于出生体重<1 500 g的新生儿,使用眼底镜检查的CER为5 617美元/QALY,而应用远程医疗为3 193美元/QALY。因此在ROP管理中远程医疗较标准眼底镜检查成本效用更佳。
4.3 卫生经济学评价在政府有关新生儿卫生决策中的作用 卫生管理部门在资金有限的前提下推行一项或多项医疗保障措施,需要通过卫生经济学评价众多的备选方案,从中选取最佳者,以达到充分利用有限资源产生最大效益的目的。发展中国家承受着严峻的早产儿和NRDS负担[49]。Vidyasagar等[50]发现,在发展中国家除了改善基础治疗,应将持续气道正压通气(CPAP)作为治疗NRDS的首选,而将费用昂贵的PS留给那些CPAP治疗不能改善或者需要机械通气的患儿。Parappil等[51]对卡塔尔胎龄在28~32周的早产儿存活率改善最经济和有效措施的研究表明,2/3的早产儿生后早期的NRDS可以通过产前激素和生后CPAP来控制,从而为低收入国家和地区围产医疗保障投入提供依据。
4.4 卫生经济学评价在新生儿领域应用的不足 目前卫生经济学研究在新生儿领域的研究大多数是回顾性的,缺乏前瞻性研究;用于研究的样本例数较少;经济学部分常是临床试验的附属物,使得评价的效力不够充分。另外,在方法学上仍不够成熟、完善,一是成本测定困难,成本数据难以获得;二是CUA和CBA研究中的效用和效益的评估尚无统一的金标准。这些都有待进一步研究,从而使卫生经济学评价方法在筛选成本低、产出高的诊断治疗方法中发挥重要作用。
5 新生儿学科卫生经济学评价研究的前景
近30年来国内新生儿专业快速发展,许多新生儿治疗中心的医疗配置与发达国家新生儿科当前水平接近,而新生儿救治水平与发达国家仍有较大差距,并且国内城乡、东西部之间差距亦很大。由于中国新生儿临床规模、设施、转运模式、医保制度与国外差别很大,在发展过程中不能简单移植发达国家的经验。近年来新生儿专业流行病学研究及大样本、多中心研究逐渐增多,利用临床研究资料进行卫生经济学评价,将有助于新生儿救治新技术的应用及推广,指导不同地区、不同层次的新生儿病房的资源配置和利用,提高医疗质量的发展方向。政府决策者可以利用提供的资料信息对不同方案进行卫生经济学评价,避免重复劳动和过度浪费,最大限度地降低成本,制定出与社会卫生资源利用有关的更优决策,解决发展中经济、医保不足及有限医疗资源与大量低收入人群就医的矛盾,提高国内新生儿专业的整体救治水平。
[1]程晓明,主编.卫生经济学.北京:人民卫生出版社,2007.462-491
[2]Black RE, Cousens S, Johnson HL, et al. Global, regional, and national causes of Child mortality in 2008: a systematic analysis.Lancet, 2010, 375(9730): 1969-1987
[3]Martin JA, Hamilton BE, Menacker F, et al. Preliminary births for 2004: infant and maternal health.http://www.cdc.gov/nchs/products/pubs/pubd/hestats/prelimbirths04/prelimbirths 04health.htm
[4]WHO. World Health Statistics 2010. http://www.who.int/whosis/whostat/2010/en/index.html
[5]Ministry of Health of the People's Republic of China(中华人民共和国卫生部).The 2011 Statistic Bulletin of Chinese medical health development.http://www.moh.gov.cn/publicfiles/business/htmlfiles/mohwsbwstjxxzx/s7967/201204/54532.htm
[6]Sun B, Ma L, Liu XH, et al. Development of neonatal respiratory and intensive care: Chinese perspectives. Neonatology, 2012, 101(2):77-82
[7]Dukhovny D,Zupancic JA.Economic evaluation with clinical trials in neonatology.Neoviews, 2011, 12(2): e69-75
[8]Drummond MF, Jefferson TO. Guidelines for authors and peerreviewers of economic submissions to the BMJ.The BMJ Economic Evaluation Working Party. BMJ, 1996, 313(7052):275-283
[9]Lee SK, Zupancic JA, Sale J, et al. Cost-effectiveness and choice of infant transport systems. Med Care, 2010, 40(8):705-716
[10]Dukhovny D, Lorch SA, Schmidt B, et al. Economic evaluation of caffeine for apnea of prematurity. Pediatrics, 2011, 127(1):e146-155
[11]The Impact-RSV Study Group. Palivizumab, a humanized respiratorysyncytial virus monoclonal antibody, reduces hospitalization from respiratorysyncytial virus infection in high-risk infants. Pediatrics, 1998, 102(3):531-537
[12]Feltes TF, Cabalka AK, Meissner HC, et al. Palivizumab prophylaxis reduces hospitalization due to respiratory syncytial virus in young children with hemodynamically significant congenital heart disease: Cardiac Synagis Study Group. J Pediatr, 2003, 143(4):532-540
[13]Nuijten MJ, Wittenberg W, Lebmeier M. Cost effectiveness of palivizumabfor respiratory syncytial virus prophylaxis in high-risk children: a UKanalysis. Pharmacoeconomics, 2007, 25(1):55-71
[14]Resch B, Sommer C, Nuijten MJ, et al. Cost-effectiveness of palivizumab for respiratory syncytial virus infection in high-risk children, based on long-term epidemiologic data from Australia. Pediatr Infect Dis J, 2012, 31(1):e1-8
[15]Mahadevia PJ, Masaquel AS, Polak MJ,et al. Cost utility of palivizumab prophylaxis among preterm infants in the United States: a national policy perspective.J Med Econ, 2012, 15(5):987-996
[16]Kostinov MP, Zverev VV. Economic effectiveness of vaccination against rotavirus infection in the Russian Federation.Zh Mikrobiol Epidemiol Immunobiol, 2012,(3):50-55
[17]Siegel JE, Weinstein MC, Russell LB, et al. Recommendations of the panel on cost-effectiveness in health and medicine. JAMA, 1996,276(15):1253-1258
[18]Saigal S, Tyson J. Measurement of quality of life of survivors ofneonatal intensive care: critique and implications. Semin Perinatol, 2008,32(1):59-66
[19]Zupancic JA. Appendix D. A systematic review of costs associatedwith preterm birth. In: Institute of Medicine. Preterm Birth:Causes, Consequences, and Prevention. Washington DC: National Academies Press, 2007
[20]Briggs AH, Gray AM. Handing uncertainty in economic evaluations of healthcareinterventions. BMJ, 1999, 319(7210): 635-638
[21]Sculpher MJ, Fenwick E, Claxton K. Assessing quality in decision analyticcost-effectiveness models: a suggested frame-work and example of application.Pharmacoeconomics,2000,17(5): 461-467
[22]Sun LH(孙利华), Zong X.Some suggestions on the discount rate in pharmacoeconomic evaluation of China. Chinese Journal of New Drugs(中国新药杂志), 2010, 19(9):737-739
[23]Smith DH, Gravelle H. The practice of discounting in economic evaluations of healthcare interventions.Int J Technol Assess Health Care, 2001, 17(2):236-243
[24]Siegel JE, Weinstein MC, Russell LB, et al. Recommendations for reporting cost-effectiveness analyses. Panel on Cost-Effectiveness in Health and Medicine. JAMA, 1996, 276(16):1339-1341
[25]Wang L(王莉), Hu SL, Sun X, et al. Systematic review of economic analyses: methods and challenges. Chinese Journal of Evidence-based Medicine(中国循证医学杂志), 2008, 8(11):1007-1011
[26]Lewit EM, Baker LS, Corman H, et al.The direct cost of low birth weight.Future Child, 1995, 5(1): 35-56
[27]Halliday HL. Surfactants: past, present and future. J Perinatol, 2008,28(S1):47-56
[28]Soll RF. Synthetic surfactant for respiratory distress syndrome in preterm infants. Cochrane Database Syst Rev, 2003,(2):CD001149
[29]Seger N, Soll R. Animal-derived surfactant extract for treatment of respiratory distress syndrome. Cochrane Database Syst Rev, 2009, (2):CD007836
[30]Tubman TRJ, Halliday HL, Norman C. Cost of surfactant replacement treatment for severe neonatal respiratory distress syndrome: a randomized controlled trial. BMJ, 1990, 301(6756):842-845
[31]Mugford M. Cost effectiveness of prevention and treatment of neonatal respiratory distress (RDS) with exogenous surfactant: what has changed in the last three decades?Early Hum De, 2006, 82(2):105-115
[32]Stevens TP, Sinkin RA, Notter RH, et al. Alternative strategies for dispensingexogenous surfactant: drug cost implications and in vitrofeasibility studies. Hosp Pharm, 2004, 39(4):338-345
[33]Ballard RA, Truog WE, Cnaan A, et al. Inhalednitric oxide in preterm infants undergoingmechanical ventilation. N Engl J Med, 2006, 355(4):343-353
[34]Ballard RA. Inhaled nitric oxide in preterminfants: correction. N Engl J Med, 2007, 357(14):1444-1445
[35]Finer NN, Barrington KJ. Nitric oxide for respiratory failure in infants born at or nearterm. Cochrane Database Syst Rev, 2006, (2):CD000399
[36]Angus DC, Clermont G, Watson RS, et al. Cost-effectiveness of inhaled nitric oxide in the treatment of neonatal respiratory failure in the united states. Pediatrics, 2003, 112(6 Pt 1):1351-1360
[37]Watson RS, Clermont G, Kinsella JP, et al. Clinical and economic effects of iNO in premature newborns with respiratory failure at 1 year. Pediatrics, 2009, 124(5):1333-1343
[38]Lorch SA, Cnaan A, Barnhart K. Cost-effectiveness of inhaled nitric oxide for the management of persistent pulmonary hypertension of the newborn. Pediatrics, 2004, 114: 417-426
[39]Zupancic JA, Hibbs AM, Palermo L, et al. Economic evaluation of inhaled nitric oxide in preterm infants undergoing mechanical ventilation. Pediatrics, 2009, 124(5):1325-1332
[40]Elbourne D, Field D, Mugford M. Extracorporeal membrane oxygenation for severe respiratory failure in newborn infants (Cochrane Review). In: The Cochrane Library, Issue 4. Oxford, United Kingdom: Update Software; 2002
[41]United Kingdom Collaborative ECMO Trial Group. United Kingdomcollaborativerandomised trial of neonatal extracorporeal membrane oxygenation. Lancet, 1996, 348(9020):75- 82
[42]Roberts TE, the ECMO Economics Working Group. Economic evaluation and randomized controlled trial of extracorporeal membrane oxygenation: UK Collaborative Trial. BMJ, 1998, 317(7163):911-915
[43]Petrou S, Edwards L. Cost-effectiveness analysis of neonatal extracorporeal membrane oxygenation based on four year results from the UK Collaborative ECMO Trial. Arch Dis Child Fetal Neonatal Ed, 2004, 89(3):F263-268
[44]Petrou S, Bischof M, Bennett C, et al. Cost-effectiveness of neonatal extracorporeal membrane oxygenation based on 7-yearresults from the United Kingdom collaborative ECMO trial. Pediatrics, 2006, 117(5):1640-1649
[45]World Health Organization.Gloabal registry and database on craniofacial anomalies. 2001
[46]Prosser LA, Grosse SD, Kemper AR, et al.Decision analysis, economic evaluation, and newborn screening: challenges and opportunities.Genet Med, 2012,14:703-712
[47]Huang LH, Zhang L, Tobe RY, et al. Cost-effectiveness analysis of neonatal hearing screening program in china: should universal screening be prioritized?BMC Health Serv Res, 2012, 12: 97
[48]Jackson KM, Scott KE, Graff Zivin J,et al.Cost-utility analysis of telemedicine and ophthalmoscopy for retinopathy of prematurity management. Arch Ophthalmol, 2008, 126(4):493-499
[49]Beck S, Wojdyla D, Say L, et al. The worldwide incidence of preterm birth: a systematic review of maternal mortality and morbidity. Bull World Health Organ, 2010,88(1):31-38
[50]Vidyasagar D, Velaphi S, Bhat VB.Surfactant replacement therapy in developing countries. Neonatology, 2011, 99(4): 355-366
[51]Parappil H, Rahman S, Salama H. Outcomes of 28+1 to 32+0 weeks gestation babies in the state of Qatar: finding facility-based cost effective options for improving the survival of preterm neonates in low income countries.Int J Environ Res Public Health, 2010, 7(6):2526-2542
