葛根素对中波紫外线损伤HaCaT细胞的抗氧化作用*
2012-01-06黄绵庆杨照新姚茂忠田树红
黄绵庆,杨照新,姚茂忠,田树红,符 健
(海南医学院,海口 571101)
葛根素(puerarin)是从豆科植物野葛(pueraria lobata)的干燥根中提取的主要有效成分,其化学名称为8-β-D-葡萄吡喃糖-4′,7-二羟基异黄酮,临床上主要用于冠心病、各型心绞痛、心肌梗死、视网膜动、静脉阻塞及突发性耳聋的治疗。葛根素在体外有良好的清除氧自由基的能力[1-2],其抗氧化作用是保护急性缺血心肌细胞的重要机制之一[3]。为了深入研究葛根素是否对氧化损伤的上皮细胞也具有保护作用,作者以人角质形成细胞(HaCaT细胞)建立中波紫外线(ultraviolet B,UVB)氧化损伤模型,研究葛根素不同处理方式对HaCaT细胞抗氧化指标的影响。
1 材料与方法
1.1细胞株 HaCaT细胞株,购自中科院昆明细胞库。
1.2仪器与试剂 MCO-15AC二氧化碳培养箱为日本三洋公司产品,MK3型酶标仪为上海赛默飞世尔仪器有限公司产品,流式细胞仪为美国Becton Dickison公司产品,紫外线测量仪为台湾先驰光电股份有限公司产品,葛根素为华北制药集团制剂有限公司产品,活性氧(reactive oxygen species,ROS)检测试剂盒为江苏碧云天生物技术研究所产品,超氧化物歧化酶(super oxidative dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPH-Px)、过氧化氢酶(catalase,CAT)、总抗氧化能力(total antioxidant capacity,T-AOC)和丙二醛(malondialdehyde,MDA)检测试剂盒为南京建成生物工程研究所产品。
1.3方法
1.3.1HaCaT细胞培养 HaCaT细胞以DMEM培养,置于37 ℃和5%CO2的细胞培养箱环境生长。细胞融合至80%以上,倾去瓶中培养液,以0.05%胰蛋白酶和0.02%乙二胺四乙酸(EDTA)消化细胞,1 000 r/min离心5 min后去上清液,加入培养液调整细胞浓度为5×104/mL,将HaCaT细胞接种到6孔培养板生长,取指数生长期细胞进行实验。
1.3.2HaCaT细胞分组和处理 实验设5个组,分别为阴性对照组、模型组、UVB照射前给药组、UVB照射后给药组和UVB照射前后给药组。细胞生长融合至80%时,UVB照射前给药组细胞以1.0 mg/mL葛根素孵育1 h,弃上清液后以30 mJ/cm2UVB直接照射细胞;UVB照射后给药组细胞在UVB照射后以1.0 mg/mL葛根素处理1 h;UVB照射前后给药组细胞在UVB射前后各以1.0 mg/mL葛根素处理1 h。选择1.0 mg/mL葛根素浓度,是因为课题组先前研究结果显示该浓度葛根素对HaCaT细胞无细胞毒性,并且对UVB诱导的HaCaT细胞凋亡抑制作用最佳[4]。阴性对照组不接收药物和UVB处理,模型组细胞只接受UVB照射。各处理组细胞在UVB射后24 h进行指标检查。
1.3.3检测细胞内ROS UVB照射后24 h,细胞消化和离心,以4 ℃磷酸缓冲液洗涤2次,调节细胞浓度为1×106/mL,按照ROS检测试剂盒装载DCFH-DA荧光探针,以流式细胞仪检测每万个细胞的平均荧光强度,激发波长为488 nm,荧光强度代表细胞内ROS水平。
1.3.4检测细胞内抗氧化指标 细胞在UVB照射后24 h消化洗涤,调节细胞浓度为1×107/mL,在0 ℃制备细胞匀浆,离心后将细胞上清液转移至干净试管,按照各试剂盒说明书检测T-AOC、MDA、SOD、CAT、GSH-Px水平。
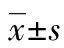
2 结 果
2.1葛根素对HaCaT细胞内ROS水平的影响 照射UVB的HaCaT细胞内ROS水平显著升高,给予葛根素处理后ROS水平均下降,见图1。
2.2葛根素对HaCaT细胞内T-AOC和MDA水平的影响 与阴性对照组相比,模型组T-AOC水平明显下降,而MDA水平明显升高,差异有统计学意义(P<0.01)。与模型组比较,UVB照射前给药组与UVB照射前后给药组HaCaT细胞内T-AOC水平下降,而MDA水平上升,差异有统计学意义(P<0.05);UVB照射后给药组HaCaT细胞内T-AOC和MDA水平与模型组比较差异无统计学意义(P>0.05)。见表1。
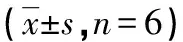
表1 葛根素对HaCaT细胞内T-AOC和MDA水平的影响
##:P<0.01,与阴性对照组比较;*:P< 0.05,**:P<0.01,与模型组比较。
2.3葛根素对HaCaT细胞内SOD、CAT、GSH-Px水平的影响 与阴性对照组比较,模型组细胞内SOD、CAT、GSH-Px水平均明显下降(P<0.01)。与模型组比较,UVB照射前给药组和UVB照射前后给药组细胞内SOD、CAT、GSH-Px水平均上升(P<0.05);UVB照射后给药组细胞内SOD水平上升(P<0.05),但CAT和GSH-Px水平无明显变化(P>0.05)。见表2。
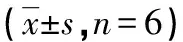
表2 葛根素对HaCaT细胞内SOD、CAT、GSH-Px水平的影响
##:P< 0.01,与阴性对照组比较;*:P< 0.05,**:P< 0.01,与模型组比较。
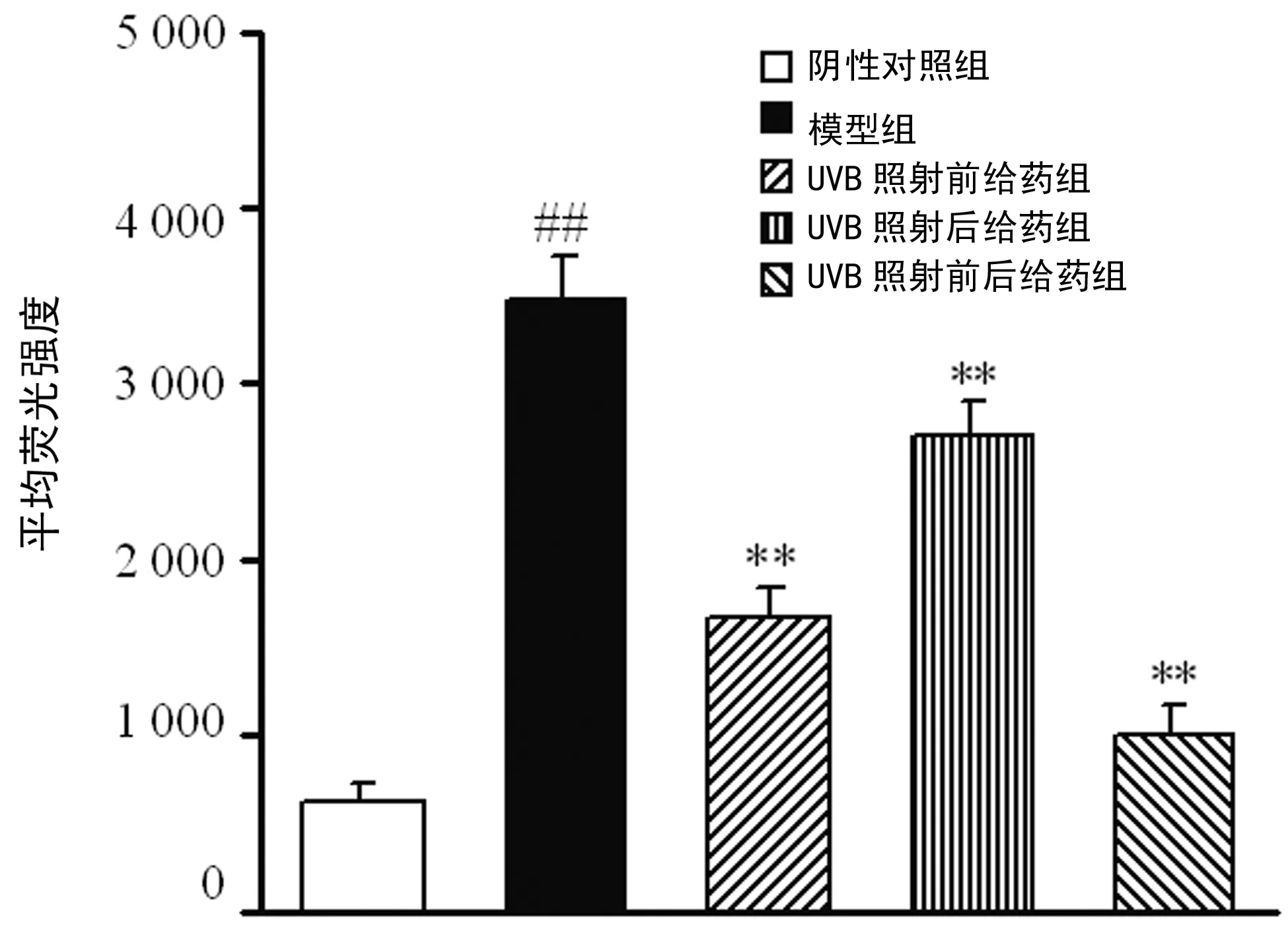
##:P<0.01,与阴性对照组比较;**:P<0.01,与模型组比较。
3 讨 论
阳光紫外线根据波长分为UVA、UVB和UVC,UVB虽然只占其中4%,但对皮肤晒伤和皮肤癌的形成起主要作用。首先,UVB可被皮肤角质形成细胞DNA吸收,直接导致DNA损伤、癌基因和抑癌基因突变。其次,UVB可触发光氧化反应,增加细胞内ROS。ROS水平超过细胞抗氧化系统防御能力引起细胞损伤[5-6]。因此针对UVB的抗氧化剂一直是这一领域的热点。葛根素药用制剂从2003年起被SFDA批准注册,主要作为心血管治疗药物使用。虽然葛根素在心脑血管病治疗中显示抗氧化作用,但是尚未有抗紫外线氧化损伤的研究报道。
有关葛根素的大多数研究显示,葛根素能直接清除氧自由基,对多种细胞损伤具有保护作用,可减轻缺血-再灌注引起的心肌细胞、胰岛细胞、肝细胞和神经细胞损伤,此外对糖尿病胰腺细胞、乙醇中毒肝细胞和阿尔茨海默病神经细胞也有很好的保护作用[3,7-13]。在抗氧化机理方面,Zhao等[14]研究显示葛根素提高乙醇损伤大鼠肝脏内SOD和GSH-Px水平,同时降低MDA水平;Wan等[15]发现葛根素可提高缺血-再灌注大鼠脑组织SOD水平并降低MDA水平。与此一致的是,本文无论预防性还是治疗性葛根素处理,均不同程度增加UVB照射细胞相关抗氧化指标和减少ROS水平。相比之下,UVB照射前后均给葛根素增加细胞内SOD、CAT和GSH-Px水平的效果更佳,而UVB照射后给葛根素处理除了增加细胞内SOD水平外,对其他指标均无影响。这表明葛根素不同处理方式影响其抗氧化能力,其中预防性结合治疗性处理效果最佳,单纯预防性处理其次,单纯治疗性处理最差。
[1]邝枣园,吴伟,葛根素,等.川芎嗪注射液对羟自由基水平的影响[J].中药新药与临床药理,1998,
9(2):92-93.
[2]朱庆磊,吕欣然,何爱霞.葛根素对氧自由基的清除和抗氧化性损伤作用[J].解放军药学学报,2001,17(1):1-3.
[3]卢金萍,任江华,姜黎.葛根素对心肌缺血-再灌注损伤能量代谢的影响[J].山东中医杂志,2009,28(12):867-868.
[4]黄绵庆,杨照新,姚茂忠,等.预防性葛根素抑制UVB诱导的HaCaT细胞凋亡[J].中国热带医学,2011,11(11):1379-1380.
[5]Saitoh Y,Miyanishi A,Mizuno H,et al.Super-highly hydroxylated fullerene derivative protects human keratinocytes from UV-induced cell injuries together with the decreases in intracellular ROS Generation and DNA damages[J].J Photochem Photobiol B,2011,102(1):69-76.
[6]Afaq F,Zaid MA,Khan N,et al.Protective effect of pomegranate-derived products on UVB-mediated damage in human reconstituted skin[J].Exp Dermatol,2009,18(6):553-561.
[7]王嵘,苏晓灵,周白丽.葛根素对兔心肌缺血-再灌注损伤时SOD、ANF含量的变化[J].青海医学院学报,2005,26(2):102-104.
[8]李卫东,刘顺英.葛根素清除急性胰腺炎大鼠氧自由基作用的实验研究[J].江苏中医药,2007,39(1):55-56.
[9]李涛,邹志森.葛根素对大鼠肝缺血-再灌注损伤的保护作用[J].中药药理与临床,2004,20(4):15-16.
[10]王玉,朱慧渊,郭莹,等.葛根素对局灶性脑缺血-再灌注模型大鼠脑组织水肿及神经细胞Na+-K+-ATPase,Ga2+-ATPase活性的影响[J].中国中医急症,2007,16(1):70-71.
[11]曹莉,茅彩萍,顾振纶.葛根素对胰岛素抵抗大鼠糖耐量及胰腺组织形态学的影响[J].中国血液流变学杂志,2008,18(1):47-48,95.
[12]赵敏,杜艳秋,李长喻.葛根素对急性酒精中毒大鼠保护作用的实验研究[J].中国现代医学杂志,2006,16(17):2610-2612,2615.
[13]张海英,胡海涛,刘亦恒,等.葛根素对Aβ25-35诱导PC12细胞凋亡的影响[J].中药材,2008,31(4):543-546.
[14]Zhao M,Du YQ,Yuan L,et al.Protective effect of puerarin on acute alcoholic liver injury[J].Am J Chin Med,2010,38(2):241-249.
[15]Wan H,Zhu H,Tian M,et al.Protective effect of chuanxiongzine-puerarin in a rat model of transient middle cerebral artery occlusion-induced focal cerebral ischemia[J].Nucl Med Commun,2008,29(12):1113-1122.
