不同来源鹿茸肽对成骨细胞作用的比较
2012-01-06刘中天刘吉华高向东
刘中天,刘吉华,洪 勇,姜 宁,高向东,尚 靖
(中国药科大学 1.新药筛选中心,2.生命科学与技术学院,3.中药学院,江苏 南京 210009)
不同来源鹿茸肽对成骨细胞作用的比较
刘中天1,刘吉华3,洪 勇2,姜 宁2,高向东2,尚 靖1
(中国药科大学 1.新药筛选中心,2.生命科学与技术学院,3.中药学院,江苏 南京 210009)
目的 比较塔里木马鹿茸肽与梅花鹿茸肽对成骨细胞增殖分化的影响,并分析药材差异性。方法 以相同工艺从两种鹿茸中提取不同肽段的鹿茸肽。以MTT法及PNPP法检测不同肽段鹿茸肽对原代大鼠成骨细胞的增殖分化作用。采用粉末鉴别及薄层色谱法分析塔里木马鹿茸与梅花鹿茸的结构及甘氨酸含量差异。以凝胶电泳法及HPLC法分析鹿茸肽成分差异。结果 从塔里木马鹿茸中分离得到3种不同肽段的鹿茸肽,分别为相对分子质量(Mr)>30 kD组分(样A)、Mr5~10 kD组分(样B)、Mr>5 kD组分(样C);从梅花鹿茸中分离得到3种不同肽段的鹿茸肽,分别为Mr>30 kD组分(样D)、Mr5~10 kD组分(样E)、总肽组分(样F)。样B和C显著促进大鼠成骨细胞增殖并上调碱性磷酸酶活性,样F仅具有促进细胞增殖作用,其余组分作用微弱。塔里木马鹿茸与梅花鹿茸粉末形态类似,但含有更多甘氨酸成分,其鹿茸肽含更多潜在活性成分。结论 塔里木马鹿茸与梅花鹿茸存在较大差异,前者包含抗骨质疏松成分。
塔里木马鹿;梅花鹿;鹿茸肽;成骨细胞;增殖;碱性磷酸酶
鹿茸为鹿科动物马鹿(Cervus elaphus Linnaeus)和梅花鹿(Cervus nippon Temminck)未骨化或稍骨化的幼角,具有益精血、强筋骨、壮肾阳等功效[1],长期被列为同一药材入药。新疆塔里木马鹿(Cervus elaphus yarkandensis)为我国重要的马鹿亚种,主要分布于塔里木盆地各沿河地带[2],但塔里木马鹿茸的药用价值鲜有报道。
本研究拟用相同工艺提取分离不同肽段的塔里木马鹿茸肽与梅花鹿茸肽,并对其生物活性及成分差异做初步研究,通过与梅花鹿茸肽比较,来探讨塔里木马鹿茸的药用价值。
1 材料
塔里木马鹿茸及梅花鹿茸由新疆华士丹药业有限公司提供,经中国药科大学刘吉华教授鉴定为鹿茸。
α-MEM培养基及胎牛血清,美国invitrogen公司;四甲基偶氮唑盐(MTT)、茜素红、Ⅱ型胶原酶、维生素C、β甘油磷酸二钠盐、TritonX-100,美国Sigma公司;Sephadex G-75蛋白标准品(3.0~70 kD),中国科学院上海生化研究所;BCA蛋白定量试剂盒、BCIP/NBT碱性磷酸酶(ALP)显色试剂盒,碧云天生物技术研究所;ALP检测试剂盒,日本Wako公司。
倒置显微镜,日本Olympus公司;Powerpac universal型电泳仪、ChemiDoc XRS凝胶成像仪,美国Bio-rad公司;LC-2010 HT高效液相色谱仪、LcSolution1.11sp1工作站,日本Shimadzu公司;Safire2型微孔板测读仪,瑞士TECAN公司。
2 方法
2.1 鹿茸肽的制备
分别将塔里木马鹿茸干品与梅花鹿茸干品锯成小段,浸入乙醇-水(2∶1),4 ℃,浸泡 7 d,取出切片,37℃烘干,干茸片打成粉末,称重,按每1 g加入5 mmol/L NaAc-HAc缓冲液(pH 3.5)20 mL,冰浴搅拌浸提12 h;4℃,12 000 r/min离心20 min,得上清;-0.1 mPa,0.45 μm 水系混合滤膜滤过,滤出液为鹿茸干品总多肽粗提液,经乙醇沉淀除杂蛋白,每1 000 mL 分别经30000 MWCO、10000 MWCO、5000 MWCO切向超滤膜包截留浓缩至约50 mL,分别得鹿茸多肽组分相对分子质量(Mr>30 kD、Mr>10 kD、Mr>5 kD。所得鹿茸多肽组分Mr>10 kD经5000 MWCO(PES)切向超滤膜包截留浓缩,得鹿茸多肽组分Mr5~10 kD。经冷冻干燥,得马鹿茸多肽组分 Mr>30 kD(样 A)、Mr5 ~10 kD(样 B)、Mr>5 kD(样C),梅花鹿茸多肽组分Mr>30 kD(样 D)、Mr5 ~10 kD(样 E)及梅花鹿茸总肽(样 F)[3-4]。
2.2 鹿茸肽对成骨细胞作用
2.2.1 原代成骨细胞培养 采用酶消化法培养大鼠成骨细胞,取新生SD大鼠(雌雄不限),取出颅骨,清理骨膜、血管等结缔组织,磷酸盐缓冲液(PBS)清洗颅骨3遍至白色,并剪成1 mm×1 mm的骨片。加入0.25%胰蛋白酶溶液于37℃消化20 min,以清除纤维组织;加入0.1%Ⅱ型胶原酶溶液于37℃振荡消化60 min。细胞消化液经200目筛网过滤,于1 000 r/min离心10 min,沉淀细胞用α-MEM+10%FBS制成悬液,重复上述Ⅱ型胶原酶消化步骤。将2次消化获得的细胞混匀,并接种于培养瓶内,置于5%CO2培养箱中培养。每2~3 d换液一次,倒置显微镜下观察细胞生长状况,待细胞生长至80%融合,用0.25%胰酶(含0.02%EDTA)溶液消化传代培养。取生长良好的第3代细胞用于实验及细胞功能鉴定[5]。
2.2.2 成骨细胞增殖测定 将第3代成骨细胞以1×105细胞/孔,接种于96孔培养板。培养24 h后更换低血清 α-MEM,分别加入 0.1,1.0,10.0 μg/mL样品A~F,每组重复5孔。给药1,3,7 d,每孔加入0.5 mg/mL MTT溶液20 μL,于37 ℃、5%CO2条件下继续孵育4 h,弃去培养液,加入二甲亚砜(DMSO)150μL,振荡10 min,用酶标仪在570 nm波长处测定吸光度值。
2.2.3 ALP活力测定 将第3代成骨细胞,以1×106细胞/孔,接种于6孔板中。培养24 h后更换低血清 α-MEM,分别加入 0.1,1.0,10.0 μg/mL 样品A~F,每组重复5孔。给药3和7 d后,TritonX-100提取蛋白,并用BCA法定量检测蛋白。依据ALP检测试剂盒说明,在96孔板中加入蛋白上清液20 μL与PNPP(对硝基苯磷酸二钠)溶液100μL。于37℃下孵育15 min,中止反应,用酶标仪在405 nm波长处测定吸光度值。
2.3 鹿茸粉末形态比较
分别取塔里木马鹿鹿茸与梅花鹿鹿茸粉末少许,醋酸甘油装片,镜下观察其表皮角质层、毛茸及骨碎片形态。
2.4 鹿茸薄层色谱比较
分别取塔里木马鹿茸粉末与梅花鹿茸粉末0.4 g,加 70%乙醇 5 mL,超声处理 15 min,滤过,滤液作为供试品溶液。取甘氨酸对照品,加70%乙醇制成2 mg/mL对照品溶液。吸取供试品溶液各8 μL、对照品溶液1μL,分别点于同一硅胶G薄层板上,以正丁醇-冰醋酸-水(3∶1∶1)为展开剂,展开,取出,晾干,喷以2%茚三酮丙酮溶液,在105℃加热至斑点显色清晰。
2.5 Tricine-SDS-PAGE 电泳
分别制备并灌注分离胶(凝胶浓度为16.5%)、间隙胶(凝胶浓度为10%)和浓缩胶(凝胶浓度为4%)。上样鹿茸肽样品20μg,采用恒定电压电泳方法,浓缩胶及夹层胶电泳:电压60 V,电流15 mA;分离胶电泳:电压120 V,电流25 mA,至电泳结束。将凝胶置于固定液(0.5%戊二醛,30%乙醇)固定20 min;置于染色液(50%甲醇,10%乙醇,0.2%G-250)染色30 min;置于脱色液(45%甲醇,10%冰醋酸)脱色30 min,并将胶放入水中。当电泳条带清晰,脱色完成[6]。
表1 鹿茸肽促成骨细胞增殖作用(n=5s)Tab.1 Effects of velvet peptides on osteoblast proliferation(n=5s)

表1 鹿茸肽促成骨细胞增殖作用(n=5s)Tab.1 Effects of velvet peptides on osteoblast proliferation(n=5s)
与对照组比较:1 P <0.05,2 P <0.01,3 P <0.0011 P <0.05,2 P <0.01,3 P <0.001 vs control group
?
2.6 HPLC 分析
2.6.1 色谱条件 DIKMA Diamonsil-C18分析柱(250 mm ×4.6 mm,5 μm);C18预柱;柱温:40 ℃,流速:0.6 mL/min;进样量:20 μL;检测波长:280 nm;流动相:乙腈-0.1%三氟乙酸溶液(40∶60)。
2.6.2 供试品溶液制备 精密称取鹿茸肽样品各100μg,分别置于5 mL量瓶内,各加20 mmol/L醋酸钠-醋酸缓冲液(pH 4.5),摇匀,滤过,得供试品溶液。
2.7 统计分析
3 结果
3.1 鹿茸肽对成骨细胞作用比较
3.1.1 鹿茸肽对成骨细胞增殖作用影响 结果见表1。与对照组相比,给予鹿茸肽1 d,马鹿茸肽(样A、B、C)及梅花鹿茸肽(样D和E)均对成骨细胞无明显增殖作用,但中剂量梅花鹿鹿茸总肽(样F)表现出明显增殖作用(P<0.05)。给予鹿茸肽3 d,中低剂量马鹿鹿茸肽样C显著促进成骨细胞增殖(P<0.01);梅花鹿鹿茸肽组中,低剂量样D、中高剂量样F显著促进成骨细胞增殖(P<0.01)。给予鹿茸多肽7 d,中高剂量马鹿茸肽样B、低剂量马鹿鹿茸肽样C及中剂量梅花鹿茸样F表现出显著促成骨细胞增殖作用(P<0.05或0.01)。结果表明,塔里木马鹿茸肽(Mr5~10 kD、Mr>5 kD)及梅花鹿鹿茸总肽具有显著促成骨细胞增殖作用;与梅花鹿茸肽(Mr5~10 kD)相比,相同组分的塔里木马鹿茸肽显著促进成骨细胞增殖。
3.1.2 鹿茸肽对成骨细胞ALP活性影响 结果见表2。给予鹿茸肽3 d,马鹿茸肽及梅花鹿茸肽均对ALP活性无明显上调作用。与对照组相比,多数鹿茸肽对ALP活性起到一定抑制作用。给予鹿茸肽7 d,成骨细胞ALP活性上调。与对照组相比,梅花鹿鹿茸肽对ALP活性无显著上调作用;而中低剂量的马鹿茸肽能显著上调ALP活性,其中低剂量样B和C对ALP活性升高作用尤为明显(P<0.01或0.001)。结果表明,与梅花鹿茸肽(Mr5~10 kD)相比,相同组分塔里木马鹿茸肽显著促进成骨细胞分化。
表2 鹿茸肽对成骨细胞ALP活性的影响(n=5s)Tab.2 Effects of velvet peptides on ALPactivity of primary osteoblast(n=5s)
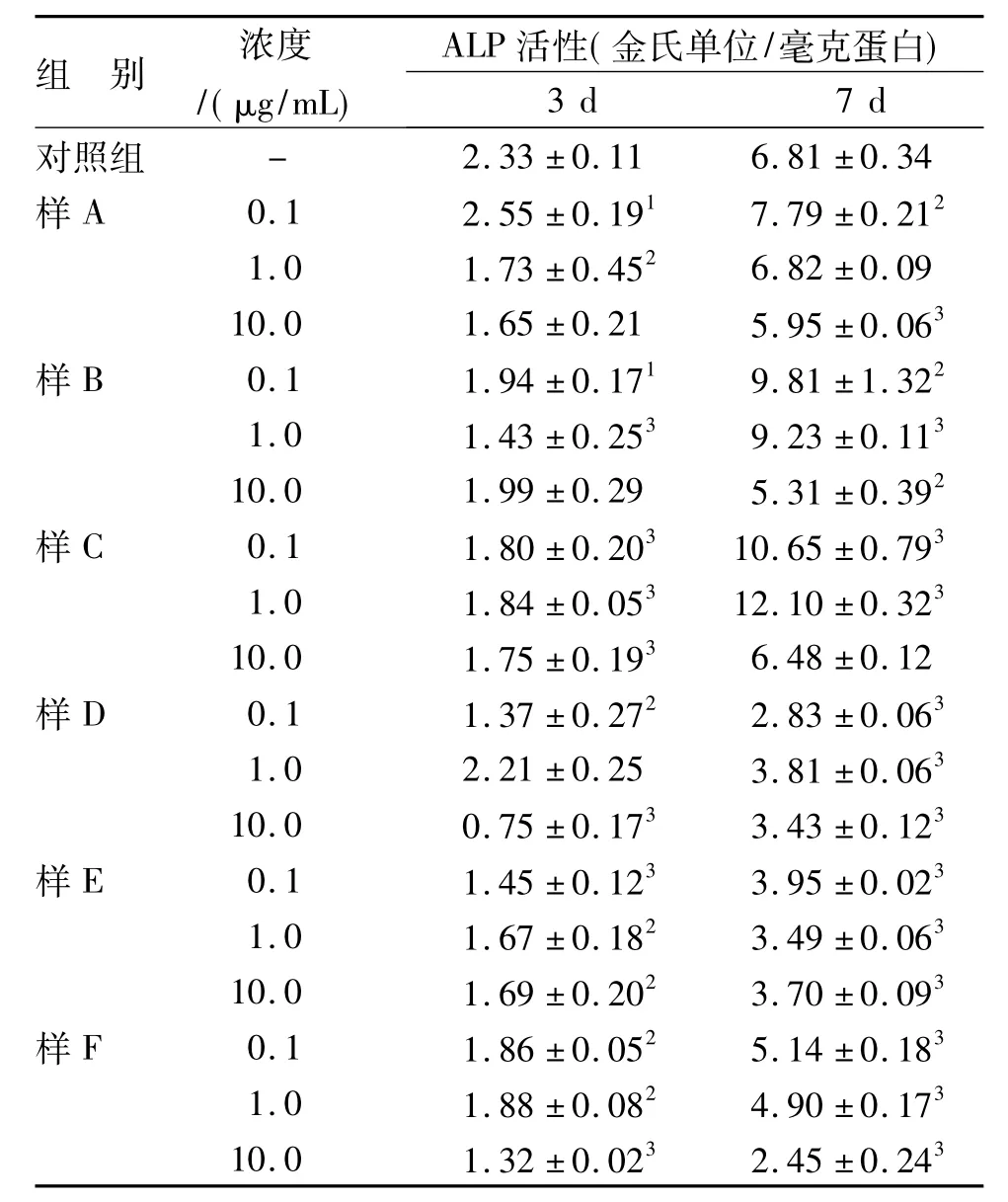
表2 鹿茸肽对成骨细胞ALP活性的影响(n=5s)Tab.2 Effects of velvet peptides on ALPactivity of primary osteoblast(n=5s)
与对照组比较:1 P <0.05,2 P <0.01,3 P <0.0011 P <0.05,2 P <0.01,3 P <0.001 vs control group
?
3.2 鹿茸粉末形态及甘氨酸含量比较
3.2.1 鹿茸粉末形态比较 塔里木马鹿茸粉末淡棕黄色,镜下观察可见表皮角质层淡棕色或棕黄色,可见多角形纹格,表面颗粒深棕色;茸毛脱落后的毛窝呈圆洞状。毛茸较多较粗,碎断,毛茸中部直径22~85μm,表面由扁平细胞(鳞片)呈复瓦状排列的毛小皮包围,细胞的游离缘指向毛尖,皮质有棕色色素;髓质断续或无。骨碎片表面有纵纹及点状孔隙;骨陷窝呈类圆形或类梭形,边缘骨小管呈放射状沟纹(图2A)。梅花鹿鹿茸粉末形态与塔里木马鹿茸粉末形态类似(图2B),两者无明显区别。
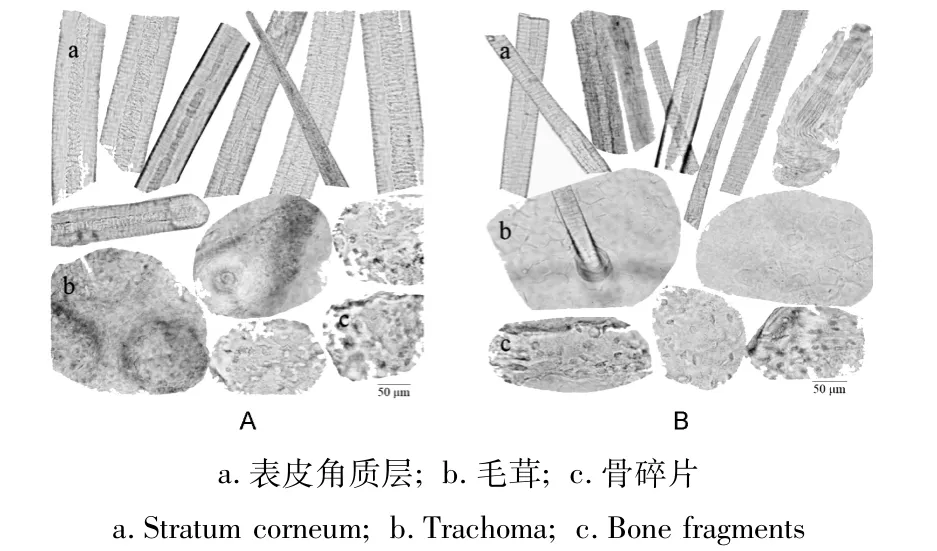
图2 塔里木马鹿茸(A)和梅花鹿茸鹿茸(B)粉末结构鉴定Fig.2 Microscopic identification of Cervus elaphus yarkandensis antler powder(A)and Cervus nippon Temminck antler powder(B)
3.2.2 鹿茸甘氨酸含量比较 由薄层色谱图(图3)可知,与甘氨酸对照品相比,鹿茸醇提液的色谱颜色均较淡。与梅花鹿茸色谱相对应位置上,塔里木马鹿茸显相同棕色主副斑点,且颜色较深。斑点颜色深浅表明,塔里木马鹿茸较梅花鹿茸含有更多甘氨酸成分。

图3 鹿茸薄层色谱鉴别Fig.3 Thin layer chromatography assay of antlers
3.3 鹿茸肽成分比较
3.3.1 鹿茸肽电泳条带比较 鹿茸肽Mr5~10 kD组分的活性差异提示,塔里木马鹿茸肽与梅花鹿茸肽可能存在成分差异。将鹿茸肽Mr5~10 kD组分进行Trincine-SDS-PAGE检测,可清晰观察到马鹿茸肽(样B)与梅花鹿茸肽(样E)均集中于Mr6~7 kD,电泳条带清晰可见(图4)。结果表明,塔里木马鹿茸肽活性组分(Mr5~10 kD)与梅花鹿茸肽组分(Mr5~10 kD)条带无显著差异。
3.3.2 鹿茸肽HPLC分析比较 由HPLC色谱图(图5)可知,5~10 kD塔里木马鹿茸肽及梅花鹿茸肽含有共有吸收峰 a、b、c、d、e、f,其保留时间分别为3.8,5.2,8.2,10.8,11.8 和 16.0 min。与梅花鹿茸肽Mr5~10 kD相比,马鹿茸肽Mr5~10 kD含有特征吸收峰 g、h、i,其保留时间分别为 5.9,6.7 和18.7 min(图5A)。结果表明,塔里木马鹿茸肽含有异于梅花鹿茸肽的成分,这可能是其促进成骨细胞增殖分化的物质基础。
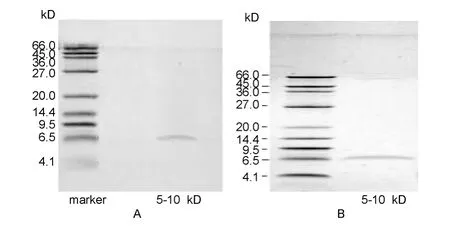
图4 塔里木马鹿茸肽(A)和梅花鹿茸肽(B)Trincine-SDSPAGE电泳Fig.4 Trincine-SDS-PAGE assay of velvet peptides of Cervus elaphus yarkandensis(A)and Cervus nippon Temminck(B)

图5 塔里木马鹿茸肽(A)和梅花鹿茸肽(B)M r 5-10 kD组分HPLC图Fig.5 HPLC chromatograms of M r 5-10 kD velvet peptides of Cervus elaphus yarkandensis(A)and Cervus nippon Temminck(B)
4 讨论
鹿茸为我国名贵补益中药,可应用于畏寒乏力、阳痿滑精、腰脊酸软、小儿骨软行迟及免疫力低下等症的治疗[7-8]。中国药典将马鹿与梅花鹿归为同一药材,临床上也鲜见其疗效对比的报道。本研究通过塔里木马鹿茸与梅花鹿茸对比,表明不同来源鹿茸肽对成骨细胞活性作用存在差异,这与相关报道结果类似[9]。将同属不同种鹿茸列为同一药材是不严谨的,并有碍鹿茸相关制剂的开发。
ALP是成骨细胞的特异性酶,大量表达的ALP显示成骨细胞向成熟成骨细胞分化能力上升[10]。在成骨细胞生长中早期,塔里木马鹿茸肽抑制ALP表达;在成骨细胞生长中晚期,塔里木马鹿肽(Mr5~10 kD、Mr>5 kD)却显著促进细胞ALP表达。这表明塔里木马鹿茸肽可能同时含有成骨分化激动剂和抑制剂,成骨分化抑制剂在细胞生长中早期发挥主要效应,而激动剂在细胞生长中晚期起主要作用,显著上调ALP活性。梅花鹿茸肽抑制ALP表达,可能是由于梅花鹿茸经干燥后,活性成分被一定程度破坏[11],而抑制成分并未遭完全破坏。研究表明,塔里木马鹿茸不同于梅花鹿茸,前者含有防治骨质疏松的潜在成分。
[1]中国药典[S].一部.2010:303.
[2]马合木提·哈力克.新疆塔里木马鹿(Cervus elaphus yarkandensis)研究进展及展望[J].新疆大学学报:自然科学版,2009,26(3):262-270.
[3]Guan SW,Duan L X,Li Y Y,et al.A novel polypeptide from Cervus nippon Temminck proliferation of epidermal cells and NIH3T3 cell line[J].Acta Biochim Pol,2006,53(2):395-397.
[4]王 丰,梅子青,周秋丽,等.鹿茸多肽的分离纯化及药理活性[J].吉林大学学报,2003,41(1):111-114.
[5]王洪复.骨细胞图谱与骨细胞体外培养技术[M].上海:上海科学技术出版社,2001:54.
[6]孙 波,迟玉杰,徐 宁,等.Tricine-SDS-PAGE电泳检测蛋清肽分子量的研究[J].食品科学,2008,29(5):385-388.
[7]谢 敏,朱至明,欧兰芳.鹿茸粉的制备与临床疗效观察[J].河南中医学院学报,2006,21(4):70.
[8]吉静娴,钱 璟,黄凤杰,等.鹿茸的活性物质及药理作用的研究进展[J].中国生化药物杂志,2009,30(2):141-143..
[9]周秋丽,刘永强,王 颖,等.梅花鹿茸和马鹿茸多肽化学性质及生物活性比较[J].中国中药杂志,2001,26(10):699-702.
[10] Lian J B,Stein G S.Development of the osteoblast phenotype:molecular mechanisms mediating osteoblast growth and differentiation[J].Iowa Orthop J,1995,15(3):118-140.
[11]田再民,武玉环,龚学臣,等.加热对鲜鹿茸中碱性磷酸酶活性的影响[J].安徽农业科学,2009,37(5):1874-1875.
Comparison of the effects of velvet peptides isolated from different antlers on osteoblast activation
LIU Zhong-tian1,LIU Ji-hua3,HONG Yong2,JIANG Ning2,GAO Xiang-dong2,SHANG Jing1
(1.New Drug Screening Center,2.Shool of Life and Technology,3.School of Traditional Chinese Medicine,China Pharmaceutical University,Nanjing 210009,China)
Purpose To compare the effects of velvet peptides isolated from antlers of Tarim red deer(Cervus elaphus Yarkandensis)and sika deer(Cervus nippon Temminck)on osteoblast proliferation and differentiation,and to analyze the difference between the two antlers.Methods The velvet peptides were isolated from the above mentioned antlers by same technique.Effects of velvet peptides on osteoblast proliferation and Alkaline phosphatase(ALP)activity were determinated through MTT and PNPP assay.Microscopic method was adopted to identify the structures of the two antlers.Glycine content of antlers was tested by thin layer chromatography assay.The constituents of velvet peptides were identified by Trincine-SDS-PAGE and HPLC,respectively.Results Three different peptides,Mr>30 kD(A),Mr5-10 kD(B)and Mr>5 kD(C),were isolated from the antler of Tarim red deer.Meanwhile,other three peptides,Mr>30 kD(D),Mr5-10 kD(E)and total peptides(F),were extracted from the antler of sika deer.Sample B and Cincreased osteoblast proliferation and ALPactivity significantly,while sample Fcould only stimulate cell proliferation.Antlers of Tarim red deer contain more glycine inside than those of sika deer,though their structures were similar.More potential functional constituents were found in the ve lvet peptides isol-ated from Tarim red deer.Conclusion The Tarim red deer and sika deer are different from each other.The velvet peptides from Tarim red deer may function as antiosteoporotic agents.
Tarim red deer(Cervus elaphus Yarkandensis);sika deer(Cervus nippon Temminck);velvet peptides;primary osteoblast;proliferation;alkaline phosphatase
R284.2;R285.5;R282.74
A
1005-1678(2012)06-0701-05
2012-04-12
新疆维吾尔白治区科技型中小企业技术创新基金项目(201153116);乌鲁木齐高新技术产业开发区科技创新基金项目(CX09209W)
刘中天,男,硕士研究生,E-mail:wojiushilzt@yahoo.com.cn;尚 靖,女,通信作者,博士,教授,博士生导师,研究方向:天然药物活性研究;高向东,女,通信作者,博士,教授,博士生导师,研究方向:生物新药研制,E-mail:xdgao@cpu.edu.cn。
