披碱草内生真菌共生体中麦角生物碱的组织分布与季节动态
2012-01-02徐瑞南志标周雁飞李春杰
徐瑞,南志标,周雁飞,李春杰
(兰州大学草地农业科技学院 草地农业生态系统国家重点实验室,甘肃 兰州730020)
*披碱草(Elymusdahuricus)是禾本科(Poaceae)披碱草属(Elymus)多年生、疏丛型、旱中生禾草。其野生种主要分布于北半球寒温带的蒙古、俄罗斯、日本、朝鲜、土耳其、印度等国以及我国北方大部分地区,其对水热要求不严,适应环境能力强,是我国披碱草属牧草中分布最广、最为常见的种[1]。在改良退化草地、发展生产、保护环境中有重要作用[2]。禾草内生真菌(grass endophyte;fungal endophyte;endophytic fungi)是指生长在植株体内并完成全部或大部分生活周期,而禾草不显示外部症状的一大类真菌[3]。真菌和禾草共同形成互惠互利的共生体,绝大多数的真菌在宿主植物内产生生物碱,以Peramine为代表的吡咯并吡嗪类生物碱,麦角生物碱,饱和吡咯化合物Loline,以及吲哚双萜类生物碱Lolitrem[4]。其中Peramine对阿根廷象鼻虫(Listronotusbonariensis)有毒性,但对家畜无危害,而麦角生物碱和Lolitrem对家畜和昆虫都有毒性[5,6]。目前,对生物碱的研究大都集中在生物碱的分类、提取和检测方法、生物碱的合成机理以及生物碱对共生体的生理生态作用上。对禾草内生真菌共生体中生物碱的研究报道主要集中在高羊茅(Festucaarundinacea)[7-9]、多年生黑麦草(Loliumperenne)[5,6,10,11]、草地羊茅(Festucapratensis)[12]、睡眠草(Achnatherumrobustum)[13]、醉马草(Achnatheruminebrians)[14-16]。国外对披碱草内生真菌的研究主要是对加拿大披碱草(E.canadensis)和佛吉尼亚披碱草(E.virginicus)的带菌情况进行了调查[17],并发现被内生真菌侵染的加拿大披碱草中能够产生麦角生物碱,并且含量低于带菌高羊茅中的含量[18]。在我国最早关于内生真菌侵染披碱草的报道见于Nan和Li[19]在检测的3份披碱草样品中发现1份带菌,带菌率为100%。对披碱草属其他种的研究发现,中国分布4个种与内生真菌共生[3],而且内生真菌侵染显著增加了圆柱披碱草(E.cylindricus)的生物量[19]。对披碱草所带Neotyphodium属内生真菌的生理生物特性以及共生体的生长、光合速率、生理特性[2]和对水分胁迫的响应[20,21]亦作了较系统的研究,发现雾灵山和沁源种群带菌植株的叶鞘含有Peramine,Peramine在叶鞘中的含量呈季节性变化,生长季末含量较高[22]。杨松等[23]2010年研究了披碱草内生真菌共生体对3种草坪草种子与种苗的化感效应。
禾草内生真菌共生体中生物碱的种类和含量受寄主植物基因型和内生真菌基因型的影响而变化[8,24],本研究是继Zhang和Nan[22]对带菌披碱草中Peramine分布的研究后,对该共生体中麦角生物碱的分布展开研究,从而为进一步了解披碱草内生真菌共生体中麦角生物碱的合成机制提供基础资料。
1 材料与方法
1.1 供试植物
供试的披碱草带菌(E+)和不带菌(E-)种群,来自于已检测的国内9个省(自治区)、26个披碱草种群中带菌率较高的北京雾灵山(WLS)、山西沁源(QY)、山西五台山(WTS)和北京百望山(BWS)种群,于2004年5月播种于育苗盆中,4周后用苯胺蓝染色法[22]检测叶鞘带菌率,标记E+和E-植株,并于2004年7月将已标记的植株分别移栽到小区,每个种群E+和E-小区均为1.2m×2.5m,株间距为20cm,土壤营养成分含量:全P,0.072%;全 N,0.34%;全 K,2.13%;速效 P,9.39mg/kg;速效 K,282mg/kg;速效 N,96.0mg/kg;pH=7.7;盐分,0.05%[2]。移栽4周内每隔2d浇水1次,4周后不再浇水,植物的需水依靠自然降水。
1.2 取样与处理
于2009年的返青期4月1日、分蘖期6月3日、拔节期8月1日和成熟期10月1日上午10点剪取已标记的E+和E-披碱草距地面3cm左右的地上部分,并采集植物的根部。每5株作为1个混合样,每个种群各5个重复。将4,6和8月所采集的植物地上部分分成叶、茎和鞘3个部分;并将10月所采集的雾灵山、沁源和百望山种群的植物地上部分分成营养枝(叶、茎和鞘)和生殖枝(种子)部分,其中五台山种群不抽穗。将4个月份采集的4个种群的根和其他组织洗净,并用滤纸吸干水分,放于-20℃低温冰箱保存,待测。
1.3 麦角生物碱检测
麦角酰胺和麦角新碱标样以及检测方法均来自李春杰[14]的方法。将所采集的样本放于-60℃干燥24h后,取出粉碎成细粉状。称取50mg样品装于1.5mL离心管;加入1mL提取液(CHCl3∶甲醇∶NH4OH=75∶25∶2),混匀,室温条件下过夜。在10 000r/min下15℃离心5min(eppendorf 5415R离心机),挥发干燥。每个离心管中加入0.75mL的甲醇∶CCl4=1∶2和0.25mL的25mmol/L酒石酸,混匀,在12 000r/min下21℃离心5min,小心吸取上清液并经0.45μm孔径的过滤垫过滤,加入1.5mL色谱瓶,待测。所用药品均为分析纯试剂。
用Agilent 1100series高效液相色谱系统,ZORBAX-XDB C18反相色谱柱,流动相流速1mL/min,进样量20μL,以VWD紫外监测器进行检测。流动相A为0.1mol/L NH4OAc,B为乙睛/0.1mol/L NH4Oac=3/1,按照95%A液3min、70%A液22min、65%A液5min、95%A液10min流动相配比与时间,检测波长312nm。分别稀释至5,10,20mg/kg含量,以外标法建立标准相关直线方程分别为(Y为含量,X为面积):麦角酰胺Yergine=8.729 05Xergine+5.545 70(R2=0.993 1)和麦角新碱Yergonovine=8.047 21Xergonovine+0.884 155(R2=0.999 6)。
整株植物中的麦角酰胺或麦角新碱含量为叶片、茎、叶鞘和根中麦角酰胺或麦角新碱含量的平均数。
1.4 统计分析
利用SAS 9.0软件对不同组织中麦角生物碱以及整株麦角生物碱在各种群之间进行最小极差(LSD)分析,麦角酰胺和麦角新碱含量之间进行相关分析,最后用Microsoft Office Excel 2003生成图1~3。
2 结果与分析
4-10月带内生真菌(E+)的披碱草各组织中均检测到2种麦角生物碱,即麦角酰胺和麦角新碱,而不带内生真菌的披碱草在各组织中均未检测到任何一种生物碱。
2.1 供试披碱草E+种群不同组织中麦角酰胺含量的分布
在雾灵山、沁源、五台山和百望山各E+种群内,4-10月麦角酰胺在不同组织中的含量均不同(表1)。其中以4月百望山叶片中含量最高,为30.037mg/kg,8月百望山茎中含量最低,为0.471mg/kg。4个种群的带菌披碱草在营养生长的4,6和8月,麦角酰胺主要分布在叶片和叶鞘中,而在生殖生长的10月,麦角酰胺则主要集中在种子和叶片中。4月,披碱草返青初期,4个种群叶片中麦角酰胺含量最高,其次是叶鞘,分别为13.831~30.037和6.259~22.255mg/kg,其中除雾灵山种群外,其余3个种群叶片和叶鞘中麦角酰胺的含量均显著高于茎和根中的含量(P<0.05),雾灵山种群叶片中的麦角酰胺含量显著高于其他3个组织(P<0.05),且叶鞘、茎和根中麦角酰胺的含量差异不显著(P>0.05)。6月,雾灵山和沁源种群中的麦角酰胺在叶片中含量最高,分别为10.779和8.953mg/kg,其次是叶鞘、茎和根,其中雾灵山种群叶鞘和茎中麦角酰胺含量无显著差异(P>0.05),但均与叶片和根中含量差异显著(P<0.05),沁源种群叶片和叶鞘中含量差异不显著(P>0.05),但均显著高于茎和根中(P<0.05);五台山和百望山种群叶鞘中麦角酰胺含量最高,分别为7.728和8.527mg/kg,其次是叶片、茎和根,五台山叶片和茎中麦角酰胺含量无显著差异(P>0.05),但均与叶鞘和根中差异显著(P<0.05),百望山种群叶鞘和叶片中麦角酰胺含量差异不显著(P>0.05),但均高于茎和根中(P<0.05)。8月,4个种群中麦角酰胺主要分布于叶片和叶鞘中,分别为8.508~13.187和0.751~8.083mg/kg,且叶片中含量显著高于叶鞘(P<0.05),除沁源种群外,其他种群叶片和叶鞘中含量均显著高于茎和根中(P<0.05),沁源种群中叶鞘、茎和根中麦角酰胺含量之间差异不显著(P>0.05)。10月,雾灵山、沁源和百望山种群麦角酰胺主要分布在种子和叶片中,分别为5.045~8.971和3.119~6.658mg/kg,茎中含量最低,为0.472~1.169mg/kg,其中种子中含量显著高于其他组织(P<0.05);五台山种群没有结穗,叶片中麦角酰胺含量最高,为4.997mg/kg,其次是根、叶鞘和茎,各组织之间差异显著(P<0.05)。
雾灵山、沁源、五台山和百望山各E+种群的叶片、茎秆和叶鞘中麦角酰胺在生长初期(4或6月)含量最高,后期(8或10月)含量显著减小(P<0.05)。其中4个种群叶片中的麦角酰胺均于4月含量最高,10月最低,分别为13.831~30.037和3.119~6.658mg/kg,两者之间差异显著(P<0.05)。沁源和五台山种群茎中麦角酰胺于4月最高,10月最低,含量分别为5.102,8.013mg/kg和0.472,0.575mg/kg,两者差异显著(P<0.05);雾灵山和百望山种群茎中麦角酰胺分别于6和4月最高,但均于8月最低,含量分别为7.671,15.025mg/kg和0.919,0.471mg/kg,2个种群最高与最低含量之间差异均显著(P<0.05)。沁源、五台山和百望山种群叶鞘中麦角酰胺于4月最高,10月最低,含量分别为12.377~22.255和0.615~2.667mg/kg,两者之间差异显著(P<0.05);雾灵山种群麦角酰胺含量于6月最高,10月最低,分别为7.987和5.087mg/kg,两者差异显著(P<0.05)。4个种群根中麦角酰胺均于8月最低,含量为0.552~0.576mg/kg,且均显著低于其他月份(P<0.05)(表1)。
2.2 供试披碱草E+种群不同组织中麦角新碱含量的分布
在雾灵山、沁源、五台山和百望山各E+种群内,4-10月麦角新碱在不同组织中的含量均不同(表2)。4个种群中麦角新碱的含量以百望山种群4月叶片中含量最高,为8.226mg/kg,8月百望山种群茎中没有测得麦角新碱。4个种群的带菌披碱草在营养生长的4,6和8月,麦角新碱主要分布于叶片和叶鞘中,在生殖生长的10月中,麦角新碱主要集中于种子和叶片。4月,4个种群麦角新碱主要分布于叶片和叶鞘中,分别为5.102~8.226和1.757~5.490mg/kg,除雾灵山种群外,其他3个种群叶片中的麦角新碱含量均显著高于其他组织(P<0.05),雾灵山种群叶片中的含量显著高于茎和根中(P<0.05)。6月,雾灵山、五台山和百望山种群麦角新碱于叶片和叶鞘中含量最高,分别为3.274~4.779和0.937~3.023mg/kg,其中叶片中含量显著高于茎秆和根(P<0.05);沁源种群中麦角新碱主要分布于叶鞘和叶片中,分别为4.789和4.615mg/kg,各组织之间差异显著(P<0.05)。8月,4个种群中麦角新碱主要分布在叶片和叶鞘,分别为2.206~3.326和0.268~2.881 mg/kg,其中雾灵山种群各组织之间差异显著(P<0.05);沁源种群中叶片中含量显著高于其他3个组织(P<0.05),而叶鞘、根和茎中含量差异不显著(P>0.05);五台山和百望山种群叶片和叶鞘、根和茎中含量差异均不显著(P>0.05),但前者显著高于后者(P<0.05)。10月,雾灵山、沁源和百望山3个种群中麦角新碱主要分布于种子和叶片中,分别为1.647~5.664和1.890~2.251mg/kg,茎中含量最低,为0.137~0.146mg/kg,其中雾灵山和沁源种群种子中含量显著高于其他组织(P<0.05),百望山种群种子和叶片中麦角新碱含量之间无显著差异(P>0.05),但均显著高于其他组织(P<0.05);五台山种群没有结穗,麦角新碱主要集中于叶片,为1.353 mg/kg,且显著高于其他组织(P<0.05),其次是根,茎中含量最低,为0.005mg/kg。
雾灵山、沁源、五台山和百望山各E+种群的叶片、茎秆和叶鞘中麦角新碱在生长初期(4或6月)含量最高,后期(8或10月)含量显著减小(P<0.05)。其中,4个种群叶片中麦角新碱含量均于4月最高,10月最低,分别为5.102~8.226和1.353~2.251mg/kg,两者差异显著(P<0.05)。4个种群茎中麦角新碱含量均于4月最高,为1.209~4.971mg/kg;雾灵山和五台山种群麦角新碱含量于10月最低,而沁源和百望山种群含量于8月最低,分别为0.137,0.005mg/kg和0.063,0mg/kg,其中各种群最高含量与最低含量之间差异显著(P<0.05)。雾灵山、五台山和百望山种群叶鞘中的麦角新碱含量均于4月最高,10月最低,分别为1.757~5.490和0.341~0.834mg/kg,两者之间差异显著(P<0.05);沁源种群麦角新碱含量于6月最高,10月最低,分别为4.789和0.147mg/kg,两者之间差异显著(P<0.05)。4个种群根中的麦角新碱含量均于8月最低,4月最高,分别为0.128~0.283和0.881~3.207mg/kg,其中雾灵山种群各月份之间差异显著(P<0.05);沁源和百望山种群6,8和10月差异不显著(P>0.05),且显著低于4月(P<0.05);五台山种群4和10月,6和8月之间差异不显著(P>0.05),且前者显著高于后者(P<0.05)(表2)。
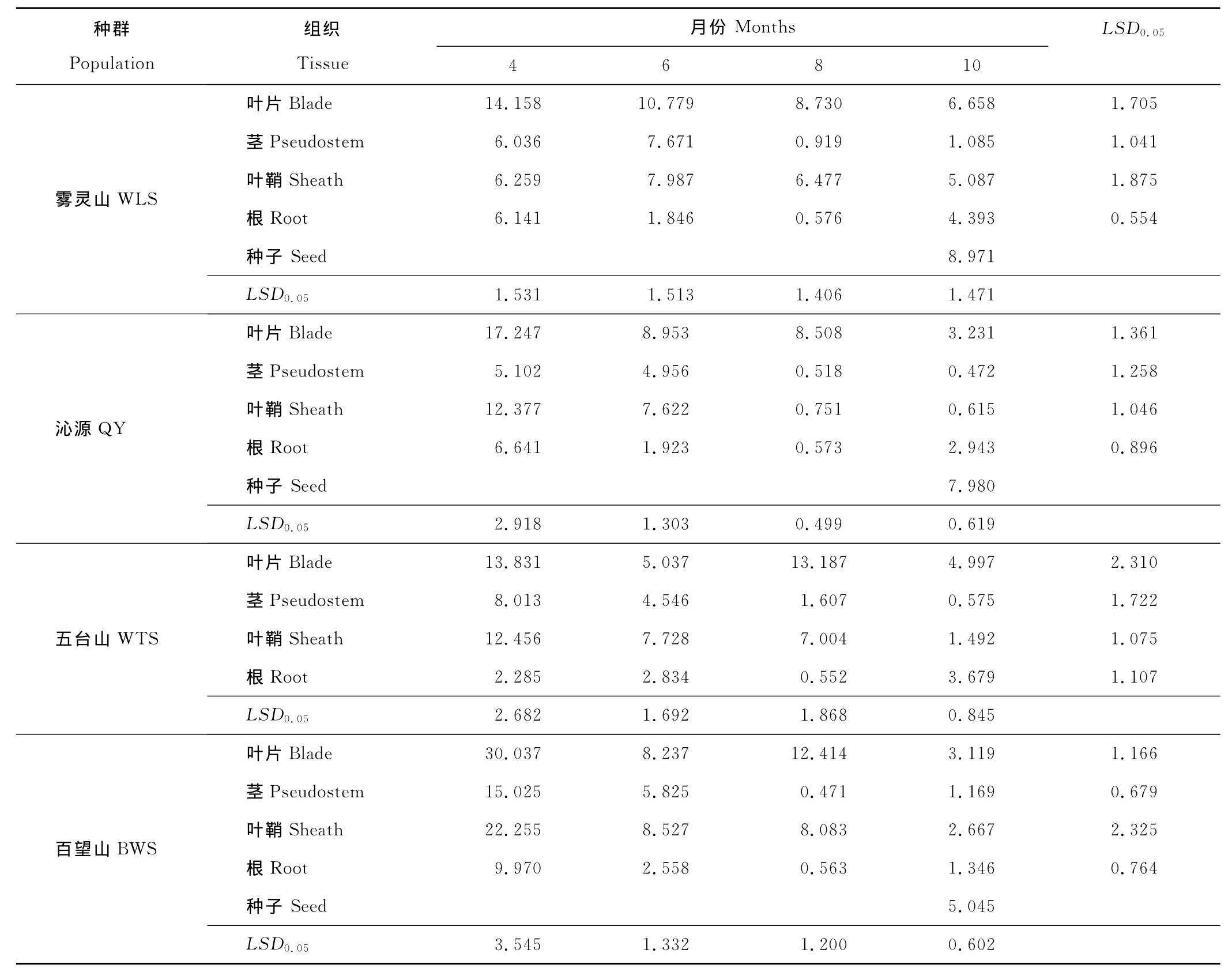
表1 4个披碱草E+种群4-10月各植物组织中麦角酰胺的含量Table 1 Ergine levels in different tissues of four endophyte-infected E.dahuricus population in different months mg/kg
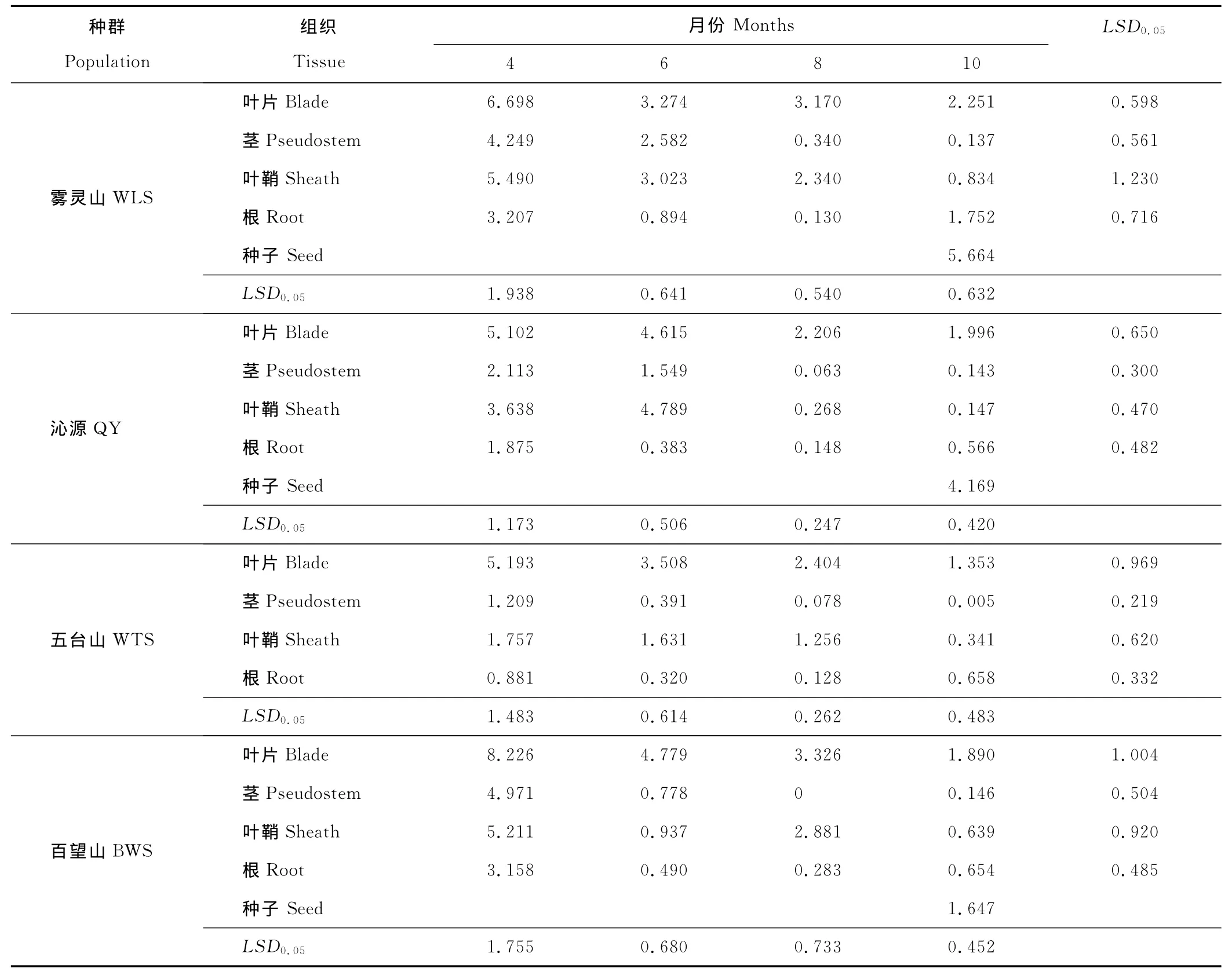
表2 4个披碱草E+种群4-10月各植物组织中麦角新碱的含量Table 2 Ergonovine levels in different tissues of four endophyte-infected E.dahuricus population in different months mg/kg

图1 4-10月4个披碱草E+种群麦角酰胺含量Fig.1 Ergine levels in four populations in different months
2.3 供试植物披碱草E+种群整株中麦角酰胺和麦角新碱的含量
4-10月雾灵山、沁源、五台山和百望山4个披碱草E+种群整株中麦角酰胺含量均不同(图1)。4月百望山种群中总麦角酰胺含量显著高于其他3个种群(P<0.05),为19.322mg/kg;6月雾灵山种群中麦角酰胺总含量显著高于其他3个种群(P<0.05),为7.071mg/kg;8月五台山种群中麦角酰胺总含量显著高于雾灵山和沁源种群(P<0.05),为5.587mg/kg;10月雾灵山种群麦角酰胺总含量显著高于其他3个种群(P<0.05),为4.306mg/kg(图1)。
4-10月4个披碱草带菌种群整株中麦角新碱含量均不同(图2)。4月百望山种群中麦角新碱总含量显著高于沁源和五台山种群(P<0.05),为5.392 mg/kg;6月沁源种群麦角新碱总含量显著高于其他3个种群(P<0.05),为2.834mg/kg;8月百望山种群中麦角新碱总含量显著高于沁源和五台山种群(P<0.05),为1.622mg/kg;10月雾灵山种群中总麦角新碱含量显著高于其他3个种群(P<0.05),为1.243 mg/kg(图2)。

图2 4-10月4个披碱草E+种群麦角新碱含量Fig.2 Ergonovine levels in four population in different months
2.4 披碱草E+种群中麦角酰胺含量和麦角新碱含量的关系
在每个生长时期,雾灵山、沁源、五台山和百望山各E+种群内,麦角生物碱的总含量中麦角酰胺显著高于麦角新碱(P<0.05)。麦角酰胺和麦角新碱呈极显著线性正相关(P<0.01),相关系数r=0.827,二者的关系可用方程Y=0.292 4X+0.280 6表示(图3)。
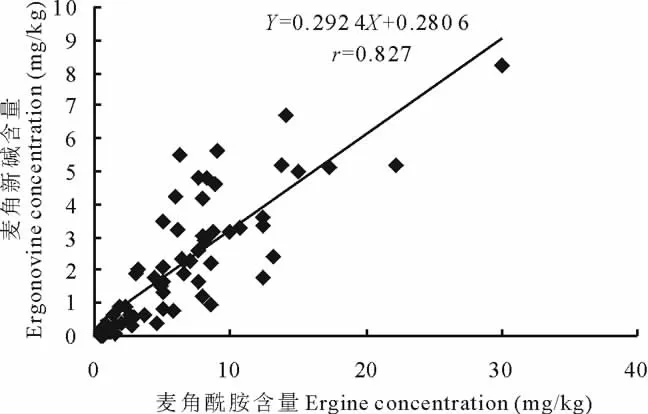
图3 麦角酰胺和麦角新碱的相关性Fig.3 Correlations between ergine and ergonovine
3 讨论
披碱草中生物碱的产生与内生真菌的感染有关。本试验对2004年栽培于兰州的雾灵山(WLS)、沁源(QY)、五台山(WTS)和百望山(BWS)4个披碱草种群中麦角生物碱检测结果表明,带内生真菌的植株均能检测到不同含量的麦角生物碱,而不带内生真菌的植株均未检测到任何一种麦角生物碱,这一结果与以往研究结果相同[4-18]。本试验从带菌披碱草中检测出麦角生物碱,但至今没有家畜在采食披碱草后中毒的报道,主要原因是带菌披碱草中麦角生物碱含量较少,在百望山种群成长初期,即4月时,叶片中的麦角酰胺含量最高,为30.037mg/kg干重,麦角新碱含量也最高,为8.226mg/kg干重,这比李春杰[14]报道的醉马草中麦角酰胺含量290.26mg/kg干重和麦角新碱含量(103.75 mg/kg干重)低;而且Vinton等[18]检测到带菌加拿大披碱草中麦角生物碱含量也低于被内生真菌侵染的高羊茅中麦角生物碱的含量。
本试验结果发现种群内各组织的麦角生物碱含量不同,在营养生长阶段(4,6和8月),雾灵山、沁源、五台山和百望山4个E+披碱草种群的麦角生物碱主要分布在叶片和叶鞘中,生殖生长阶段(10月),麦角生物碱主要集中在种子和叶片中。这一结果与李春杰[14]和代乐英等[15]的研究结果相似,其结果表明,带菌醉马草叶片和果穗的生物碱含量均显著高于茎秆。Ball等[10]、Spiering等[6]及Reinholz和Paul[11]对黑麦草的研究也是生物碱含量因部位不同而变化。此外,披碱草内生真菌共生体各器官中麦角酰胺的含量均显著高于麦角新碱,这一结果也与李春杰[14]和代乐英等[15]的研究结果一致。
本试验检测了4个种群的披碱草麦角生物碱的含量,结果表明,每个生长季麦角酰胺和麦角新碱含量都在种群间有差异,这与代乐英等[15]对不同带菌醉马草种群麦角生物碱检测结果相似,说明植物基因型是影响生物碱合成的重要因子。Faeth等[24]的研究表明,植物基因型而非内生真菌单体决定产生生物碱的种类,内生真菌单体在不同的寄主植物中产生的生物碱含量不同。Hill等[8]的研究表明,内生真菌和植物基因型共同影响生物碱的含量,生物碱含量受不同寄主和内生真菌形成共生体的影响很大。Leuchtmann等[25]的研究表明,生物碱含量与植物和内生真菌的生活史策略有关,垂直传播的真菌较水平传播的真菌产生更高含量的生物碱。
本试验结果还表明4个E+披碱草种群的叶片、茎秆和叶鞘中麦角生物碱在生长初期(4或6月)含量最高,后期(8或10月)含量显著减小;根中麦角生物碱在前3个生长季含量逐渐降低,8月最低,10月含量有所回升。这与以往研究结果有所出入:李春杰[14]研究结果表明,麦角生物碱的含量随着生育期的延长呈先增长后下降的趋势;Ball等[26]发现Lolitrem B和Peramine的含量都在冬季降到最低;Justus等[12]发现草地羊茅中生物碱Loline从早春到种子成熟时期呈增长趋势,含量在种子散播和秆老化是降到几乎为0,随后的营养生长阶段含量又增高。主要原因可能是因为麦角生物碱将随着营养物质的运输在植物体内分布,营养生长阶段营养物质主要作用于叶片和叶鞘中,于是麦角生物碱也主要集中于这两部分,生殖生长阶段营养物质则作用于生殖枝,因而植物营养枝中的麦角生物碱含量下降。
本试验最主要的发现是被内生真菌侵染的披碱草根中存在麦角生物碱。在以往研究中,对禾草内生真菌共生体的根研究较少[7,9],Malinowski等[7]在被Neotyphodiumcoenophialum侵染的高羊茅根中同样测得了麦角生物碱,其含量还随土壤中磷含量增高而增高。Justus等[12]在被内生真菌侵染的草地羊茅的根中发现了黑麦草碱。李春杰[14]并没有在带菌醉马草1月龄的幼苗根部检测出麦角生物碱。主要原因可能是麦角生物碱随着营养物质传输到根部。
根据以上试验结果将提出假设,麦角生物碱将随着营养物质的运输在植物体内分布:披碱草刚返青时,营养物质主要用于叶片的生长,因此,麦角生物碱主要分布在叶片和叶鞘中;随着植物的生长,植株体生长迅速,但体内麦角生物碱的代谢较为缓慢,因此形成稀释作用,含量降低;直到披碱草开始结穗,营养物质主要作用于生殖枝,因此营养枝部分含量降低,种子中麦角生物碱含量增高;到种子散播结束,植物枯萎,麦角生物碱随着营养物质的运输转移到根部,因而根部10月的麦角生物碱含量增高。Rasmussen等[5]提出了假设,麦角生物碱是由营养物质葡萄糖、果糖和蔗糖代谢产生的。因此,今后可以通过生物化学和分子生物学的手段对麦角生物碱的代谢和运输,以及内生真菌对寄主植物的诱导展开研究。
[1]陈默君,贾慎修.中国饲用植物[M].北京:中国农业出版社,2000.
[2]张玉平.披碱草-内生真菌共生体生物学与生理学特性的研究[D].兰州:兰州大学,2007.
[3]南志标,李春杰.禾草-内生真菌共生体在草地农业系统中的作用[J].生态学报,2004,24(3):605-616.
[4]高嘉卉,南志标.禾草内生真菌生物碱的研究进展[J].生态学报,2007,27(6):2531-2546.
[5]Rasmussen S,Parsons A J,Newman J A.Metabolomics analysis of theLoliumperenne-Neotyphodiumloliisymbiosis:more than just alkaloids[J].Phytochem Reviews,2009,8:535-550.
[6]Spiering M J,Lane G A,Christensen M J,etal.Distribution of the fungal endophyteNeotyphodiumloliiis not a major determinant of the distribution of fungal alkaloids inLoliumperenneplants[J].Phytochemistry,2005,66:195-202.
[7]Malinowski D P,Belesky D P,Hill N S,etal.Influence of phosphorus on the growth and ergot alkaloid content ofNeotyphodiumcoenophialum-infected tall fescue(FestucaarundinaceaSchreb)[J].Plant and Soil,1998,198:53-61.
[8]Hill N S,Bouton J H,Adcock R A,etal.Symbiont regulation and reducing ergot alkaloid concentrattion by breeding endophyte-inffected tall fescue[J].Ournal of Chemical Ecology,1997,23(3):691-701.
[9]Malinowski D P,Brauer D K,Belesky D P.The endophyteNeotyphodiumcoenophialumaffects root Morphology of tall fescue grown under phosphorus deficiency[J].Agronomy & Crop Science,1999,183:53-60.
[10]Ball O J P,Barker G M,Prestidge R A,etal.Distribution and accumulation of the alkaloid peramine inNeotyphodiumloliiinfectedperennial ryegrass[J].Chemical Ecology,1997,23:1419-1434.
[11]Reinholz J,Paul V H.Effect of temperature on the lolitrem B content inLoliumperenneinfected byNeotyphodium lolii[A].The 3rd International Conference on Harmful and Beneficial Microorganisms in Grassland,Pastures and Turf[C].American:Mycological Society of American,2000:57-63.
[12]Justus M,Witte L,Hartmann T.Levels and tissue distribution of loline alkaloid in endophyte-infectedFestucapratensis[J].Phytochemistry,1997,44(1):51-57.
[13]Faeth S H,Gardner D R,Hayes C J,etal.Temporal and spatial variation in alkaloid levers inAchnatheruminebrians,a native grass infected with the endophyteNeotyphodium[J].Journal of Chemical Ecology,2006,32(6):307-324.
[14]李春杰.醉马草-内生真菌共生体生物学与生态学特性的研究[D].兰州:兰州大学,2005.
[15]代乐英,黄玺,李春杰.麦角生物碱在醉马草内生真菌共生体中的空间分布[J].草业学报,2010,19(6):215-221.
[16]高嘉卉.Neotyphodiumgansuense离体麦角碱的检测和N.lolii麦角碱基因的测序[D].兰州:兰州大学,2006.
[17]Saha M C,Young C A,Hopkins A A.Genetic variation within and among wildrye(ElymuscanadensisandE.virginicus)population from the southern Great Plains[J].Crop Science,2009,49:913-922.
[18]Vinton M A,Kathol E S,Vogel K P,etal.Endophyticfungiin Canada wild rye in natural grasslands[J].Journal of Range Management,2001,54:390-395.
[19]Nan Z B,Li C J.Neotyphodium in native grasses in China and observations on endophyte/host interactions[A].In:Paul V H,Dapprich P D.Proceedings of the 4th InternationalNeotyphodium/Grass Interactions Symposium.Soest:Germany,2000:41-49.
[20]Zhang Y P,Nan Z B.Germination and seedling anti-oxidative enzymes of endophyte-infected populations ofElymusdahuricusunder osmotic stress[J].Seed Science and Technology,2010,38:522-527.
[21]Zhang Y P,Nan Z B.Growth and anti-oxidative systems changes inElymusdahuriusis affected byNeotyphodiumendophyte under contrasting water availability[J].Journal of Agronomy & Crop Science,2007,193:377-386.
[22]Zhang Y P,Nan Z B.Distribution of epichloe endophytes in Chinese populations ofElymusdahuricusand variation in peramine levels[J].Symbiosis,2007,43(1):13-19.
[23]杨松,李春杰,柴青,等.披碱草内生真菌对三种草坪草种子与种苗的化感效应[J].草业学报,2010,19(4):33-40.
[24]Faeth S H,Bush L P,Sullivan T J.Peramine alkaloid variation inNeotyphodium-infected arizona fescue:Effects of endophyte and host genotype and environment[J].Journal of Chemical Ecology,2002,28(8):1511-1527.
[25]Leuchtmann A,Schmidt D,Bush L P.Different levels of protective alkaloids in grasses with stroma-forming and seed-transmittedEpichlo Neotyphodiumendophytes[J].Journal of Chemical Ecology,2000,26(4):1025-1036.
[26]Ball O J P,Prestidge R A,Sprosen J M.Interrelationships betweenAcremoniumlolii,Peramine,and Lolitrem B in perennial ryegrass[J].Applied and Environmental Microbiology,1995,61(4):1527-1533.
