中华补血草多酚提取物对自由基的清除能力
2011-12-31陈炳华郭巧茹陈莺莺
陈炳华,李 均,郭巧茹,陈莺莺
(福建师范大学生命科学学院,福建福州350108)
中华补血草〔Limonium sinense(Girard)Kuntze〕是白花丹科(Plumbaginaceae)多年生泌盐草本植物,喜生于盐渍化的低洼湿地上[1],广泛分布于福建惠安、晋江、诏安、厦门以及台湾金门等地的沿海滩涂,野生资源蕴藏量大。中华补血草根或全草入药,根具有健脾补血、活血止血和调经之功效,用于治疗感冒、失血和血热月经过多等症[1-2]。
中华补血草所含的化学成分十分丰富,含水溶性多糖、鞣质及黄酮类等多种活性成分。郭洪祝等[3]从其地上部分分得4种黄酮醇类成分:杨梅素-3-O-β-D-葡萄糖苷、杨梅素-3-O-α-L-鼠李糖苷、槲皮素-3-O-α-L-鼠李糖苷和槲皮素;Lin等[2,4]从中华补血草的地上部分和根部获得20余种酚性成分,主要有3-黄烷酮、(-)表没食子酸儿茶素和3-O-没食子酸酯等。
Chaung等[5]考察了中华补血草根的水提物及叶醇提物的三氯甲烷部分抗大鼠肝损伤的作用,发现中华补血草具有保肝、降酶作用。Tang等[6]、汤新慧等[7]、Tang等[8]分别研究了中华补血草根提取物(LSE)对小鼠急性肝损伤的防护作用并探讨其药理机制,均发现LSE可显著对抗人工诱导的小鼠急性肝损伤,其机制可能与其保护肝细胞线粒体、抑制细胞凋亡有关;Lin等[4]的研究结果显示:从中华补血草根乙醇提取物中分离得到的10种黄酮类化合物均能抑制HSV-1病毒在Vero(绿猴肾细胞)中的复制,其中samarangenin B和(-)-epigallocatechin 3-O-gallate的抑制能力最强,比阳性对照无环鸟昔(acydovir)具有更高的抑制活性;李均等[9]的研究结果也证实中华补血草根提取物具有较强的抗氧化活性。可见,中华补血草的药理活性主要有抗病毒、抗肿瘤、抗氧化及对小鼠肝细胞损伤的保护作用等,有关中华补血草不同形态学部位(根、根茎、叶和花)自由基清除能力的比较研究目前尚未见报道。
作者采用超声波辅助浸提-大孔树脂吸附法分别从中华补血草的根、根茎、叶及花中提取酚性组分,并测定其对DPPH·、·OH和O-·2的清除效果,旨在了解中华补血草全草的抗氧化活性,为该种的进一步开发利用提供依据。
1 材料和方法
1.1 材料
供试中华补血草全草采自福建惠安崇武镇的沙滩湿地,经福建师范大学生命科学学院刘剑秋教授鉴定。植株洗净后分成根、根茎、叶及花(含花和花茎等部分)4个部位,分别经50℃烘干、粉碎后过60目筛,于4℃保存、备用。
1.2 试剂和仪器
所用试剂:二苯基苦味酰基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH·)、罗丹明B(rhodamine B)和Folin-酚均购自美国 Sigma公司;吩嗪硫酸甲酯(phenazin methosulfate,PMS)为美国Fluka公司产品;还原性辅酶Ⅱ钠盐(reducedβ-nicotinamide adenine dinucleotide,NADH)购自美国 Roche Diagnostics公司;硝基四氮唑蓝(nitroblue tetrazolium,NBT)购自美国Amresco公司;芦丁购自中国药品生物制品检定所(批号:100080-200306,纯度91.7%);2,6-二叔丁基-4-甲基苯酚(BHT)和单宁酸等均购自国药集团化学试剂有限公司。
所用仪器:SynergyHT多功能酶标仪(美国Bio-Tek公司)、F-4600型荧光分光光度计(日本日立公司)和Ultra-spec2100 pro紫外可见光光度计(美国Amersham Biosciences公司)等。
1.3 方法
1.3.1 多酚提取物的制备 取上述根、根茎、叶(预先用石油醚脱脂)和花的粉末样品适量,以体积分数45%乙醇为提取剂,采用超声波辅助浸提-大孔树脂吸附法分别制备多酚提取物,具体操作参照文献[10]。提取物贮藏于-20℃冰箱中备用。
1.3.2 提取物中各组分的含量测定 总酚含量采用Folin-Ciocalteu试剂比色法[10]进行测定,以单宁酸为标准品,根据单宁酸回归方程y=3.969 3x+0.018 0 (y为吸光度,x为单宁酸质量浓度,R2=0.999 1)计算样品中多酚质量分数。原花色素含量采用硫酸-香草醛比色法[11]进行测定,以儿茶素为标准品,根据儿茶素回归方程y=9.484 0x+0.009 5(y为吸光度,x为儿茶素质量浓度,R2=0.998 9)计算样品中原花色素质量分数。黄烷醇含量采用DMACA法[12]进行测定,以儿茶素为标准品,根据儿茶素回归方程y= 64.037 0x+0.023 3(y为吸光度,x为儿茶素质量浓度,R2=0.999 8)计算样品中黄烷醇质量分数。总黄酮含量采用AlCl3显色法[13]进行测定,以芦丁为标准品,根据芦丁回归方程y=3.112 9x-0.012 8(y为吸光度,x为芦丁质量浓度,R2=0.999 8)计算样品中总黄酮质量分数。每个样品均设4次重复。
1.3.3 对自由基清除能力的测定
1.3.3.1 对DPPH·清除能力的测定 DPPH·动力学曲线的测定采用酶标仪法,参照Fukumoto等[14]的方法并略加改进。以体积分数80%甲醇为溶剂,将不同部位多酚提取物配制成质量浓度0.012 5~0.2 g·L-1的供试样液。在96孔酶标板中加25μL供试样液和150μmol·L-1DPPH·溶液(用体积分数80%甲醇配制)200μL,对照则加入200μLDPPH·溶液和25μL体积分数80%甲醇,空白则加入200μL体积分数80%甲醇和25μL供试样液,置于酶标仪中振动30 s,37℃保温60 min,期间每隔2.5 min于520 nm波长下读取吸光度。以质量浓度0.012 5~0.2 g·L-1的BHT和芦丁作阳性对照。每个样品设4次重复。根据公式计算DPPH·清除率:DPPH·清除率=〔1-(As-Ab)/Ac〕×100%。式中:Ac为空白的吸光度;Ab为对照的吸光度;As为样液的吸光度。
1.3.3.2 对·OH清除能力的测定 参照 Liang等[15]的方法进行测定。用高纯水将上述不同部位多酚提取物配制成质量浓度0.02~0.2 g·L-1的供试样液,依次取供试样液0.1 mL、0.02 mol·L-1HCl-NaAc缓冲液(pH 4.95)1 mL、5.02 mmol·L-1FeSO40.1 mL、20 mmol·L-1KI 0.2 mL、0.1 mmol·L-1罗丹明B 0.6 mL、高纯水2.85 mL和43.2 mmol·L-1H2O250μL,快速摇匀,室温静置5 min后,在激发波长358 nm下同步扫描其荧光发射光谱,记录波长575 nm处的荧光强度Fs;空白管以0.1 mL高纯水代替供试样液,测得荧光强度F0;对照管分别以0.1 mL和50μL高纯水代替供试样液和H2O2,测得荧光强度F。以质量浓度0.02~0.2 g·L-1的芦丁作阳性对照。每个样品均设4次重复。根据下述公式计算·OH清除率:·OH清除率=〔(Fs-F0)/(F-F0)〕× 100%。
1.3.3.3 对O-·2清除能力的测定 参考Wang等[16]的方法并略加改进。用Tris-HCl缓冲液(pH 8.0)将不同部位多酚提取物配制成质量浓度0.025~0.2 g·L-1的供试样液。反应体系总体积为300μL,包括16 mmol·L-1Tris-HCl缓冲液(pH 8.0)100μL、468 μmol·L-1NADH 50μL、300μmol·L-1NBT 50μL、60μmol·L-1PMS 50μL以及50μL供试样液,其中PMS最后加入体系以引发反应;25℃温浴反应5 min后,用酶标仪于560 nm处测定反应液的吸光度As;空白管用等体积Tris-HCl缓冲液(pH 8.0)代替PMS,测得吸光度Ab;对照管用等体积Tris-HCl缓冲液(pH 8.0)代替样液,测得吸光度Ac。以质量浓度0.025~0.2 g·L-1的芦丁作阳性对照。每个样品均设4次重复。根据下述公式计算O-·2清除率:O-·2清除率=〔1-(As-Ab)/Ac〕×100%。
半数清除质量浓度(ρSC50)的定义为:体系中50%自由基(DPPH·、·OH和O-·2)被清除时阳性对照或样品的质量浓度。
1.4 数据分析
采用SPSS 16.0统计分析软件进行数据处理和差异显著性分析。
2 结果和分析
2.1 多酚提取物的得率及其组成分析
中华补血草根、根茎、叶和花4个部位的多酚提取物均为粉末状,外观呈棕红色,易溶于水和醇水溶液,各部位多酚提取物的得率及其组成见表1。
由表1可知:中华补血草各部位多酚提取物得率为3.98%~12.42%,其中根多酚提取物的得率(12.42%)最高,显著高于其他部位(P<0.05);根茎和叶多酚提取物的得率不及根多酚提取物得率的50%,且二者差异不显著(P>0.05);而花多酚提取物的得率最低,仅为3.98%。
中华补血草各部位多酚提取物中总酚含量均在质量分数51%以上,其中根中的总酚含量最高,达61.60%,显著高于其他部位;根茎中的总酚含量也较高;叶和花中的总酚含量相近,二者差异不显著,但较前2个部位低。各部位多酚提取物中原花色素含量为质量分数5.62%~39.47%,不同部位间差异显著,分别占相应部位总酚含量的64.07%、36.71%、31.31%和10.65%。4个部位多酚提取物中黄烷醇含量的差异也达显著水平,但其含量均处于较低水平,其中根中黄烷醇含量(12.46%)最高,但仅占总酚含量的20.23%。4个部位多酚提取物中总黄酮含量的差异达显著水平;其中花中总黄酮含量最高,质量分数达35.97%,占总酚含量的68.15%;其余3个部位中总黄酮含量均很低,尤其是根中总黄酮含量仅占总酚含量的4.11%。由此可见,中华补血草根多酚提取物主要组成成分是原花色素类,花多酚提取物中主要组成成分为黄酮类。
表1 中华补血草不同部位多酚提取物的得率及其组成分析(±SD)1)Table 1 Analyses of yield and constituents in polyphenol extracts from different parts of Limonium sinense(Girard)Kuntze(±SD)1)
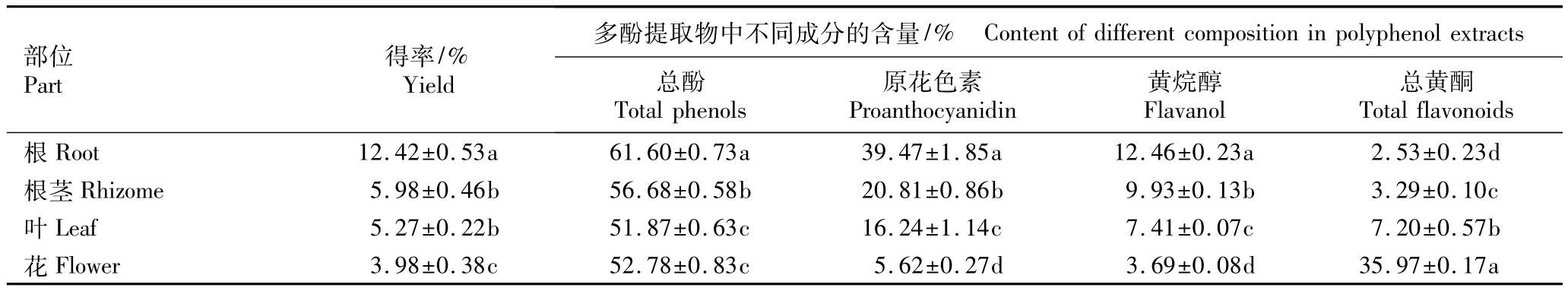
表1 中华补血草不同部位多酚提取物的得率及其组成分析(±SD)1)Table 1 Analyses of yield and constituents in polyphenol extracts from different parts of Limonium sinense(Girard)Kuntze(±SD)1)
1)同列中不同的小写字母表示经邓肯氏新复极差检验差异显著(P<0.05)Differentsmall letters in the same column indicate the significantdifferenceby Duncan’s new multiple range test(P<0.05).
部位Part 得率/% Yield多酚提取物中不同成分的含量/% Content of different composition in polyphenol extracts总酚Total phenols 原花色素Proanthocyanidin 黄烷醇Flavanol 总黄酮Total flavonoids根Root 12.42±0.53a 61.60±0.73a 39.47±1.85a 12.46±0.23a 2.53±0.23d根茎Rhizome 5.98±0.46b 56.68±0.58b 20.81±0.86b 9.93±0.13b 3.29±0.10c叶Leaf 5.27±0.22b 51.87±0.63c 16.24±1.14c 7.41±0.07c 7.20±0.57b花Flower 3.98±0.38c 52.78±0.83c 5.62±0.27d 3.69±0.08d 35.97±0.17a
2.2 对DPPH·清除能力的比较
2.2.1 对DPPH·的反应动力学分析 DPPH·是一种稳定的有机自由基,广泛用于评估天然活性物质对自由基的清除能力。实际操作中,依据自由基清除剂的不同类型(快速、中速和慢速)[17],可采用固定反应时间法和动力学监测法进行测定,后者得到的结果能够真实地反映样品对DPPH·的清除能力[18]。为此,在研究过程中首先考察了中华补血草不同部位多酚提取物对DPPH·的反应动力学,以获得其达到平衡时所需的时间。不同部位多酚提取物(0.1 g·L-1)与DPPH·的反应动力学曲线见图1。由图1可见:各部位多酚提取物与DPPH·的反应动力学曲线相近,均表现为起始时体系中吸光度迅速降低,20~30 min吸光度降幅趋缓,30 min后吸光度趋于稳定,说明反应初期多酚提取物能迅速与 DPPH·结合生成 DPPHPheO,大量的DPPH·被消耗,表现出吸光度的迅速下降。这一结果与葡萄(Vitis vinifera L.)籽原花青素清除DPPH·的反应动力学相似[17]。而在60min的反应时间内,空白管的吸光度则基本稳定。因此,据此推断,中华补血草不同部位总酚提取物与DPPH·反应的时间应设定为30 min。
2.2.2 对DPPH·的清除能力 中华补血草不同部位多酚提取物对DPPH·的清除率见表2。由表2可知:随着质量浓度的提高,中华补血草不同部位多酚提取物对DPPH·的清除率均逐渐增大。当质量浓度为0.1 g·L-1时,根、根茎和叶的多酚提取物对DPPH·的清除率均在92%以上;质量浓度0.025、0.05和0.1 g·L-1的根、根茎和叶多酚提取物对DPPH·的清除率差异不显著(P>0.05),但均显著高于花多酚提取物(P<0.05),表明中华补血草根、根茎和叶多酚提取物对DPPH·具有较强的清除作用。
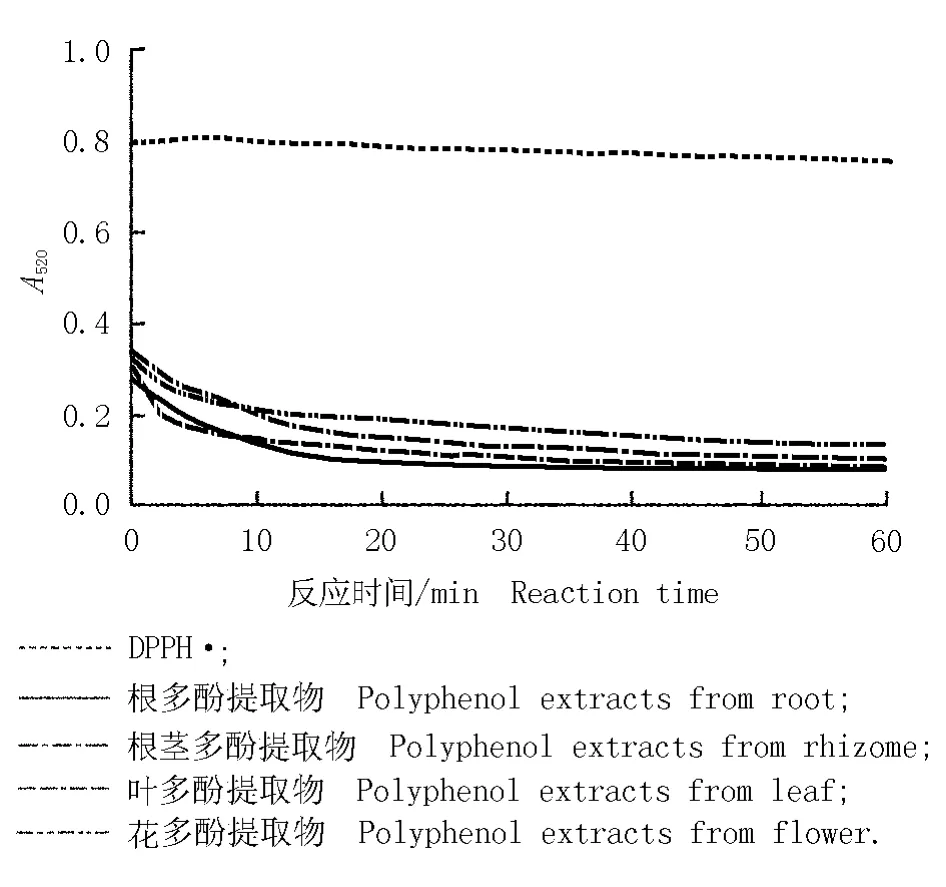
图1 中华补血草不同部位多酚提取物(0.1 g·L-1)与DPPH·的反应动力学曲线Fig.1 Reaction kinetic curves of polyphenol extracts(0.1 g·L-1) from different parts of Limonium sinense(Girard)Kuntze w ith DPPH·
表2 中华补血草不同部位多酚提取物对DPPH·的清除率(±SD)1)Table 2 Scavenging rate of polyphenol extracts from different parts of Limonium sinense(Girard)Kuntze to DPPH·(±SD)1)
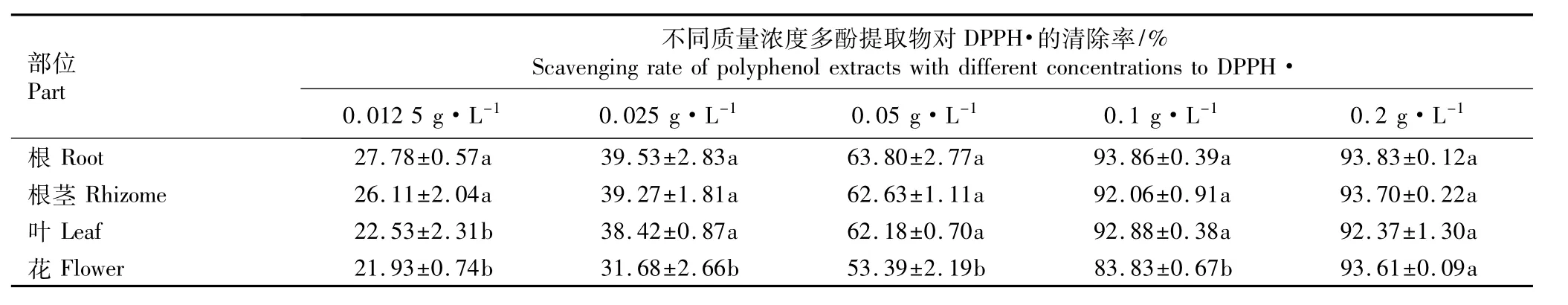
表2 中华补血草不同部位多酚提取物对DPPH·的清除率(±SD)1)Table 2 Scavenging rate of polyphenol extracts from different parts of Limonium sinense(Girard)Kuntze to DPPH·(±SD)1)
部位Part不同质量浓度多酚提取物对DPPH·的清除率/% Scavenging rate of polyphenol extracts with different concentrations to DPPH· 0.012 5 g·L-1 0.025 g·L-1 0.05 g·L-1 0.1 g·L-1 0.2 g·L-1根Root 27.78±0.57a 39.53±2.83a 63.80±2.77a 93.86±0.39a 93.83±0.12a根茎Rhizome 26.11±2.04a 39.27±1.81a 62.63±1.11a 92.06±0.91a 93.70±0.22a叶Leaf 22.53±2.31b 38.42±0.87a 62.18±0.70a 92.88±0.38a 92.37±1.30a花Flower 21.93±0.74b 31.68±2.66b 53.39±2.19b 83.83±0.67b 93.61±0.09a
1)同列中不同的小写字母表示经邓肯氏新复极差检验差异显著(P<0.05)Differentsmall letters in the same column indicate the significantdifference by Duncan’s new multiple range test(P<0.05).
2.3 对·OH清除能力的比较
羟自由基·OH是氧化能力最强、同时也是对机体造成损伤最大的一类自由基。中华补血草不同部位多酚提取物对·OH的清除率见表3。表3结果表明:随质量浓度的提高,各部位多酚提取物对·OH的清除率表现出先快速增大而后增幅减缓的趋势。当质量浓度为0.02和0.04 g·L-1时,花多酚提取物对·OH的清除率均显著高于其他部位(P<0.05);当质量浓度为0.08、0.1和0.2 g·L-1时,根、叶和花的多酚提取物对·OH的清除率显著高于根茎的多酚提取物,但三者间差异不显著。总体上看,花的多酚提取物对·OH的清除率最大,而根茎的多酚提取物对·OH的清除率最小。
2.4 对清除能力的比较
表3 中华补血草不同部位多酚提取物对·OH的清除率(±SD)1)Table 3 Scavenging rate of polyphenol extracts from different parts of Limonium sinense(Girard)Kuntze to·OH(±SD)1)
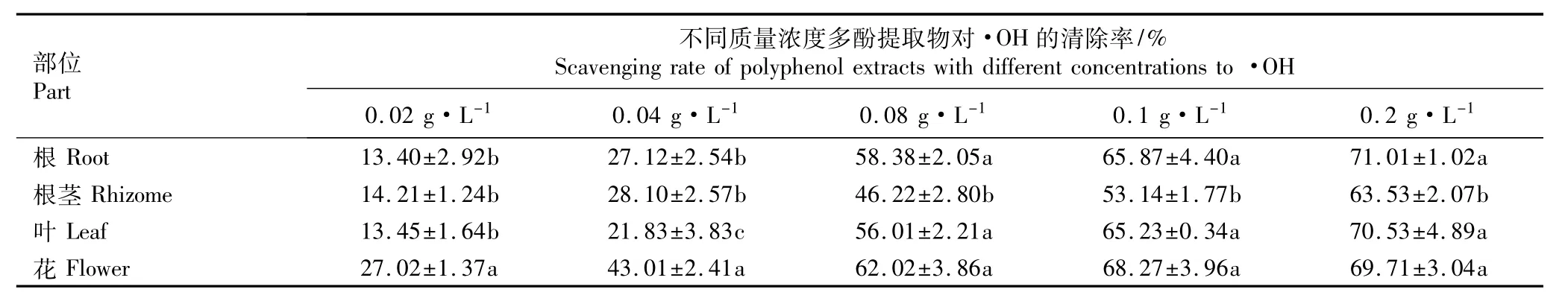
表3 中华补血草不同部位多酚提取物对·OH的清除率(±SD)1)Table 3 Scavenging rate of polyphenol extracts from different parts of Limonium sinense(Girard)Kuntze to·OH(±SD)1)
1)同列中不同的小写字母表示经邓肯氏新复极差检验差异显著(P<0.05)Differentsmall letters in the same column indicate the significantdifference by Duncan’s new multiple range test(P<0.05).
部位Part不同质量浓度多酚提取物对·OH的清除率/% Scavenging rate of polyphenol extractswith different concentrations to·OH 0.02 g·L-1 0.04 g·L-1 0.08 g·L-1 0.1 g·L-1 0.2 g·L-1根Root 13.40±2.92b 27.12±2.54b 58.38±2.05a 65.87±4.40a 71.01±1.02a根茎Rhizome 14.21±1.24b 28.10±2.57b 46.22±2.80b 53.14±1.77b 63.53±2.07b叶Leaf 13.45±1.64b 21.83±3.83c 56.01±2.21a 65.23±0.34a 70.53±4.89a花Flower 27.02±1.37a 43.01±2.41a 62.02±3.86a 68.27±3.96a 69.71±3.04a
表4 中华补血草不同部位多酚提取物对O-· 2的清除率(±SD)1)Table 4 Scavenging rate of polyphenol extracts from different parts of Limonium sinense(Girard)Kuntze to O-· 2(±SD)1)
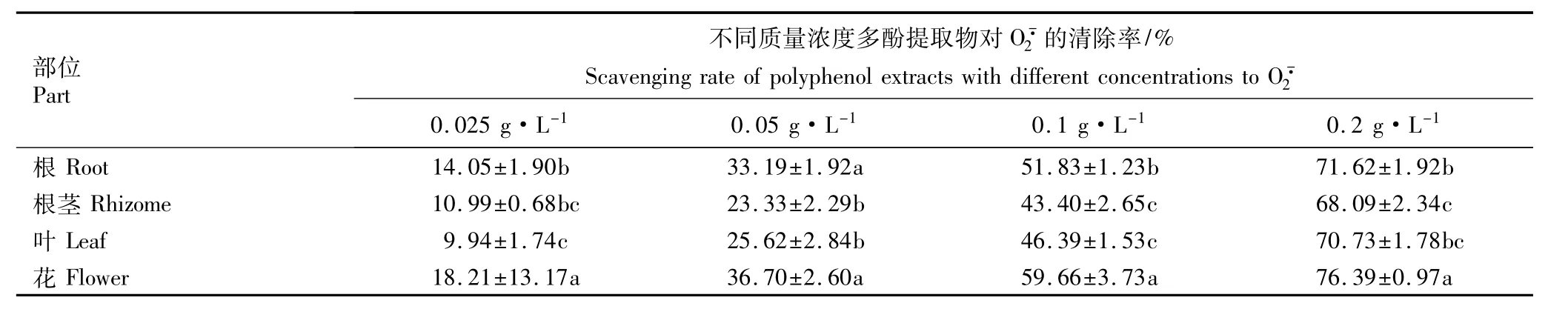
表4 中华补血草不同部位多酚提取物对O-· 2的清除率(±SD)1)Table 4 Scavenging rate of polyphenol extracts from different parts of Limonium sinense(Girard)Kuntze to O-· 2(±SD)1)
1)同列中不同的小写字母表示经邓肯氏新复极差检验差异显著(P<0.05)Differentsmall letters in the same column indicate the significantdifferenceby Duncan’s new multiple range test(P<0.05).
部位Part不同质量浓度多酚提取物对O-· 2的清除率/% Scavenging rate of polyphenol extracts with different concentrations to O-· 2 0.025 g·L-1 0.05 g·L-1 0.1 g·L-1 0.2 g·L-1根Root 14.05±1.90b 33.19±1.92a 51.83±1.23b 71.62±1.92b根茎Rhizome 10.99±0.68bc 23.33±2.29b 43.40±2.65c 68.09±2.34c叶Leaf 9.94±1.74c 25.62±2.84b 46.39±1.53c 70.73±1.78bc花Flower 18.21±13.17a 36.70±2.60a 59.66±3.73a 76.39±0.97a
2.5 不同部位多酚提取物清除自由基的ρSC50比较
为更好地说明中华补血草不同部位多酚提取物对自由基清除能力的强弱,采用半数清除质量浓度(ρSC50)这一指标进行比较分析,ρSC50越低,表明其清除自由基的能力越强[13-14]。中华补血草不同部位多酚提取物清除自由基的ρSC50见表5。
表5 中华补血草不同部位多酚提取物和阳性对照对自由基的半数清除质量浓度(ρSC 50)(±SD)1)Table5 Half scavenging concentration(ρSC50)of polyphenol extracts from different parts of Limonium sinense(Girard)Kuntze and positive controls to radicals(±SD)1)
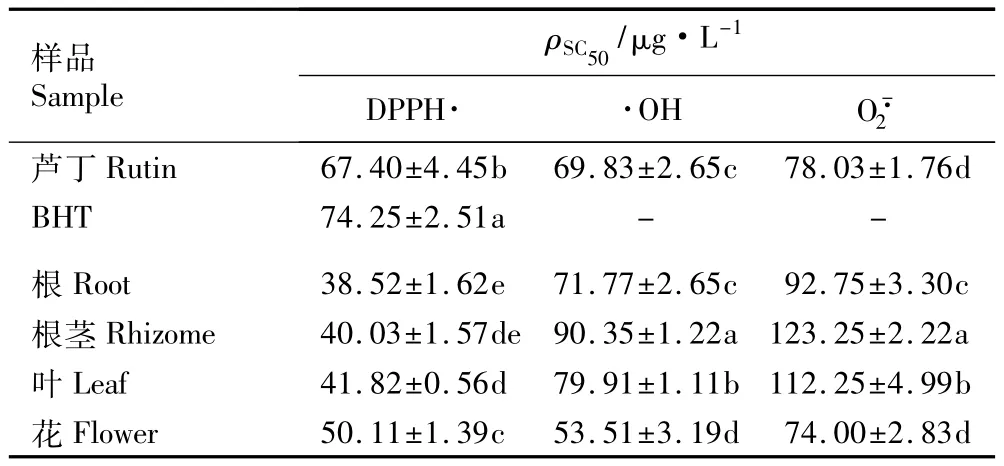
表5 中华补血草不同部位多酚提取物和阳性对照对自由基的半数清除质量浓度(ρSC 50)(±SD)1)Table5 Half scavenging concentration(ρSC50)of polyphenol extracts from different parts of Limonium sinense(Girard)Kuntze and positive controls to radicals(±SD)1)
1)同列中不同的小写字母表示经邓肯氏新复极差检验差异显著(P<0.05)Different small letters in the same column indicate the significant difference by Duncan’snewmultiple range test(P<0.05).
样品Sample ρSC50/μg·L-1 DPPH· ·OH O-· 2芦丁Rutin 67.40±4.45b 69.83±2.65c 78.03±1.76d BHT 74.25±2.51a - -根Root 38.52±1.62e 71.77±2.65c 92.75±3.30c根茎Rhizome 40.03±1.57de 90.35±1.22a 123.25±2.22a叶Leaf 41.82±0.56d 79.91±1.11b 112.25±4.99b花Flower 50.11±1.39c 53.51±3.19d 74.00±2.83d
表5的数据表明:在中华补血草不同部位的多酚提取物中,以根多酚提取物清除DPPH·的ρSC50值最低,为38.52μg·L-1,说明根多酚提取物对DPPH·的清除能力最强,其次为根茎和叶,而花多酚提取物的ρSC50值显著高于其他部位(P<0.05),说明花多酚提取物对DPPH·的清除能力略差。依据ρSC50值,4个部位多酚提取物对DPPH·的清除能力由强至弱依次为根、根茎、叶、花。与阳性对照芦丁和BHT相比,中华补血草不同部位多酚提取物清除DPPH·的ρSC50值均显著小于芦丁和BHT。
对一定质量浓度范围内中华补血草不同部位多酚提取物对·OH的清除率曲线进行非线性拟合,从拟合方程中求得ρSC50(表5)。由表5可知:中华补血草根、根茎、叶和花多酚提取物清除·OH的ρSC50值分别为71.77、90.35、79.91和53.51μg·L-1,差异达到显著水平。4个部位多酚提取物对·OH的清除能力由强至弱依次为花、根、叶、根茎。与阳性对照芦丁清除·OH的ρSC50(69.83μg·L-1)相比,中华补血草花多酚提取物对·OH的清除能力显著强于芦丁,根多酚提取物对·OH的清除能力则与芦丁相当,而其他部位多酚提取物对·OH的清除能力则比芦丁弱。
3 讨论和结论
中华补血草根、根茎、叶和花多酚提取物对不同的自由基表现出不同的清除能力。不同部位多酚提取物对有机自由基DPPH·均表现出很强的清除能力,其中根、根茎和叶多酚提取物的清除效果较为接近,依据半数清除质量浓度(ρSC50)高低,4个部位多酚提取物对DPPH·的清除能力由强至弱依次排序为根、根茎、叶、花,且均显著强于芦丁和BHT的清除能力(P<0.05)。中华补血草不同部位多酚提取物对2种活性氧自由基(·OH和)的清除率均随着质量浓度的提高而增大。由ρSC50可见:中华补血草4个部位多酚提取物对·OH和的清除能力由强至弱依次为花、根、叶、根茎,其中,花多酚提取物的清除活性比阳性对照芦丁略强。可见,中华补血草不同部位多酚提取物是一种天然的自由基清除剂,能有效地清除有机自由基和活性氧自由基。
中华补血草根、根茎、叶和花的多酚提取物中总酚(以单宁酸计)质量分数均在51%以上,说明多酚类成分是中华补血草多酚提取物的主要组分。植物多酚是一类广泛存在于植物各器官的重要次生代谢产物,结构上的酚羟基使其具有较强的自由基清除活性和抗氧化活性[19],但植物多酚对自由基清除活性的强弱与其特殊结构密切相关。在类型多样的多酚成分中,原花色素类和黄酮类是自由基清除活性较强的类型,这点已得到不少研究结果的证实。中华补血草多酚提取物中,原花色素占总酚的比例较大,尤其是在根多酚提取物中高达64.07%。根多酚提取物对DPPH·具有很强的清除能力,对·OH和O-·2活性氧自由基也具有较强的清除作用。李均等[9]的研究结果表明:中华补血草根提取物对大豆卵磷脂脂质体氧化有显著抑制作用,对CD-POV和MDA的96 h抑制率分别达79.03%和93.36%,比槲皮素略低,说明中华补血草根提取物也具有较强的抗脂质过氧化作用。经Sephadex LH-20纯化后中华补血草根多酚提取物主要组成成分为低聚原花色素,可见,原花色素是根多酚提取物具有自由基清除能力的主要作用者(待发表)。有关中华补血草根多酚提取物中原花色素的具体化学结构及其表征有待进一步研究。
本文研究结果表明:中华补血草花的多酚提取物对·OH和O-·2均有很强的清除能力,ρSC50值分别为53.51和74.00μg·L-1。花多酚提取物以黄酮类成分为主,占总酚含量的68.15%。可见,花多酚提取物对自由基的清除作用与其中所含的大量黄酮类成分有关。
[1]马丰山,周曙明.中华补血草的开发价值初探[J].中国野生植物,1991(2):34-35.
[2]Lin L C,Chou C J.Flavonoids and phenolics from Limonium sinense[J].Planta Medica,2000,66(4):382-383.
[3]郭洪祝,袁久荣.中华补血草化学成分的研究[J].中草药,1994,25(8):398-400.
[4]Lin L C,Kuo Y C,Chou C J.Anti-herpes simplex virus type-1 flavonoids and a new flavanone from the root of Limonium sinense[J].Planta Medica,2000,66(4):333-336.
[5]Chaung SS,Lin C C,Lin J,et al.The hepatoprotective effects of Limonium sinense against carbon tetrachloride andβ-D-galactosamine intoxication in rats[J].Phytotherapy Research,2003,17(7): 784-791.
[6]Tang X H,Gao J,Chen J,et al.Expression of VDAC regulated by extracts of Limonium sinense Ktze root against CCl4-induced liver damage[J].Internationa1 Journal of Molecular Sciences,2007,8 (3):204-213.
[7]汤新慧,高 静,陈 瑾,等.中华补血草根提取物对D-GalN/ LPS肝损伤的防护作用[J].时珍国医国药,2008,19(8): 1888-1890.
[8]Tang Y H,Xu L Z,Tang X H,etal.Mitochondrial protection in the effect of Limonium sinense extract against acetaminophen-induced toxicity[J].南京大学学报:自然科学,2010,46(1):100-107.
[9]李 均,陈炳华,苏安玲.中华补血草根提取物抗氧化活性的初步研究[J].福建师范大学学报:自然科学版,2008,24(3): 83-87.
[10]李 均,陈炳华,王晶晶,等.AB-8大孔树脂对中华补血草根多酚的吸附洗脱特性[J].食品与发酵工业,2009,35(4): 65-69.
[11]孙 芸,谷文英.硫酸-香草醛法测定葡萄籽原花青素含量[J].食品与发酵工业,2003,29(9):43-46.
[12]Bae SH,Suh H J.Antioxidant activities of five differentmulberry cultivars in Korea[J].LWT-Food Science and Technology,2007,40(6):955-962.
[13]Lin JY,Tang C Y.Determination of total phenolic and flavonoid contents in selected fruits and vegetables,as well as their stimulatory effects on mouse splenocyte proliferation[J].Food Chemistry,2007,101(1):140-147.
[14]Fukumoto L R,Mazza G.Assessing antioxidant and prooxidant activities of phenolic compounds[J].Journal of Agricultural and Food Chemistry,2000,48(8):3597-3604.
[15]Liang A H,Zhou SM,Jiang ZL.A simple and sensitive resonance scattering spectral method for determination of hydroxyl radical in Fenton system using rhodamine Sand itsapplication to screening the antioxidant[J].Talanta,2006,70(2):444-448.
[16]Wang H Y,Zhao M M,Yang B,et al.Identification of polyphenols in tobacco leaf and their antioxidant and antimicrobial activities[J].Food Chemistry,2008,107(4):1399-1406.
[17]李春阳,许时婴,王 璋.DPPH法测定葡萄籽原花青素清除自由基的能力[J].食品与生物技术学报,2006,25(2):102-106.
[18]李小飞,张 伟,薛淑媛,等.两种测试方法对DPPH分光光度法测试结果的影响[J].生物技术,2007,17(4):51-53.
[19]张力平,孙长霞,李俊清,等.植物多酚的研究现状及发展前景[J].林业科学,2005,41(6):157-162.
