胶束电动毛细管色谱法测定何首乌中的二苯乙烯苷、大黄素和大黄酚
2011-12-26陈冠华武传芹
吴 娴,陈冠华,王 坤,石 杰,武传芹
(江苏大学食品与生物工程学院,江苏镇江 212013)
胶束电动毛细管色谱法测定何首乌中的二苯乙烯苷、大黄素和大黄酚
吴 娴,陈冠华,王 坤,石 杰,武传芹
(江苏大学食品与生物工程学院,江苏镇江 212013)
采用胶束电动毛细管色谱法,建立测定何首乌中二苯乙烯苷、大黄素、大黄酚的新方法,对影响分离的诸因素进行了优化。缓冲液组成为25 mmol/L硼砂-40 mmol/L十二烷基硫酸钠-10%(体积分数)乙醇,p H值为9.5。在优化的条件下,二苯乙烯苷、大黄素和大黄酚可于20 min内分离;线性范围分别为10~1 000,5.2~260,4.5~225 mg/L;检出限分别为1.10,0.29,0.43 mg/L;平均加标回收率分别为98.8%,98.8%,100.7%。该方法可满足何首乌中二苯乙烯苷、大黄素和大黄酚的测定要求,可作为何首乌药材的质量控制方法。
胶束电动毛细管色谱;何首乌;二苯乙烯苷;大黄酚;大黄素
何首乌为蓼科植物何首乌的干燥块根,其根和茎所含蒽醌类、二苯乙烯苷类和磷脂类化合物是其药理作用的物质基础。二苯乙烯苷(2,3,5,4'-四羟基二苯乙烯-2-O-β-D-葡萄糖苷)为何首乌主要的水溶性成分,具有抗衰老[1]、提高免疫力、防止动脉硬化和保肝的药理作用,其含量作为何首乌及其制剂的质量控制指标。蒽醌类成分是何首乌中公认的主要活性成分,现代药理学研究表明其具有抗菌消炎、利尿和抗肿瘤[2]、调节免疫功能[3]等作用。
目前文献报道对二苯乙烯苷、大黄素、大黄酚的测定方法主要有紫外分光光度法、荧光法、薄层层析法、高效液相色谱法[4-8]。胶束电动毛细管色谱(MECC)是毛细管电泳的一种分离模式,具有分离效率高、分析速度快、样品用量和试剂消耗小等突出优点,被广泛应用于蒽醌类[9-10]、皂苷类[11-14]、酚酸类[15-16]、黄酮类[17]、内酯类[18]和生物碱类[19-20]等多种天然药物成分的分离检测。尚小玉等在5 min内实现了对大黄中大黄酚、大黄素、土大黄苷和大黄酸的分离[21];张国庆等分离了何首乌中的7种蒽醌类成分,但仅能检测出大黄素和大黄酸[22];袁海龙等报道了以毛细管区带电泳模式检测何首乌中二苯乙烯苷的方法[23]。对何首乌中二苯乙烯苷、大黄素和大黄酚进行同时分离测定,可以为何首乌药材质量控制以及何首乌药效成分提取工艺研究提供检测方法,目前尚无采用MECC法对此3种成分进行同时分离检测的报道。笔者对此进行了研究,与已报道的HPLC同时测定何首乌中二苯乙烯苷和蒽醌类的方法相比,本方法分析时间较短,3种成分可同时检出。
1 材料与方法
1.1 仪器与试剂
CL1020高效毛细管电泳仪(北京彩陆科学仪器有限公司提供);电源(电压0~30 k V可调);未涂层熔融石英毛细管柱(62 cm×75μm,有效长度为50 cm,产地为河北永年);HW-2000色谱工作站(邯郸市鑫诺光纤色谱有限公司提供);高速中药粉碎机(青州市精密制药机械制造有限公司提供);BS124S电子分析天平(赛多利斯公司提供);p HS-2型酸度计(上海第二分析仪器厂提供);B5500S-MT超声清洗机(上海必能信超声有限公司提供);优谱超纯水机(成都超纯科技有限公司提供)。
何首乌(镇江市售);二苯乙烯苷对照品(昆明科翔生物科技有限公司提供,纯度>98%);大黄酚、大黄素对照品(上海博蕴生物技术有限公司提供,纯度>98%);硼砂、十二烷基硫酸钠(SDS)、甲醇,均为分析纯;水为二次重蒸水(电阻率为182 kΩ·cm)。
1.2 电泳条件
重力进样(16 cm×5 s),分离电压为15 k V,检测波长为254 nm,温度为25℃。缓冲体系为25 mmol/L硼砂-40 mmol/L的SDS-10%(体积分数)乙醇,p H 值为9.5。
第1次使用前,依次用1.0 mol/L的 HCl、水、0.1 mol/L的 NaOH、水和缓冲溶液冲洗毛细管5,3,10,3,10 min,在2次运行之间依次用水、0.1 mol/L的 NaOH、水和缓冲溶液冲洗毛细管1,2,1,2 min。为了保证重现性,缓冲溶液每运行3次后要进行更新。
1.3 标准和样品溶液制备
精密称定二苯乙烯苷、大黄素、大黄酚适量,分别以甲醇为溶剂,配制成标准储备液(二苯乙烯苷质量浓度为1 000 mg/L,大黄素质量浓度为520 mg/L,大黄酚质量浓度为450 mg/L),于4℃保存。在使用前,用甲醇稀释为不同质量浓度的工作溶液。
将一定量的何首乌粉碎过177μm(80目)筛。准确称取0.5 000 g,加入30 m L甲醇溶液,超声提取60 min,冷却至室温,浸泡12 h后过滤。将滤渣用20 m L甲醇超声提取60 min后过滤,合并2次滤液,减压浓缩并定容至10 m L,用0.45μm滤膜过滤备用。
2 结果与讨论
2.1 硼砂缓冲液p H值的选择
缓冲液p H值对组分的峰形和迁移时间均有影响。当p H值低于8.5时,大黄素和大黄酚在60 min内未见出峰;随着p H值的升高,两者均可出峰,但大黄酚峰形有拖尾现象,这种现象是大黄素和大黄酚在较低p H值条件下发生沉淀析出并被吸附于管壁上所造成的。如图1所示,随着p H值的继续上升,组分的峰宽逐渐变窄,拖尾现象得到改善。当p H值在9.5以上时,大黄酚拖尾现象消失,但迁移时间会有所增加,综合考虑迁移时间,选择缓冲液的最佳p H值为9.5。
2.2 硼砂浓度的影响
缓冲液浓度在一定范围内可影响到电渗流、组分与管壁的相互作用和组分区带的扩散。图2所示为硼砂浓度为10~30 mmol/L时对组分峰宽的影响。当硼砂浓度较低时,大黄酚峰形拖尾严重;随着缓冲液浓度的增加,大黄酚峰宽逐渐减小,同时电渗流降低,组分的迁移时间增长;当硼砂浓度高于25 mmol/L时,基线噪声较大,对检出限有不利影响。综合考虑峰形和基线噪声的影响,选择硼砂浓度为25 mmol/L。

图2 硼砂浓度对分析物峰宽的影响Fig.2 Effect of buffer concentration on peak width
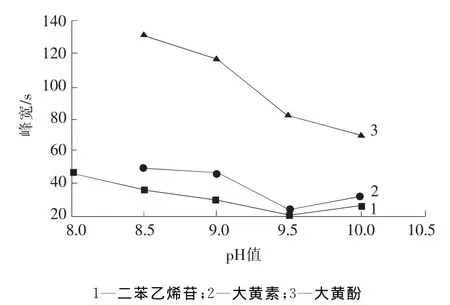
图1 酸度对分析物峰宽的影响Fig.1 Effect of p H on peak width
2.3 SDS浓度的影响
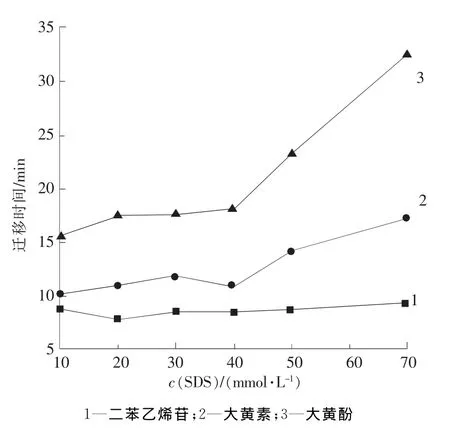
图3 SDS浓度对分析物迁移时间的影响Fig.3 Effect of SDS concentration on migration time
SDS浓度可影响组分的容量因子k′,从而对其迁移时间产生影响。SDS浓度对分析物迁移时间的影响见图3。从图3中可以看出,当SDS浓度超过40 mmol/L时,组分的迁移时间随SDS浓度的增大而增大,并且基线噪声明显增强;而当SDS浓度小于40 mmol/L时,组分在管壁上存在吸附现象,峰形拖尾,且随SDS浓度增大而逐步改善。这是由于缓冲液中的SDS可以通过疏水相互作用增强组分在胶束中的溶解,从而对其在管壁上的吸附产生一定抑制。综合考虑迁移时间、检出限和峰形,选择SDS浓度为40 mmol/L。
2.4 乙醇体积分数的影响
有机溶剂可以改善组分在缓冲液中的溶解度,从而使迁移时间变短,乙醇对分析物迁移时间的影响见图4。从图4可以看出,当乙醇体积分数小于5%时,迁移时间随乙醇体积分数增大而减小;但当体积分数继续增大时,迁移时间又会增大,这是乙醇体积分数升高导致电渗流变小所致;当乙醇体积分数低于10%时,大黄酚由于管壁吸附而峰形拖尾;随着乙醇体积分数的增加,大黄酚由于在缓冲液中溶解度增加而使其吸附得以抑制,拖尾逐步改善。综合考虑迁移时间和峰形的影响,选择乙醇的体积分数为10%。
2.5 分离电压的影响
研究了分离电压为8~18 k V时对组分迁移时间的影响。结果表明,组分迁移时间随分离电压升高而下降,但电压超过15 k V后将使基线噪声增大,影响检出限。综合考虑迁移时间和基线噪声的影响,选择分离电压为15 k V。
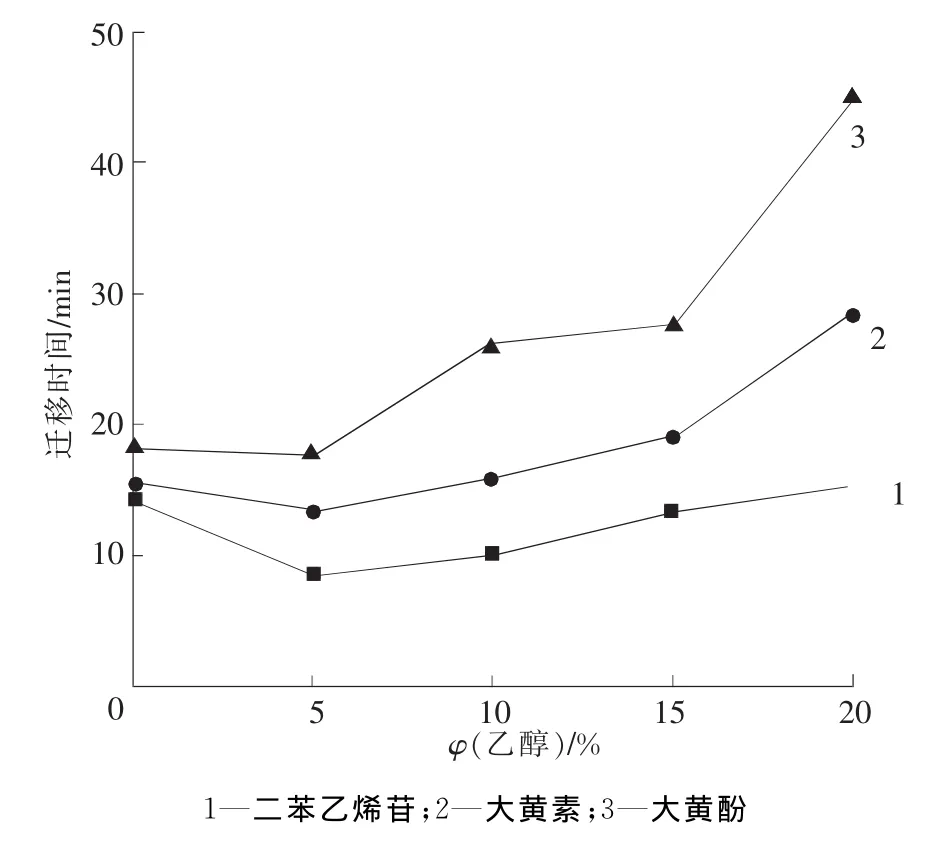
图4 乙醇体积分数对分析物迁移时间的影响Fig.4 Effect of ethanol concentration on migration time
2.6 线性范围和检出限
按照优化的电泳条件对不同质量浓度的标准工作溶液系列进行测定,可得二苯乙烯苷、大黄素和大黄酚的标准曲线。对空白样品测定后按3倍信噪比获得了组分的检出限,结果如表1所示。

表1 检出限、工作曲线及其线性范围Tab.1 Detection limits calibration curves and linear dynamic ranges
2.7 方法的日内和日间精密度
配制二苯乙烯苷、大黄素和大黄酚的标准溶液,于配制当日连续测定6次,可得日内迁移时间和峰面积的RSD值;对同一标准溶液在配制后6日内每日进行测定,可得日间迁移时间和峰面积的RSD值,见表2。
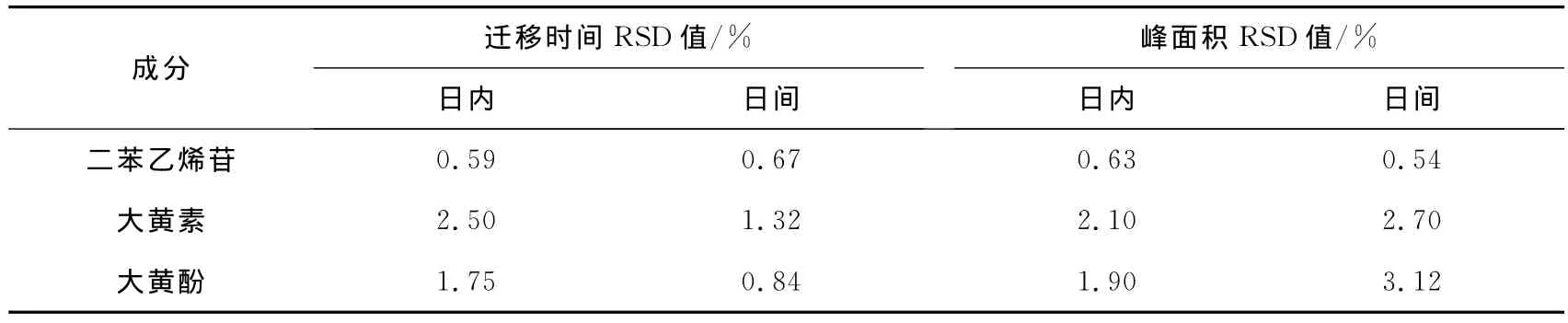
表2 精密实验结果Tab.2 Precision results
2.8 样品测定结果和加标回收率
按照样品制备方法制备6份平行样品,测得二苯乙烯苷的质量分数和相对标准偏差分别为17.6 mg/g和3.8%;大黄素的质量分数和相对标准偏差分别为1.19 mg/g和3.37%;大黄酚的质量分数和相对标准偏差分别为0.17 mg/g和2.97%。对照品和样品的电泳图如图5所示。同时进行3个质量浓度级别的加标回收率测定,结果如表3所示。
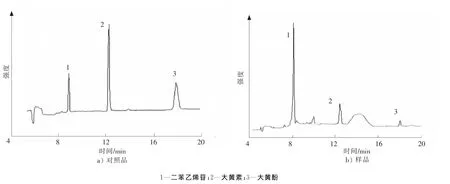
图5 对照品和样品的电泳谱图Fig.5 Electropherograms of the reference substance and the extract
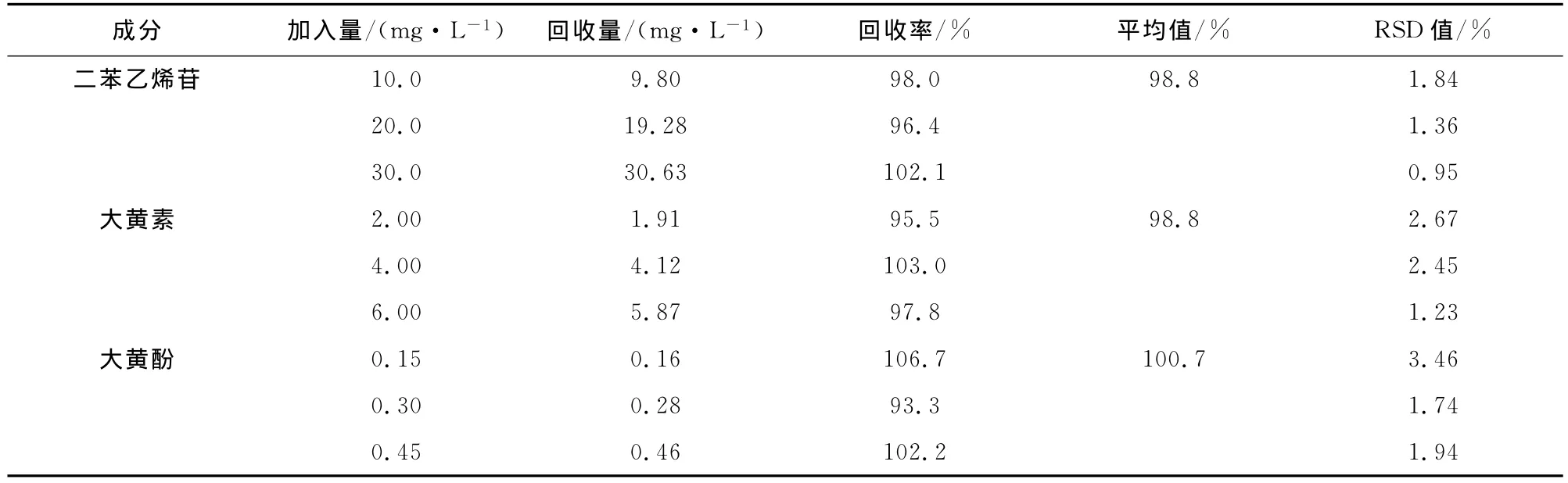
表3 回收率实验结果(n=6)Tab.3 Results of recovery(n=6)
3 结 语
样品和加标回收率测定结果表明,本方法准确度和精密度较高,可满足何首乌药材质量控制的要求。
[1] ZHANG L,XING Y,YE C F,et al.Learning-memory deficit with aging in APP transgenic mice of Alzheimer's disease and intervention by using tetrahydroxystilbene glucoside[J].Behavioural Brain Research,2006,173(2):246-254.
[2] 卫培峰,焦晨莉,陈丹丹.何首乌现代药理研究进展[J].现代中医药(Modern Traditional Chinese Medicine),2004(1):57-58.
[3] 孙桂波,邓响潮,郭宝江,等.何首乌蒽醌苷类化合物抗肿瘤作用研究[J].中国新药杂志(Chinese Journal of New Drugs),2008,17(10):837-841.
[4] 蔡丽芬,钟国跃,张 倩,等.HPLC测定不同生长年限及采收期何首乌中二苯乙烯苷和蒽醌类成分的含量[J].中国中药杂志(China Journal of Chinese Materia Medica),2010(10):1 221-1 225.
[5] 库尔班江.高效薄层光密度法测定牛黄解毒丸中大黄素的含量[J].喀什师范学院学报(Journal of Kashgar Teachers College),2002,23(6):43-45.
[6] 卢建秋,高晓燕.HPLC-DAD法同时测定大黄中7个蒽醌类化合物的含量[J].药物分析杂志(Chinese Journal of Pharmaceutical Analysis),2010,30(9):1 636-1 641.
[7] 孙小梅,马 聪,吴士筠,等.大黄素的分光光度测定及其应用[J].中南民族学院学报 (自然科学版)(Journal of South-Central University for Nationalities(Natural Sciences)),2001,20(4):13-15.
[8] 赵仁邦,葛 微.高效液相色谱法测定何首乌中大黄酸、大黄素、大黄素甲醚的含量[J].食品科学(Food Science),2001,22(2):64-67.
[9] BASKAN S,DAUT-ZDEMIR A,GUNAYDIN K,et al.Analysis of anthraquinones in rumex crispus by micellar electrokinetic chromatography[J].Talanta,2007,71(2):747-750.
[10] 尚小玉,袁倬斌.β-环糊精修饰胶束电动毛细管色谱法测定大黄中有效成分[J].分析化学(Chinese Journal of Analytical Chemistry),2002,30(7):853-856.
[11] 梁生旺,王 瑞,王淑美,等.胶束电动毛细管色谱法分离分析三七中的人参皂苷Rg1、人参皂苷Re和三七皂苷R1[J].药物分析杂志(Chinese Journal of Pharmaceutical Analysis),2007,27(2):183-186.
[12] 王 瑞,王淑美,梁生旺,等.胶束电动毛细管色谱法分离分析山茱萸中齐墩果酸和熊果酸[J].中药材(Journal of Chinese Medicinal Materials),2007,30(8):946-950.
[13] 肖美添,叶 静,黄雅燕,等.胶束毛细管电泳测定枇杷叶中熊果酸和齐墩果酸的含量[J].药物分析杂志(Chinese Journal of Pharmaceutical Analysis),2007,27(5):724-727.
[14] 董 敏,陈冠华,吴 娴,等.胶束电动毛细管色谱法测定酸枣仁皂苷A和B[J].中国天然药物(Chinese Journal of Natural Medicines),2010,8(3):208-211.
[15] SHI S,LI W,LIAO Y,et al.Online concentration of aristolochic acidⅠandⅡin Chinese medicine preparations by micellar electrokinetic chromatography[J].Journal of Chromatography A,2007,1 167(1):120-124.
[16] 郭 涛,孙 沂,隋 因,等.胶束电动毛细管色谱法同时测定当归中阿魏酸和腺苷的含量[J].药物分析杂志(Chinese Journal of Pharmaceutical Analysis),2003,23(5):348-351.
[17] ZHU J,YU K,CHEN X,et al.Comparison of two sample preconcentration strategies for the sensitivity enhancement of flavonoids found in Chinese herbal medicine in micellar electrokinetic chromatography with UV detection[J].Journal of Chromatography A,2007,1 167(2):191-200.
[18] 李 琦,胡广林,徐晓琴,等.胶束电动毛细管色谱法测定穿心莲中穿心莲内酯和脱水穿心莲内酯[J].分析化学(Analchemical),2003,31(4):451-454.
[19] ZHOU L,ZHOU X,LUO Z,et al.In-capillary derivatization and analysis of ephedrine and pseudoephedrine by micellar electrokinetic chromatography with laser-induced fluorescence detection[J].Journal of Chromatography A,2008,1 190(1/2):383-389.
[20] 翁前锋,袁凯龙,张宏颖,等.胶束电动毛细管色谱安培检测中药马齿苋中多巴胺和去甲肾上腺素[J].色谱(Chromatography),2005,23(1):18-21.
[21] 尚小玉,袁倬斌.胶束电动毛细管色谱分离大黄中有效成分的研究[J].中草药(Chinese Traditonal Drug),2001,32(8):691-692.
[22] 张国庆,陈万生.高效毛细管电泳法分离模拟混合的何首乌中7种蒽醌类成分的研究[J].药学实践杂志(The Journal of Pharmaceutical Practice),1999,17(6):352-354.
[23] 袁海龙,张 纯.高效毛细管电泳法测定何首乌中二苯乙烯苷的含量[J].解放军药学学报(Pharmaceutical Journal of Chinese People's Liberation Army),2000,16(3):151-154.
[24] 杨会龙,刘宝友,王淑娟.几种植物有效成分的提取及杀虫活性研究[J].河北科技大学学报(Journal of Hebei University of Science and Technology),2005,26(3):208-211.
[25] 刘红梅,周庆霞,杨文玲.毛细管气相色谱法测定银杏叶中萜内酯含量[J].河北科技大学学报(Journal of Hebei University of Science and Technology),2006,27(3):209-213.
Determination of stilbene glycoside,emodin and chrysophanol in radix polygoni muliflori by micellar electrokinetic capillary chromatography
WU Xian,CHEN Guan-hua,WANG Kun,SHI Jie,WU Chuan-qin
(College of Food and Bioengineering,Jiangsu University,Zhenjiang Jiangsu 212013,China)
A new assay is developed by use of micellar electrokinetic capillary chromatography to determine stilbene glycoside,emodin and chrysophanol in radix polygoni muliflori.The factors affecting separation are optimized.The running buffer contains 25 mmol/L borax,40 mmol/L sodium dodecyl sulfate and 10%ethanol,and its p H value is adjusted to 9.5.Under the optimum conditions,the linear dynamic range is 2.0~1 000 mg/L for stilbene glycoside,5.2~260 mg/L for emodin and 4.5~225 mg/L for chrysophanol.The limits of detection are 1.10,0.29 and 0.43 mg/L for stilbene glycoside,emodin and chrysophanol,respectively.The average recoveries are 98.8%,98.8%and 100.7%for stilbene glycoside,emodin and chrysophanol.The assay meets the determination requirement of stilbene glycoside,emodin and chrysophanol in radix polygoni muliflori,and can be applied to quality control of the raw material of radix polygoni muliflori.
micellar electrokinetic capillary chromatography;radix polygoni muliflori;stilbene glycoside;chrysophanol;emodin
R284.1;O657.8
A
1008-1542(2011)05-0426-05
2011-05-23;
2011-09-10;责任编辑:张士莹
教育部高等学校博士学科点专项科研基金资助项目 (20093227110010);江苏大学科研基金资助项目 (08JDG001);江苏省高校优势学科建设工程资助项目
吴 娴(1986-),女,安徽马鞍山人,硕士研究生,主要从事食品安全检测方面的研究。
陈冠华教授。E-mail:chengh@ujs.edu.cn
