吐温80与氢氧化钠耦合污泥溶胞及生物水解酸化特性研究
2011-12-25吕学斌支苏丽张云霞张书廷
吕学斌,支苏丽,张云霞,张书廷
天津大学环境科学与工程学院,天津 300072
近年来,随着我国经济的高速发展和城市化进程的加快,污水处理厂急速增加,与此相伴产生了大量的剩余污泥。由于污泥无害化处理处置成本高,且处理不当会形成新的污染,因此,剩余污泥的处理处置己成为我国城市化过程中亟待解决的重大环境问题。
剩余污泥处理与处置的首要原则就是污泥源头减量。传统的污泥减量主要采用浓缩、脱水和干燥降低污泥的含水率,进而减少污泥容积,以便后续的污泥运输和处置。这种传统的污泥末端处理技术,处理费用昂贵,且无法从根本上减少污泥的干物质量,对后续的污泥处置依然带来巨大压力。因此,近年来,越来越多的研究开始着眼于污泥源头减量化,与之相应的技术研发也日益成为国内外的研究热点。
通常,污泥源头减量化包括溶胞阶段和生物转化阶段,溶胞是速率限制步骤[1]。因此,高效低成本污泥细胞溶解及其降解转化技术是实现剩余污泥减量化的关键所在。目前常用的污泥溶胞方法包括臭氧溶胞法[2-4]、高能密度超声波溶胞法[5-6]及热碱耦合法[2]等。由于臭氧在水中的溶解性差,利用率不高,且发生成本较高,导致臭氧溶胞法处理的费用较高;而高能密度超声波溶胞技术设备能耗高,关键部件易损坏,造成运行成本高;热碱耦合溶胞技术不仅加热能耗大,材料易腐蚀,而且散发臭味。笔者曾对吐温80与氢氧化钠耦合强化剩余污泥溶胞的效果进行过研究,结果表明,吐温80的存在不仅能有效提高氢氧化钠对剩余污泥的溶胞效果,而且能降低溶胞的环境温度[7]。
污泥破壁后,细胞内的蛋白质、多糖等物质释放出来,这些物质多为大分子,不易被生物所利用。如果将溶胞后的污泥通过厌氧酸化技术将大分子物质水解为有机酸、氨基酸等小分子有机物,再回流至污水处理系统的生物处理阶段,则大大提高了其生物可利用性。
笔者以吐温80与氢氧化钠耦合溶胞后的污泥为研究对象,考察了破壁后污泥上清液中蛋白质,DNA等的变化,并以破壁后的污泥为底物考察了其水解酸化特性,以期为污泥的源头减量化提供一种新的实用技术。
1 材料及方法
1.1 装置
溶胞后污泥用厌氧水解酸化试验装置(图1)处理。厌氧消化反应器为1150 mL的广口瓶,污泥体积为1000 mL,反应器置于水浴槽中,通过恒温电加热棒控制反应器内温度为(36±1)℃,采用磁力搅拌器(天津市欧诺仪器仪表有限公司)对反应物连续搅拌。取样时,从氮气入口通入氮气,利用氮气压力将污泥样从取样口压出,每次取样约80 mL。
1.2 试验方法
取一定量的污泥,用5 mol/L NaOH调节初始pH为11.5,在吐温80投加量为100 mg/L的条件下对污泥进行溶胞处理,测定不同时间下污泥上清液pH,蛋白质和DNA的浓度变化。
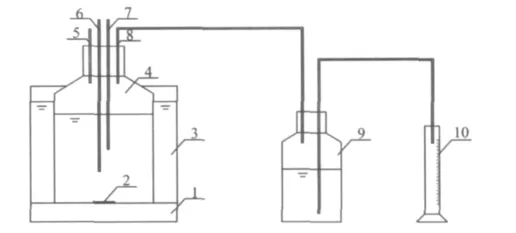
图1 溶胞后污泥水解酸化试验装置Fig.1 The experimental device for hydrolysis and acidification after sludge lysis
水解酸化试验分4组进行:第1组单独调污泥初始pH为11.5,作为对照组;其余3组先投加吐温80,投加量分别为0.1,1和2 g/L,反应15 min后再调节pH为11.5。经过30 min充分溶胞后,按照接种泥∶溶胞泥为200∶800分别加入水解酸化反应器中,温度设为36℃,厌氧水解酸化时间为72 h,考察水解酸化过程中挥发性脂肪酸(VFAs),氨氮及pH的变化情况。
1.3 分析方法
污泥上清液pH采用雷磁pHS-3C精密pH计进行测定,CODCr采用KDB-Ⅲ型 COD微波消解仪[8]+硫酸亚铁铵滴定方法测定,蛋白质和DNA浓度的测定分别采用Folin-酚试剂法(Lowry)[9]和二苯胺法[9],氨氮参照国家环境保护标准方法[10]进行测定。
胞外聚合物(EPS)提取采用热处理方法[11]:将预处理过的活性污泥移至装有磷酸盐缓冲液锥形瓶中,用80℃的水浴加热处理,每10 min取样1次,将取出的混合物于10000 r/min下离心15 min,上清液为含有EPS的溶液。
VFAs浓度测定方法[12]:取适量污泥混合液于10000 r/min下离心30 min,取上清液用0.45μm的滤膜进行真空抽滤,滤液用25%的偏磷酸溶液调节pH小于3。采用气相色谱仪(SP-6890),氢火焰检测器,AT-FFAP毛细色谱柱(30 m×0.32 mm×0.5μm)进行气相色谱测定(均由山东鲁南瑞虹化工仪器有限公司制造)。试验设定柱头压为0.12 MPa,氢气压为0.5 MPa,空气压为1.1 MPa,气化室和检测器的温度均为220℃。柱温采用程序升温,初始温度为110℃,以10℃/min升温至150℃,保持5 min。VFAs浓度为乙醇、乙酸、丙酸、异丁酸、丁酸、异戊酸和戊酸浓度的总和。
2 结果与讨论
2.1 溶胞过程中污泥上清液pH的变化
在污泥初始pH为11.5,吐温80投加量为100 mg/L时,考察了污泥上清液pH随溶胞时间的变化。随着溶胞时间的增长,pH有明显的下降。经过60 min的溶胞,污泥上清液pH从初始的11.1(pH为11.5的污泥经离心后上清液pH为11.1)降低到10.6左右(图2)。其主要原因是在吐温80和碱的耦合作用下,污泥絮体被破解,而污泥絮体在破解过程中会产生VFAs[13-16],并溶解到污泥上清液中;同时,污泥絮体的EPS以及污泥微生物细胞内均含有核酸[17],在胞外聚合物溶解过程中,核酸会溶解到污泥上清液中,这些都会导致污泥上清液的pH下降。因此,污泥上清液pH的下降证明了,在试验条件下有部分污泥细胞被破解。
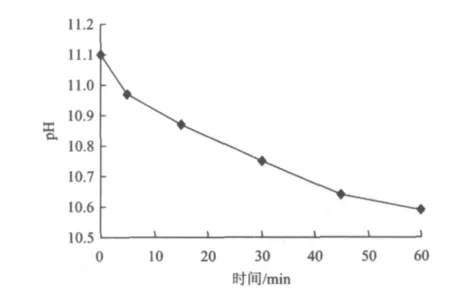
图2 污泥上清液pH随溶胞时间的变化Fig.2 Variation of pH in supernatant of sludge versus lysis time
2.2 溶胞过程中污泥上清液蛋白质和DNA浓度的变化
剩余污泥中有机物含量较高,污泥胞外聚合物主要成分有蛋白质和多糖。而细胞内原生质体则主要包括蛋白质,多糖,脂类,DNA,RNA等有机物与各种无机盐。在研究吐温80与碱耦合对污泥溶胞影响程度时,可以通过蛋白质、多糖和DNA等指标来表征。由于污泥中多糖种类繁多且性质不稳定,极易水解,且水解产物复杂[18-19],以多糖作为评价破壁程度的指标误差较大,因此,笔者采用以蛋白质和DNA溶出量为指标评价污泥的溶胞效果。表1给出了污泥破壁前上清液和污泥EPS中的蛋白质和DNA的浓度值。这些浓度值是判断污泥溶胞效果的背景数据。

表1 原污泥的上清液和EPS中蛋白质和DNA浓度Table 1 Concentrations of protein and DNA in supernatant and EPS of raw sludge mg/L
当碱与吐温80耦合作用于剩余污泥时,污泥上清液中蛋白质与DNA浓度均随着作用时间的延长而逐渐增加(图3)。污泥溶胞前上清液中初始蛋白质和DNA的浓度分别为38.8和1.2 mg/L,经过60 min溶胞后时,污泥上清液中蛋白质与DNA浓度分别达到了1301.2和20.1 mg/L,较初始上清液中蛋白质和DNA浓度分别提高了32.5倍和15.8倍,并且都超过了原污泥上清液和EPS中蛋白质和DNA浓度之和(833.9与11.0 mg/L)。这一结果揭示了在污泥溶胞过程中,不仅是EPS中蛋白质和DNA等物质被释放出来,而且细胞内部结构也得到了破解,使细胞内蛋白质和DNA也释放到了溶液中。
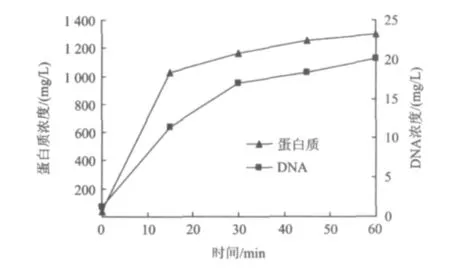
图3 污泥溶胞前后上清液中蛋白质和DNA浓度的变化Fig.3 Variation of protein and DNA concentrations versus lysis time in supernatant of sludge
2.3 溶胞后污泥水解酸化过程中VFAs浓度的变化
溶胞后污泥EPS和细胞中的蛋白质、多糖等有机质释放出来并溶解到水中,这些大分子的有机物不容易被生物直接利用。利用水解酸化工艺可以将大分子的蛋白质和多糖等降解为氨基酸,VFAs等小分子有机物,有利于后续生物的处理。图4为不同吐温80投加量下的污泥水解酸化过程中VFAs随时间的变化情况。
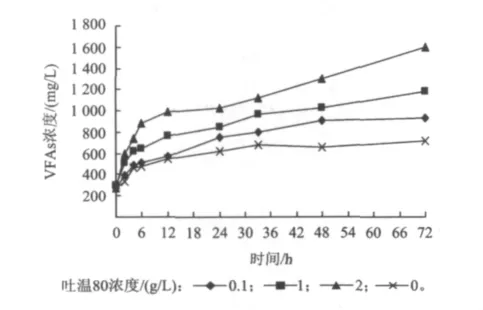
图4 溶胞后污泥水解酸化过程中VFAs浓度随时间的变化Fig.4 Variation of VFAs versus time during hydrolysis and acidification after sludge lysis
从图4可以看出,在酸化开始时,4组污泥上清液中VFAs的浓度一致,为276.8 mg/L。而在72 h的时间内,碱与吐温80耦合作用预处理后的污泥在水解酸化过程中,VFAs浓度则明显高于空白对照组,VFAs浓度随吐温80浓度和酸化时间增加而增加,这个结论与相关文献报道[20]是一致的。当吐温80投加量为0.1,1和2 g/L时,分别对应最大产酸量为923.2,1182.5和1621.1 mg/L,均超过了对照组的最大产酸量707.5 mg/L,表明碱与吐温80耦合作用能促进污泥厌氧产酸。这主要是由于表面活性剂特有的两性结构使得其具有“两亲”和“增溶”作用[21-23]。“两亲”作用使得表面活性剂链接于污泥表面的大分子与水分子之间,在外界搅拌力的作用下,污泥表面的大分子物质能够脱离污泥颗粒;增溶作用指表面活性剂能够促使一些溶解度较小或难溶物质的溶解度增加。脱离污泥表面并溶于水中的大分子物质在微生物产生的水解酶的作用下被水解为低分子量的有机物,通过产酸菌的酸化作用最终被转化为低分子脂肪酸。因此表面活性剂的加入可提高污泥的水解速率,为产酸菌提供更多的发酵底物,从而大幅度地提高水中有机酸产量。
2.4 溶胞后污泥水解酸化过程中氨氮的变化
在污泥厌氧水解酸化过程中,不同吐温80浓度下各组反应中氨氮浓度随时间的变化情况如图5所示。从图5可以得出,随着吐温80浓度的增加与水解酸化时间的延长,氨氮的浓度越来越大,当吐温80浓度分别为0.1,1和2 g/L时,在72h时氨氮浓度分别为288.4,916.3和1153.9mg/L,而对照组仅为246.1 mg/L。表明吐温80对水解酸化细菌分解蛋白质具有促进作用。张志波等[24]报道,吐温80并不能明显促进菌体生长,但却提高了酶活性,这是因为吐温80能促使细胞膜双分子层产生特定的离子通道、改变细胞表面性质以及粒子极性[25-26],促进胶体表面吸附能力下降、脱水,由此可以推断,添加吐温80可以改变微生物表面的性质和在污泥中的界面张力及胶团性质,促进了酶的释放和介质的分散吸收,从而促进了污泥的消化进程。
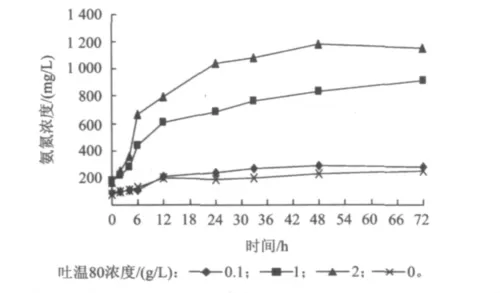
图5 溶胞后污泥水解酸化过程中氨氮浓度随时间的变化Fig.5 Variation of ammonia nitrogen versus time during hydrolysis and acidification after sludge lysis
2.5 溶胞后污泥水解酸化过程中pH的变化
pH是影响厌氧水解酸化最重要的影响因素之一。如果污泥溶胞后pH过高就会影响后续水解酸化速率。图6为溶胞后污泥进行厌氧水解酸化过程中pH随时间的变化趋势。
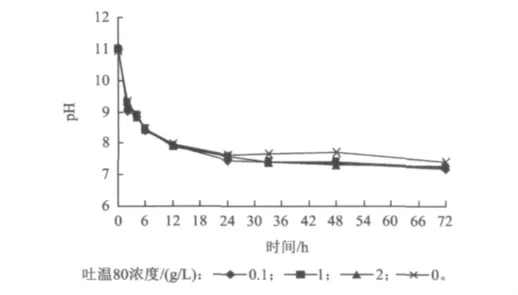
图6 溶胞后污泥水解酸化过程中pH随时间的变化Fig.6 Variation of pH versus time during hydrolysis and acidification after sludge lysis
由图6可以看出,4组试验中pH的变化趋势基本一致。由图6可知,水解酸化2 h后,系统的pH由11.0(污泥溶胞后pH已经从11.5降至11.0左右)迅速降至9.2左右,达到了水解酸化微生物适宜的pH范围。24 h后,pH降为7.4左右,此后pH下降较为缓慢,表明水解酸化系统已进入了稳定运行阶段。
pH在开始阶段下降较快的原因可能是在厌氧消化初期,污泥中含有的有机物在微生物的作用下,生成大量有机酸,在污泥中积累,从而导致污泥pH的下降。消化后期,有机物消耗殆尽,污泥中有机酸的浓度变化不大,污泥pH趋于平稳[19]。
3 结论
(1)利用吐温80与氢氧化钠耦合对污泥进行处理,经过60 min溶胞后,污泥的 pH从初始的11.1降到10.6;污泥上清液分别达到1301.2和20.1 mg/L,较初始上清液分别提高了32.5倍和15.8倍。证明吐温80与氢氧化钠耦合可以将污泥细胞破解。
(2)溶胞后的污泥在水解酸化过程中,VFAs和氨氮浓度随吐温80浓度和酸化时间的增加而增加。表明吐温80的加入对水解酸化菌分解污泥中大分子有机物具有明显的促进作用。
(3)溶胞后的污泥在水解酸化24 h后pH降为7.4,此后pH下降缓慢,系统进入稳定运行阶段。
[1]MULLER J.Disintegration as a key-step in sewage sludge treatment[J].Water Sci Technol,2000,41(8):123-130.
[2]YASUI H,SHIBATA M.An innovative approach to reduce excess sludge production in the activated-sludge process[J].Water Sci Technol,1994,30(9):11-20.
[3]BOUGRIER C,ALBASI C,DELGENES J P,et al.Effect of ultrasonic,thermal and ozone pre-treatments on waste activated sludge solubilisation and anaerobic biodegradability[J].Chemical Engineering Processing,2006,45(8):711-718.
[4]DELERIS S,PAUL E,AUDIC J M,et al.Effect of ozonation on activated sludge solubilization and mineralization[J].Ozone-Science & Engineering,2000,22(5):473-486.
[5]曹秀芹.超声波技术在污泥减量中的应用研究[D].北京:北京建筑工程学院,2003.
[6]NICKEL K,NEIS U.Ultrasonic disintegration of biosolids for improved biodegradation[J].Ultrasonics Sonochemistry,2007,14(4):450-455.
[7]吕学斌,张云霞,张书廷,等.吐温80与氢氧化钠耦合强化剩余污泥溶胞效果的研究[J].环境工程学报,2011,5(10):2359-2363.
[8]贾国珍,薛雪娟.“微波消解COD测定仪”在水环境监测中的应用与探讨[J].东北水利水电,2001,19(5):48-51.
[9]彭玉荪,朱婉华,陈钧辉.生物化学实验[M].3版.北京:科学出版社,1989.
[10]环境保护部.HJ 535—2009 水质氨氮的测定纳氏试剂分光光度法[S].北京:中国环境科学出版社,2009.
[11]田卫东.三种方法提取活性污泥胞外聚合物的比较[J].技能技术,2009,327(2):184-186.
[12]刘立成,曹秀青,刘大森.毛细管气相色谱法测试瘤胃液VFA可行性的研究[J].饲料工业,2008,29(28):59-60.
[13]LENDORMI T,PREVOT C,DOPPENBERG F,et al.Wet oxidation of domestic sludge and process integration:the Mineralis®process[J].Water Sci Technol,2001,44(10):163-169.
[14]BARLINDHAUG J,ODEGARD H.Thermal hydrolysate as a carbon soucre for denitrification[J].Water Sci Technol,1969,33(12):99-108.
[15]杨虹.超声破解促进污泥厌氧水解酸化速率的研究[D].天津:天津大学,2005.
[16]王芬.超声破解对污泥特性的影响机制与零剩余污泥排放工艺研究[D].天津:天津大学,2006.
[17]周群英,高延耀.环境工程微生物学[M].北京:高等教育出版社,2000.
[18]周秀贞,何立望,黄如彬.生物化学[M].贵州:贵州科技出版社,1993.
[19]吕火焰.碱和超声波促进污泥厌氧水解酸化-好氧减量研究[D].天津:天津大学,2009.
[20]李清清.表面活性剂在污泥资源化中的应用[D].长沙:湖南大学,2007.
[21]申沛,陈银广.表面活性剂促进污泥产酸及用于生物除磷的研究进展[J].四川环境,2008,27(3):93-97.
[22]CHEN Y G,YANG H Z,GU G W.Effect of acid and surfactant treatment on activated sludge dewatering and settling[J].Water Res,2001,35(11):2615-2620.
[23]陈银广,杨海真,吴桂标,等.表面活性剂改进活性污泥的脱水性能及其作用机理[J].环境科学,2000,21(9):97-100.
[24]张志波,曾光明.Tween-80和鼠李糖脂对铜绿假单胞菌及枯草芽孢杆菌产蛋白酶的影响[J].环境科学学报,2006,26(7):1152-1158.
[25]SHEPPARD J D,JUMARIE C,COOPER D G,et al.Ionic channels induced by surfactin in planar lipid bilayer membranes[J].Biochim Biophys Acta,1991,1064(1):13-23.
[26]HUAZ Z,CHEN I,LUN S Y.Influence of biosurfactants produced by Candida Antarctica on surface properties of microorganism and biodegradation of n-alkanes[J].Water Res,2003,37(17):4143-4150.○
