不同预处理的木薯渣水解液生物酸化特性比较
2011-12-24王菁韩刚于晓艳吕学斌张书廷
王菁,韩刚,于晓艳,吕学斌* ,张书廷
1.天津大学环境科学与工程学院,天津 300072
2.天津大学化工学院,天津 300072
木薯在我国南方大部分地区是一种重要的制取淀粉的原料,木薯渣是木薯提取淀粉后渣与工艺废水的混合物经机械脱水后得到的残渣。这种副产物在全国每年约有9.25万t(干物质)[1],如弃之不仅造成资源浪费,还严重污染环境。木薯渣的主要成分为碳水化合物,包括淀粉(66%)、纤维素(21%)、半纤维素(7%)以及蛋白质(4%)[2],因此木薯渣的资源化利用具有重要意义。目前木薯渣主要用做饲料[3],此外也用于生产单细胞蛋白、柠檬酸、建材以及与木薯杆混合共同培养黑木耳和食用菌等[1,4-8]。但其用量有限,所以开发其大宗的利用途径显得尤为重要。
由于木薯渣中淀粉的颗粒结构及其结晶组织、木质素和纤维素的包裹作用对生物降解具有一定的抑制作用[9-10],将其投入厌氧反应器直接进行水解酸化会极大降低发酵效率,增加运行能耗[11]。因此如果将木薯渣固相中微生物可利用基质转移到液相中进行可溶化,使半纤维素、纤维素水解为低聚糖或单糖,不仅可以增强淀粉溶解性和流动性,降低黏性[12],而且可提高生物的降解效率。笔者通过采用高温水热法和酶解法对木薯渣进行可溶化预处理,将木薯渣中的碳水化合物转移到液相水解液中,探索不同的预处理条件对木薯渣水解液的生物酸化特性的影响,以期为提高实际工程应用提供理论依据和借鉴。
1 材料与方法
1.1 材料
1.1.1 木薯渣水解液
木薯渣由广西必佳微生物工程有限公司提供。为了更好地对比不同预处理方式对木薯渣水解液生物酸化效果的影响,选择150℃下用蒸馏水水解20和45 min;α-淀粉酶水解3 h。另外,以未处理的木薯渣进行水解酸化作为对照。
木薯渣高温水解及酶水解时的固液比为1∶14。其中酶水解法中α-淀粉酶的添加量为8 U/g(以干渣计),用氨水调节pH至6.0~6.5,在80℃水浴和搅拌条件下水解3 h。不同水解液的性质如表1所示。
1.1.2 污泥的驯化
污泥取自天津市纪庄子污水处理厂A2/O工艺的剩余污泥,pH为7.10,氧化还原电位(ORP)为-207 mV。分别取800 mL污泥置于4个1 L的广口瓶中,在36℃水浴及搅拌条件下厌氧培养,每天投加30 mL营养液,营养液为人工模拟生活污水。营养液的配制方案[13]:配水的 SCODCr约为 400 mg/L;为了使微生物适应木薯淀粉,采用可溶性淀粉作为碳源,浓度为 340 mg/L;常量元素有CaCl2·2H2O 30mg/L,MgSO4·7H2O 25mg/L,FeSO4·7H2O 20 mg/L;微量元素(储备液,使用时取1 mL稀释到1000 mL)有H3BO350 mg/L,ZnCl250 mg/L,CuCl230mg/L,MnSO4·H2O 50mg/L,(NH4)6MoO24·H2O 50 mg/L,AlCl350mg/L,CoCl2·H2O 50 mg/L;同时为减少蛋白质对水解酸化pH的中和作用,不添加氮源;另外培养时间较短,微生物对磷源的需求较少,因此也不添加磷源。
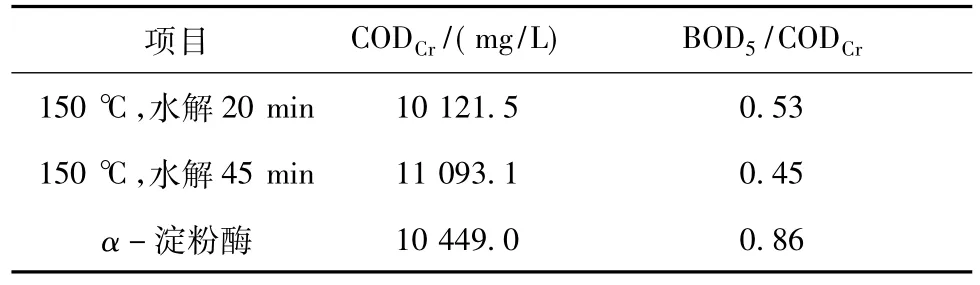
表1 水解液性质Table 1 Characteristics of hydrolysate
污泥经过5 d左右的驯化培养,其pH稳定在6.7~6.8,ORP为-280~-260 mV。将驯化好的污泥保存在4℃冰箱里,使用前在36℃下活化1 d,活化后污泥的性质如表2所示。
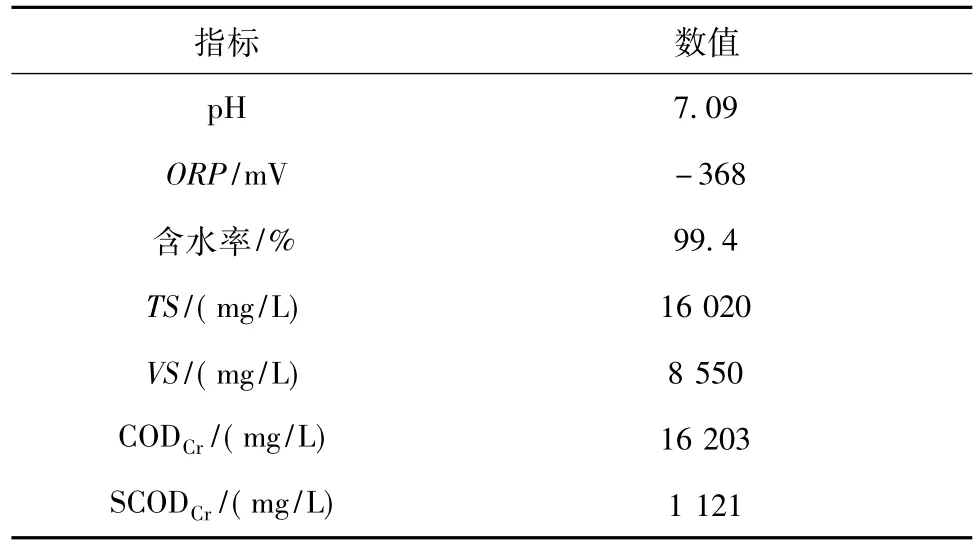
表2 污泥性质Table 2 Characteristic of sludge domesticated
1.2 方法
木薯渣水解液生物酸化的试验装置如图1所示。将驯化后的污泥重新混匀,分别置于4个广口瓶中,每瓶取泥600 mL。接种泥与水解液体积比为3∶1,一次性向4个瓶中分别加入不同的水解液200 mL(原水解液体积不足的用蒸馏水补足),此时投加的4种水解液SCODCr均为3000 mg/L,有机负荷为0.47 g/g(以SCODCr计)。4组不同预处理木薯渣水解液的水解酸化方式:①投加木薯渣9.02 g作为对照;②投加酶水解液47.9 mL;③投加150℃水解液51.9 mL,水解20 min;④投加150℃水解液47.3 mL,水解45 min。水解酸化过程中定期取样监测,取样体积为30 mL。
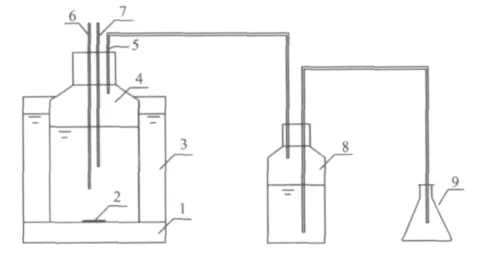
图1 厌氧水解酸化试验装置Fig.1 Experimental set-up of anaerobic hydrolysis acidification
1.3 分析方法
污泥总固体(TS),105℃干燥恒重法;总挥发性固体(VS),600℃灼烧恒重法;化学需氧量(SCODCr),重铬酸钾消解法(KDB-III型COD微波消解仪);pH,采用pH计(雷磁pHS-3C型)精确测定;ORP,采用 ORP计(METTLER TOLEDO FE20型)测定。挥发性脂肪酸(VFAs):采用Lab Alliance高效液相色谱仪,色谱柱为BioRad Aminex HPX-87H(300 mm×7.8 mm),RI示差检测器,色谱条件:柱温65℃,流动相为5 mmol/L H2SO4溶液,流速为 0.6 mL/min,进样量为 20 μL。
2 结果与讨论
2.1 pH变化
图2显示木薯渣水解液在酸化过程中pH的变化。由图2可知,4组水解液在酸化过程中的pH均呈先下降后上升的趋势。在水解酸化初期,由于微生物对颗粒状木薯淀粉或低聚糖等有机大分子的水解及产酸作用,污泥中产生大量的挥发性脂肪酸,使得pH下降。一段时间后,一方面由于污泥中蛋白质逐渐分解形成氨氮,与污泥中的脂肪酸中和;另一方面,微生物消耗了脂肪酸,因此pH会上升。
图2显示,投加水解液的3组pH下降较快,在12 h时pH均降到最低值5.5;而只投加木薯渣的pH下降较慢,在60 h时pH达到最低值5.7。这一结果表明,经水解处理后木薯淀粉溶于水中有利于微生物的利用。12 h后,投加水解液的3组pH开始回升,这可能是由于污泥中氨氮的中和作用;之后由于氨氮的中和速率与产酸速率相等,因此pH在一段时期内较为稳定,但稳定期长短不相同。投加150℃水解液水解45 min的水解酸化,由于水解液中可生化利用的有机质即BOD5相对较低,因而产酸量较少,加上其他微生物(非产甲烷菌)对脂肪酸的消耗,所以pH上升较快;而投加酶水解液及150℃水解液水解20 min的水解酸化由于可生化利用的有机质相对较多,因此pH回升较为缓慢。另外,由于水解酸化时间较长,污泥中可能会有部分微生物死亡,死亡后细胞破裂,其中的蛋白质释放出来又被其他细胞分解为氨氮,这部分氨氮又与挥发性脂肪酸中和加速了后期pH的上升。
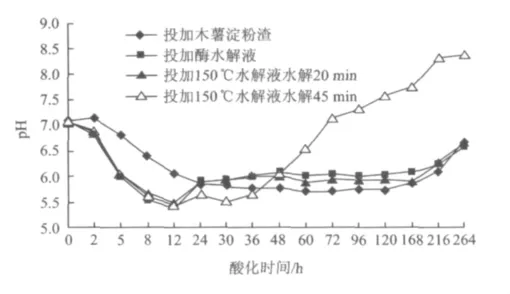
图2 水解酸化过程中pH随时间的变化Fig.2 Variation of pH with time during anaerobic hydrolysis acidification
2.2 ORP的变化
ORP是厌氧消化过程中另一个重要的影响因子,体系中的 ORP能够反映发酵液所处的厌氧状态[14-15]。
图3显示木薯渣水解液在酸化过程中ORP的变化。从图3可见,整个水解酸化过程中ORP与pH的变化呈一定的相关性:30 h前,ORP呈逐渐升高的趋势,与 pH的变化正好相反;30~168 h时ORP与pH均基本保持稳定;168 h后,ORP表现出一定的下降趋势,pH呈逐渐上升趋势。pH与ORP的变化关系与李刚等[16]提到的趋势相同。但有个别时间段ORP与pH并未表现出这样的关系,这可能与试验误差、污泥种类及挥发性脂肪酸浓度和种类不同有关。
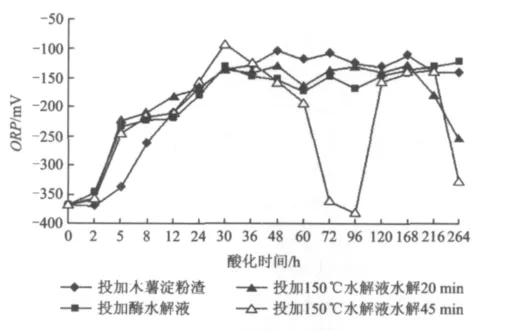
图3 水解酸化过程中ORP随时间的变化Fig.3 Variation of ORP with time during anaerobic hydrolysis acidification
2.3 VFAs的变化
图4显示木薯渣水解液在酸化过程中VFAs的变化。由于乙酸、丙酸、正丁酸峰面积占总峰面积的90%以上,因此这里VFAs只考虑以上3种。
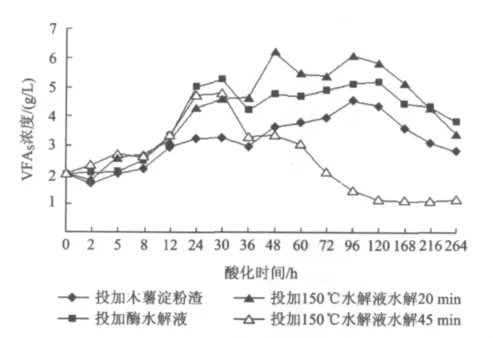
图4 水解酸化过程中VFAs浓度随时间的变化Fig.4 Variation of total VFAs with time during anaerobic hydrolysis acidification
从图4可以看出,4种水解酸化方式的VFAs均呈先上升后下降的趋势。投加150℃水解液水解45 min的水解酸化VFAs浓度在24 h时达到最大值(4734 mg/L),之后迅速下降;投加酶水解液及150℃水解液水解20 min的水解酸化VFAs浓度分别于30和48 h时达到最大值(5277和6209 mg/L);而木薯渣水解酸化的VFAs浓度在96 h时达到最大值(4558 mg/L)。可见木薯渣水解酸化产生的VFAs最少,而投加150℃水解液水解20 min的最大产酸量较150℃水解液水解45 min的多1475 mg/L,且达到最大产酸量的时间要晚24 h,说明150℃水解液水解20 min可供水解酸化菌利用的有机质较多,在相同微生物量的情况下,达到最大产酸量所需时间也较长;同时由于150℃水解液水解45 min后含有糖类降解产物糠醛等副产物,这些副产物不能被微生物所利用,因而产酸量相对较低[17];同时发酵液由于pH的升高(结合图2)消耗掉一部分挥发性脂肪酸,造成150℃水解液水解45 min酸化后期VFAs减小。通过对比可以发现,固相木薯渣有机质的可溶化性有利于后续水解酸化VFAs的产生,同时水解液的可生化性(BOD5)越高,越有利于水解酸化。
2.4 挥发酸的分布
由于产甲烷菌只能利用乙酸进行厌氧发酵,丙酸和丁酸等长链脂肪酸需由产氢产乙酸菌转化为乙酸后才可以被产甲烷菌利用,其中,丁酸转化为乙酸较丙酸快,即乙酸和丁酸浓度越高,其发酵产甲烷的效率就会越高[18]。因此考察不同木薯渣水解液的水解酸化过程中VFAs的分布是非常重要的。
图5显示4种水解酸化方式下挥发酸的分布。从图5看出,整个酸化过程所产生的挥发性脂肪酸以乙酸和正丁酸为主,二者之和占VFAs的70%以上,其中乙酸比例呈先缓慢增加后减少的趋势,正丁酸比例则表现出后期增大的趋势。而丙酸比例较低,只占VFAs的10%~30%,其浓度均小于1100 mg/L。
由图5(a)可见,投加木薯渣污泥水解酸化产生的乙酸和正丁酸之和占VFAs的80%左右,而丙酸比例基本保持在17%~24%,整个酸化过程中木薯渣的水解酸化表现为乙醇型发酵。由图5(b)(c)可见,投加酶水解液和150℃水解液水解20 min产生的乙酸和正丁酸之和占VFAs的90%左右;随着酸化时间的延长,丙酸比例逐渐降低,在水解24 h时丙酸比例减小到总VFAs的10%,这2种水解液的酸化方式从24 h开始表现为丁酸型发酵。图5(d)可见,投加150℃水解液水解45 min产生的乙酸和正丁酸之和占VFAs的70%~90%,该值在24 h时达到最大值90%;随后水解酸化中产生的丙酸比例逐渐增加,到水解酸化96 h时开始发生丁酸型发酵。因此,除投加木薯渣的水解酸化外,其余3种酸化方式均在24 h达到较好的挥发酸分布,且乙酸和正丁酸之和均占VFAs的90%左右。
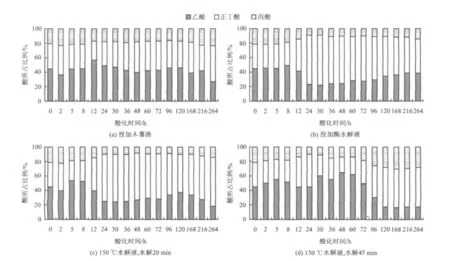
图5 水解酸化过程中各种酸所占比例随时间的变化Fig.5 Variation of VFAs distribution with time during anaerobic hydrolysis acidification
3 结论
(1)投加不同物料酸化液的pH呈先降低再升高的趋势,而产生的VFAs则呈先升高再降低的趋势,pH和VFAs呈此消彼长的规律,因此可以通过检测酸化液的pH来判断产酸量的变化情况。
(2)木薯渣可以直接进行酸化发酵,但其产酸速度比水解液慢。投加木薯渣的酸化泥在96 h达到最大产酸量(4558 mg/L),而投加150℃水解液水解45 min,酶水解及150℃水解液水解20 min条件下木薯渣水解液的酸化泥分别于24,30和48 h达到最大产酸量(4734,5277和6209 mg/L)。
(3)挥发酸的分布与物料有关。投加木薯渣的酸化泥的发酵类型主要表现为乙醇型发酵,而投加150℃水解液水解20 min,150℃水解液水解45 min和酶水解条件下水解液的酸化泥的发酵类型则表现为丁酸型发酵。此外,随着发酵时间的延长,150℃水解液水解20 min和酶水解条件下产生的挥发酸中丙酸比例逐渐减少,而木薯渣和150℃水解液水解45 min产生的挥发酸中丙酸比例相对较高。由于丙酸的累积不利于后续产甲烷过程的顺利进行,且考虑到产酸量的高低,故确定150℃水解液水解20 min更适合作为产酸发酵液。
[1]陈桂光,庞宗文,梁静娟.木薯渣生料发酵生产单细胞蛋白的研究[J].粮食与饲料工业,1997(6):23-24.
[2]浦跃武,刘坚.木薯渣厌氧发酵制取沼气的研究[J].安徽农业科学,2009,37(29):14308-14310.
[3]SRIHERWANTO C,KOOB C,BISPING B.Cassava bagasse fermented by Rhizopus spp.for potential use as animal feed[J].New Biotechnology,2009,25(Supple1):S289.
[4]贠建民,刘陇生,安志刚,等.马铃薯淀粉渣生料多菌种固态发酵生产蛋白饲料工艺[J].农业工程学报,2010,26(Supple2):399-404.
[5]洪葵,刘四新,雷雄飞,等.木薯渣发酵柠檬酸研究初报[J].热带农业科学,1996(1):23-26.
[6]应向东.木薯渣刨花板的研制[J].建筑人造板,1999(2):24-27.
[7]苏启苞.木薯杆(渣)栽培黑木耳关键技术[J].食用菌,2008(3):36-38.
[8]苏启苞.木薯杆屑、木薯渣栽培杏鲍菇的研究[J].中国食用菌,2007,26(3):22-23.
[9]何永梅,王艳锦,肖烈,等.木质纤维原料厌氧发酵工艺研究进展[J].可再生能源,2009,27(5):55-60.
[10]SHAWN D M,CAINTRIONA M,JOHN N S.Substrate and enzyme characteristics that limit cellulose hydrolysis[J].Biotechnology Progress,1999,15(5):804-816.
[11]杨世关,李继红,孟卓,等.木质纤维素原料厌氧生物降解研究进展[J].农业工程学报,2006,22(Supple1):120-124.
[12]JANE J L,CHEN J F.Effect of amylose molecular size and amylopectin branch chain length on paste properties of starch[J].Cereal Chemistry,1992,69(1):60-65.
[13]TAY J H,LIU Q S,LIU Y.Microscopic observation of aerobic granulation in sequential aerobic sludge blanket reactor[J].J Applied Microbiology,2001,91(1):168-175.
[14]李建政,任南琪.产酸相最佳发酵类型工程控制对策[J].中国环境科学,1998,18(5):398-402.
[15]任南琪.产酸发酵细菌演替规律研究[J].哈尔滨建筑大学学报,1999,32(2):29-34.
[16]李刚,杨立中,欧阳峰.厌氧消化过程控制因素及pH和Eh的影响分析[J].西南交通大学学报,2001,36(5):518-521.
[17]ZHANG R,LU X B,SUN Y S,et al.Modeling and optimization of dilute nitric acid hydrolysis on corn stover[J].J Chemical Technology and Biotechnology,2011,86(2):306-314.
[18]任南琪,王爱杰,马放.产酸发酵微生物生理生态学[M].北京:科学出版社,2005:22-23.▷
