有机质腐解对穗花狐尾藻生长及生理的影响
2011-12-21易文利王圣瑞杨苏文金相灿王国栋宝鸡文理学院灾害监测与机理模拟陕西省重点实验室陕西宝鸡7101中国环境科学研究院湖泊生态环境创新基地国家环境保护湖泊污染控制重点实验室环境基准与风险评估国家重点实验室北京10001西北农林科技大学理学院陕西杨凌71100
易文利,王圣瑞,杨苏文,金相灿,王国栋 (1.宝鸡文理学院,灾害监测与机理模拟陕西省重点实验室,陕西 宝鸡 7101;.中国环境科学研究院,湖泊生态环境创新基地/国家环境保护湖泊污染控制重点实验室,环境基准与风险评估国家重点实验室,北京 10001;.西北农林科技大学理学院,陕西 杨凌 71100)
有机质腐解对穗花狐尾藻生长及生理的影响
易文利1,2,王圣瑞2*,杨苏文2,金相灿2,王国栋3(1.宝鸡文理学院,灾害监测与机理模拟陕西省重点实验室,陕西 宝鸡 721013;2.中国环境科学研究院,湖泊生态环境创新基地/国家环境保护湖泊污染控制重点实验室,环境基准与风险评估国家重点实验室,北京 100012;3.西北农林科技大学理学院,陕西 杨凌 712100)
以原沉积物和分别添加0.5%与1%有机质(植物残体)的沉积物作为底质培养沉水植物,采用室内模拟实验研究了有机质的腐解过程对穗花狐尾藻生长及生理作用的影响.结果表明,在试验的早期阶段,有机质的腐解对狐尾藻的生长有一定的抑制,但在整个培养阶段,与原沉积物组相比,0.5%有机质的加入,在一定程度上可促进植株生长, 狐尾藻生物量和根系生物量平均增加了12.99%和125.31%,而1%有机质的加入,狐尾藻生长受到抑制.在培养的前 16d,有机质的添加抑制了沉水植物狐尾藻叶绿素和可溶性蛋白含量的增加,在培养中后期,0.5%有机质的加入,可促进植株体内可溶性蛋白和叶绿素含量的积累.0.5%有机质添加条件下, 超氧化物歧化酶(SOD)活性持续升高,添加1%有机质和较长时间处理时,狐尾藻抗氧化酶系统活性先升高后降低. 在培养前期,1%有机质添加组植株丙二醛(MDA)含量比原沉积物组提高了20.13%,但与0.5%组差异不显著,即低浓度有机质的增加能促进狐尾藻生长及生理代谢,但随着有机质增加量的升高对狐尾藻的生理活动将产生不利影响.
有机质;穗花狐尾藻;生长;生理作用
目前,恢复和重建水生植被的生态修复方法已成为湖泊修复的重要途径[1].沉水植物是湖泊生态系统中的初级生产者,不仅在生态平衡和水质保护方面具有重要作用,而且是湖泊生态系统营养循环的关键性环节,通过植物自身对碳、氮、磷等营养元素的吸收同化、收获输出、沉积输出等过程调节水体营养平衡[2-3].但当水生植物腐烂分解后,植物体内大量的有机质和营养物质转移至沉积物和周边环境储存,对水体环境状况具有很大的影响.因此在研究湖泊沉积物中有机质的生物地球化学特征和物质迁移过程中,植物降解过程的研究无疑成为其中十分重要的一环.各国学者围绕植物在湿地/湖泊生态系统中的分解已经开展了大量的工作[4-9],但主要集中在不同的水体营养盐浓度、环境条件对水生植物腐烂分解过程的影响,而对衰亡期水生植物分解过程对沉水植物生长及生理特征影响研究较少.因此本研究通过在底质中外加植物残体培养穗花狐尾藻,模拟湖泊水生植物腐烂分解过程对穗花狐尾藻生长及生理影响,以期为定量评价沉水植物在淡水湖泊生物地球化学循环中的作用、及对沉水植物在富营养化湖泊中的消亡机制及湖泊植被恢复实践提供一定的理论参考.
1 材料与方法
1.1 供试植物与实验设计
沉积物取自北京玉渊潭,自然风干后用重物捣碎,过 0.5mm的细筛多次,混匀去除杂质,使沉积物理化性质均匀一致.沉水植物穗花狐尾藻取自北京房山区拒马河附近,在温室内预培养 7d,选取长势一致的健康顶枝(长 10cm).供试植物残体选用芦苇的茎叶混合物,65℃烘干,研磨过0.25mm筛.试验底质设为3个处理:处理1:原沉积物;处理2:沉积物+0.5%(占沉积物干质量)干植物残体;处理3:沉积物+1%的干植物残体.各处理基本理化指标见表1.
试验设 6个试验组,每组在 70cm×35cm× 40cm的玻璃缸内设 14个 PVC小桶(高×直径=10cm×8cm,上底面积103.8cm2,体积600mL),每桶装500g底质.其中3组底质培养穗花狐尾藻,每桶扦插种植6株.另设3组为对照(CK)不栽培穗花狐尾藻.每个试验组重复2次.用自来水培养,玻璃缸定期补充培养水.模拟实验在中国环境科学研究院可控温室内进行.光照为温室内自然光照,温度控制在 20~30℃.自培养之日起分别在培养的第 7,16,22,29,36,43,50d测定不同试验组水体的DO、pH值、温度并采集不同试验组上覆水、沉积物、植物样品.上覆水样采集水面下10cm处,用于分析总磷及各形态磷、总氮及各形态氮浓度和水体总有机碳;沉积物和植物样品每次各组随机取2桶,用于分析沉积物不同形态磷,植物样鲜重、干重及生理指标.
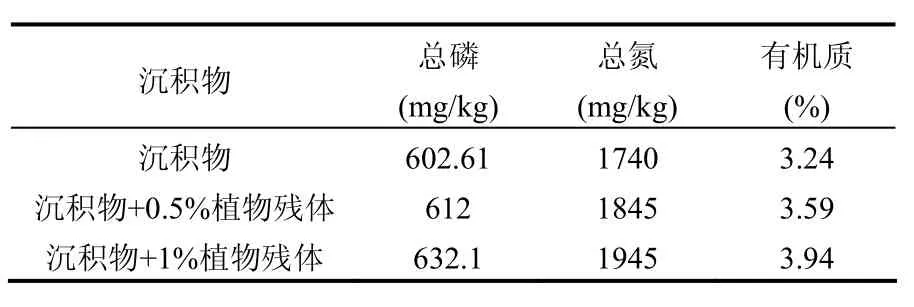
表1 不同处理沉积物营养盐指标Table 1 Content of nutritive matter of tested sediment
1.2 分析方法
沉积物总氮采用开氏消煮法[10]测定,有机质采用重铬酸钾-外加热法[10]测定,总磷及各形态磷测定采用SMT法[11]测定.上覆水TP采用过硫酸钾氧化法[12].每次取样后的小桶用自来水冲去底泥,洗去吸附在植物表面的杂质,再用去离子水冲洗2~3次,用滤纸吸干植物表面水分,分根、茎、叶测定鲜重,取部分鲜样105℃杀青2h后,80℃恒温箱内烘干至恒重,测定干物质量.另取部分鲜样参照文献[13]测定植物体叶绿素含量,可溶性蛋白(Pro),丙二醛(MDA),超氧化物歧化酶(SOD).每个样品均重复测定3次.
1.3 数据分析方法
采用SPSS11.5软件对不同处理间的数据进行方差分析和显著性检验,其中显著性差异 P<0.05.所有实验结果为3次重复测定的平均值.
2 结果与分析
2.1 有机质腐解对狐尾藻生长的影响
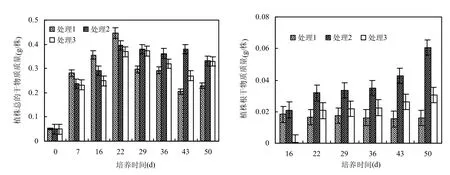
图1 沉水植物穗花狐尾藻生物量与根重随培养时间的变化Fig.1 Changes of biomass and root biomass with culturing time
2.1.1 有机质腐解对狐尾藻生物量的影响 生物量是反映植物生长状态的重要指标,同时对沉水植物净化水体的能力具有重要的影响[14-15].添加不同植物残体的沉积物培养的穗花狐尾藻生物量累积变化如图1所示.随着培养时间的延长各处理狐尾藻干物质质量呈“抛物线”型变化,且在培养的第22d达到最大值,各处理干物质质量分别为 0.05~0.446,0.05~0.396,0.05~0.373g/株,在培养的前 22d植株总生物量大小顺序为处理 1>处理 2>处理 3,在培养中后期植株生物量大小顺序为处理2>处理3>处理1.在培养的43d后,处理2穗花狐尾藻开始腐烂,处理1和处理3在培养的36d开始腐烂,但处理2狐尾藻衰亡速率较慢,开始衰亡后8d仍有部分绿叶,而处理1和处理3衰亡速率较快,在开始衰亡后14d左右就很少见绿叶.ANOVA处理结果显示,不同处理穗花狐尾藻在培养中后期(22d后)生物量的累积差异显著(P<0.05).根系是沉水植物吸收营养物质的途径之一.本研究在植株萌发初期,3个处理根系生物量较低(其中处理3植物的根系在前16d受到损伤,发黑腐烂不能萌发),之后,随着植物光合作用形成的有机物质开始向根系转移,22d后根系生物量逐渐增大,依次为处理 2>处理 3>处理 1,最大值分别为0.061,0.030,0.017g/株(图1).方差处理结果显示,不同处理根生物量差异显著(P<0.05).同时本实验中穗花狐尾藻根系是扦插生成的,说明添加植物残体的腐解对狐尾藻根系影响显著.在整个培养期,适量植物残体的残留(0.5%)使狐尾藻生物量和根系生物量平均增加了12.99%和125.31%.
2.1.2 有机质腐解对狐尾藻根系形态的影响 穗花狐尾藻是根系较为发达的沉水植物[16],根系是吸收养分的重要器官,不同处理狐尾藻根系参数见图2.由图2可知,主根平均根长随培养时间的延长,各处理均呈先升高后降低趋势,处理1、处理2及处理3主根平均根长分别为1.84~ 13.21cm、0~13.12cm、0~9.43cm.在培养的前22d,狐尾藻主根平均根长有处理1>处理2>处理3.在培养中后期,处理2主根平均根长比处理1增加了10.29%,处理3比处理1降低了12.63%.通过ANOVA分析可知,不同处理间植株主根平均根长有显著的差异(P<0.05).不同处理根系体积在培养前16d,处理1远远大于处理2和处理3,且在整个培养期,呈先上升后降低的趋势,而处理 2和处理3根系体积呈直线上升的趋势,分别是处理1组的1.85和1.47倍.通过ANOVA分析可知,不同处理间根系体积有显著差异(P<0.05).
2.2 有机质腐解对狐尾藻叶绿素和蛋白质含量的影响
从图3可见,随着有机质的加入,在培养的前16d狐尾藻中叶绿素总量逐渐降低,在培养的第7d,处理1狐尾藻中叶绿素含量最高(3.34mg/g,以鲜重计),分别是处理2和处理3的1.26和1.31倍.在培养的22~36d期间,处理1狐尾藻体内叶绿素含量持续降低,而处理2组叶绿素含量逐渐增加,且高于处理1和处理3,处理3组比较平稳,在培养的43d后,随着狐尾藻的衰亡,3个处理组叶绿素含量都逐渐降低.且处理3组叶绿素含量在整个培养期都低于对照组.
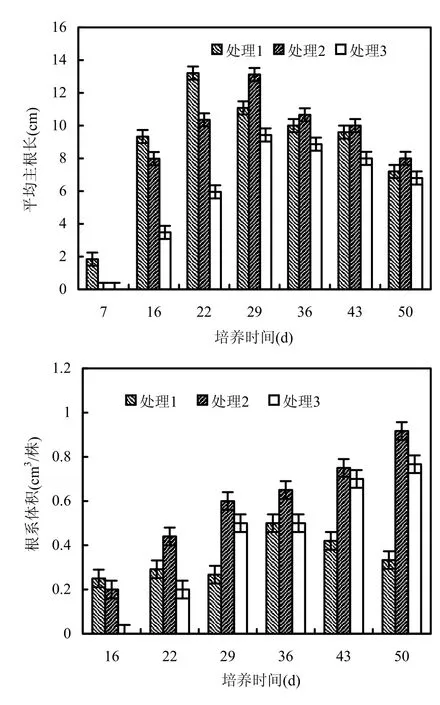
图2 沉水植物狐尾藻根系平均主根长和根系体积随培养时间的变化Fig.2 Changes of root length and root volume of Myriophyllum spicatum with culturing time
由图4可知,随着培养时间的延长,处理1植物组织中可溶性蛋白含量呈先升后降趋势,处理2和处理3大体呈先下降再上升后再下降的趋势.在培养的前 16d,3个处理植物组织中可溶性蛋白含量为处理1>处理2>处理3,三者差异显著(P<0.05).在培养的中后期,随着培养时间的延长,处理2和处理3植株体内可溶性蛋白的含量逐渐增加,且处理2>处理3>处理1,三者差异极显著(P<0.01).
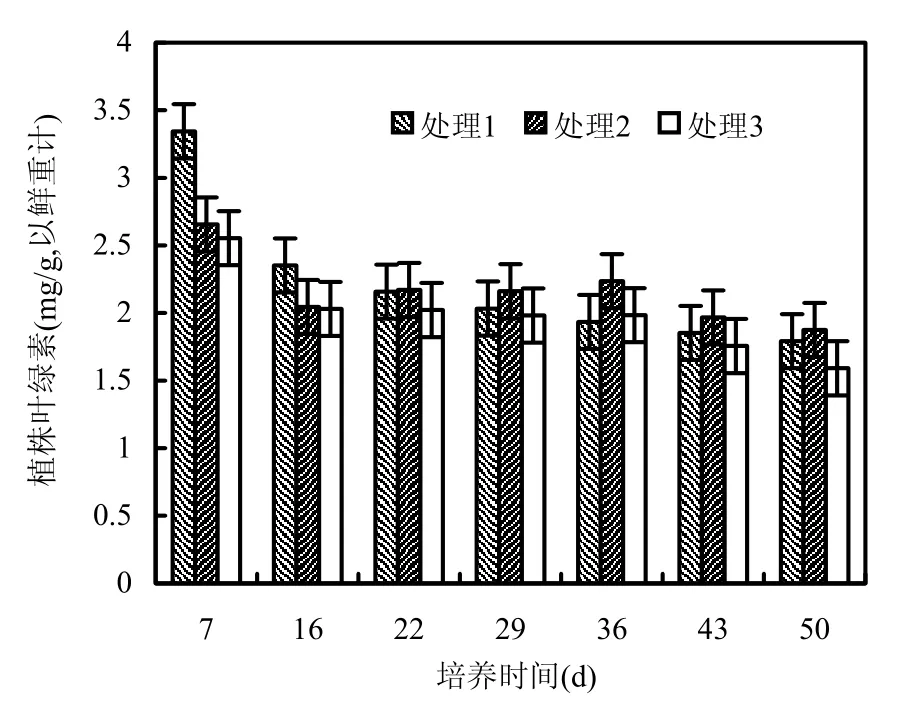
图3 狐尾藻体内叶绿素含量随培养时间的变化Fig.3 Changes of chlorophyll contents of Myriophyllum spicatum with culturing time
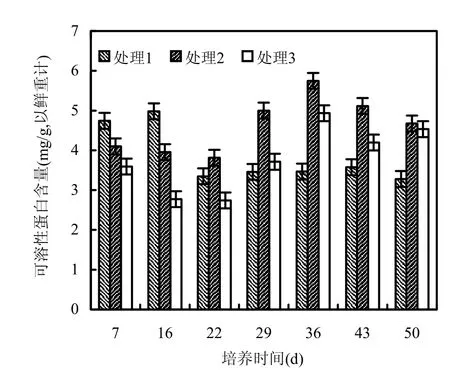
图4 狐尾藻体内可溶性蛋白含量随培养时间的变化Fig.4 Changes of protein contents of Myriophyllum spicatum with culturing time
2.3 有机质腐解对狐尾藻抗氧化酶系统的影响
超氧化物歧化酶(SOD)是生物机体防御过氧化损伤系统的关键酶之一,是一类敏感的分子生态毒理学指标[17].从图5可知,随着有机质添加量的增高,狐尾藻 SOD活性呈现上升趋势,同时随着培养时间的延长,处理1组狐尾藻SOD活性呈波浪式变化,处理3组的狐尾藻SOD活性均表现为先升高后降低,处理2组狐尾藻体内SOD活性呈升高趋势.在培养的前22d,1%有机质添加组(处理3)SOD活性的平均值是处理2和处理1组的 1.32和 1.44倍,且与处理 1有显著性差异(P<0.05),而浓度较低组(处理2)SOD活性接近对照组,差异不显著(P>0.05).随着培养时间的延长,3个处理组SOD活性均升高,处理2和处理3组显著高于处理1组.第43d后,0.5%添加组SOD活性继续上升,但变化幅度不大,而处理1和处理3 SOD活性则降低,3者差异不显著(P>0.05).在整个培养期,处理3组SOD比处理1组平均增加了28.47%,比处理2增加了15.48%,而处理2组SOD仅比处理1增加了11.25%.
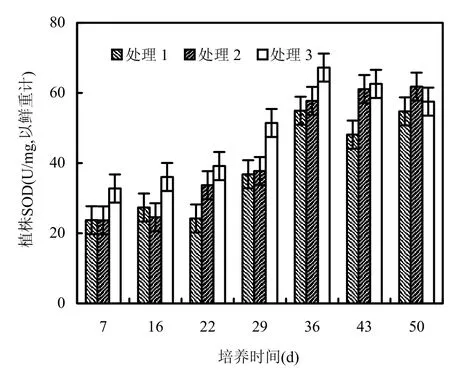
图5 狐尾藻体内超氧化物歧化酶含量随培养时间的变化Fig.5 Changes of SOD contents of Myriophyllum spicatum with culturing time
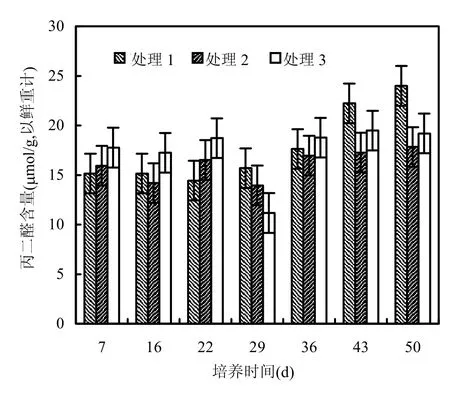
图6 狐尾藻体内丙二醛含量的变化Fig.6 Changes of MDA contents of Myriophyllum spicatum with culturing time
丙二醛(MDA)是植物膜脂过氧化的主要产物,其含量直接反映膜脂过氧化程度[18].图6表明,在培养的前 22d,1%有机质添加组(处理 3)MDA活性高于处理2和处理1,分别增加了15.19%和20.13%,且与处理 1有显著性差异(P<0.05),而浓度较低组(处理2)MDA活性与处理1差异不显著(P>0.05).在培养 36d后,由于植物衰亡,处理1MDA含量有所增加,但处理2和处理3变化不明显,三者差异不显著(P>0.05).
3 讨论
水生植物是水生生态系统的重要组成部分,具有净化水质、提高水体透明度、增加水体中溶解氧、抑制藻类生长的功能,可为水生动物提供栖息生境和繁衍场所,对生态系统的物质、能量循环具有重要调控作用,是健康水生生态系统的主要维持者[19].但当水生植物腐烂,水质在短期内会发生变化,使水生植物的生长受到巨大影响,甚至使水生植被受到灭顶之灾.有研究显示[20],在热带富营养湖泊内,凤眼莲腐烂分解过程中,浮游植物的多样性和生产率有显著降低.李敦海等
[21]研究表明,丝状绿藻腐烂过程中,水体的溶解氧(DO)、pH值、水下光强度与水面光强度的比值均比对照组大大降低,沉水植物黑藻亦慢慢腐烂,最后消失.本研究的结果也表明,植物残体在腐解前期,水体的pH值和DO浓度较对照组急剧下降,使水体处于厌氧水平,同时水体透明度较低,水下光照强度减弱,而在培养16d后,由于沉水植物对水体的净化作用,水体的pH值、DO有所升高,透明度升高,植物残体腐解所造成的厌氧胁迫有所减缓,同时由于植物残体的腐解,水体中TP、铵态氮急剧升高(本实验组未发表的数据),而过高的营养盐浓度,又可能对环境产生了一定的营养胁迫,从而抑制沉水植物的生长.植物残体添加量越多,水体的厌氧程度和营养盐含量也越大.在本研究中,植株萌发的初期,投加 0.5%有机质、短时间内狐尾藻根系由于厌氧环境而受到一定抑制,但很快恢复生长,且中后期可利用的营养盐浓度较低,又促进根系生长(图 2),从而促进了植株的生长;而 1%有机质的加入,水体厌氧程度较0.5%组高,使得根系在培养的前16d受到损伤,根系发黑腐烂不能萌发,随着时间的延长,虽然根系逐渐适应环境变化,出现较多须根,根系体积有所升高,但后期水体较高的碳氮磷营养对植株的生长造成了一定的营养胁迫,植株体颜色逐渐发暗、衰败,从而影响植株生长,生物量较低.
光合作用是植物体内极为重要的代谢过程,其强弱对植物生长及抗逆性具有十分重要的影响,叶绿素含量的高低在很大程度上反映了植株的生长状况和光合作用[22].环境胁迫可使叶绿素含量降低[23].本研究中,狐尾藻体内叶绿素含量在不同时期,不同处理下均不同.1%有机质投加但叶绿素含量始终低于对照组;而 0.5%有机质投加的处理,在试验的前期,由于植物残体的腐解,造成的厌氧环境和水体透明度的降低影响了植株的光合作用,抑制了狐尾藻体内叶绿素含量的增加,但在培养的中后期,由于狐尾藻生长对水体环境的净化,可观察到水体透明度逐渐升高,狐尾藻能很好地生长,因而其叶绿素含量又高于其他处理组.植物体内的可溶性蛋白质大多数是参与各种代谢的酶类,测其含量是了解植物体总代谢的一个重要指标.一般说来,外界环境的胁迫可影响植株蛋白质合成,导致植物体内可溶性蛋白的分解.有研究表明,较低的底泥厌氧环境有利于底泥中营养元素生物可利用性的提高,促进有根沉水植物的生理代谢[24].这也可能是本实验0.5%有机质添加处理组在培养中后期蛋白质含量较高、使叶绿素和蛋白质含量都呈现“拱形”的原因.
超氧化物歧化酶(SOD)是机体细胞抵御氧化损伤最重要的酶类之一,植物正常代谢过程和在各种环境胁迫下均能产生活性氧和自由基,活性氧和自由基的积累引起细胞结构的破坏,SOD的主要功能是清除体内有氧代谢所产生的超氧自由基(O2.-),是活性氧清除系统中第一个发挥作用的抗氧化酶[25].本研究的结果表明,狐尾藻体内的抗氧化酶对有机质腐解所造成的环境胁迫做出了敏感的响应.0.5%有机质的添加组,SOD活性持续升高,狐尾藻对该浓度残留的有机质的腐解环境具有一定的耐受能力,可以调动体内的酶系统对环境胁迫产生响应,对机体形成保护.而1%有机质添加组,SOD活性先升高后降低,高浓度组有机质腐解所造成的环境胁迫使得狐尾藻体内氧自由基大量积累,最终对抗氧化酶系统形成了一定的伤害.植物器官在逆境条件下,往往发生膜脂过氧化作用,MDA 是其产物之一.MDA含量升高通常是植物脂膜发生严重过氧化损伤的标志,间接地表示膜受损情况.在自然条件下,植物可通过酶促和非酶促反映使细胞内活性氧自由基的产生和消除处于平稳状态,不易导致膜脂化.然而,当植物遭受到严重逆环境胁迫时,细胞内活性氧自由基逐渐积累,从而促使膜脂过氧化,造成细胞膜系统的损伤,干扰植物细胞的光和、呼吸及其他代谢过程,严重时导致植物细胞死亡[26-27].本研究中,在有机质腐解的环境胁迫下,MDA 含量也增多,但在培养的前22d, 0.5%有机质投加组与对照组差异不显著(P>0.05),可能是因为穗花狐尾藻具有较强的抗逆性和适应能力,而1%有机质添加组MDA含量显著高于其他处理,植物细胞膜受损.因此在沉水植被恢复与重建中要注意必须控制沉水植物的残留生物量,充分加以利用,并在适当的时间加以收割以避免过多的植物残体在适当的时候造成水体缺氧而恶化水质,进而影响水生植物的生长.
4 结论
4.1 0.5%有机质的加入可以促使狐尾藻生长和根系生长.
4.2 有机质的添加,在试验的初期抑制了狐尾藻体内叶绿素和蛋白质含量的增加,但随着处理时间延长,0.5%有机质投加组可促进叶绿素和蛋白质含量的积累.而 1%有机质的残留,抑制了叶绿素和蛋白质的合成.
4.3 0.5%有机质的添加组,SOD活性持续升高,说明狐尾藻对该浓度残留的有机质的腐解环境具有一定的耐受能力,而 1%有机质添加组,随培养时间的延长,SOD活性先升高后降低,说明高浓度组有机质腐解所造成的环境胁迫使得狐尾藻体内氧自由基大量积累,最终对抗氧化酶系统形成了一定的伤害,使得MDA有所增加,在培养前期表现明显.
[1] 颜昌宙,许秋瑾,赵景柱,等.五里湖生态重建影响因素及其对策探讨 [J]. 环境科学研究, 2004,17(3):44-47.
[2] 李文朝,陈开宁,吴庆龙,等.东太湖水生植物生物腐烂分解实验[J]. 湖泊科学, 2001,13(4):331-336.
[3] van Donk E, van de Bund W J. Impact of submerged macrophytes including charophytes on phyto- and zooplankton communities: allelopathy versus other mechanisms [J]. Aquatic Botany, 2002,72:261-274.
[4] 秦胜金,刘景双,周旺明,等.三江平原小叶章湿地枯落物初期分解动态 [J]. 应用生态学报, 2008,19(6):1217-1222.
[5] Castro P, Freitas H. Fungal biomass and decomposition in Spartina maritimea leaves in the Mondego salt marsh (Portugal) [J]. Hydrobiologia, 2000,428:171-177.
[6] 潘慧云,徐小花,高士祥.沉水植物衰亡过程中营养盐的释放过程及规律 [J]. 环境科学研究, 2008,21(1):64-68.
[7] Juliann M B, Timothy B M. Decomposition of dynamics of aquatic macrophytes in the lower Atchafalaya, a large floodplain river [J]. Hydrobiologia, 2000,418:123-136.
[8] 成小英,王国祥,濮培民,等.凤眼莲腐烂分解对湖泊水质的影响[J]. 中国环境科学, 2004,24(3):303-306.
[9] 顾久君,金朝晖,刘振英.乌梁素海沉水植物腐烂分解实验研究.干旱区资源与环境 [J]. 2008,22(4):181-183.
[10] 南京农业大学.土壤农化分析 [M]: 2版.北京:农业出版社. 1981:29-39.
[11] Ruban V, López-Sánchez J F, Pardo P, et al. Harmonized protocol and certified reference material for the determination of extractable contents of phosphorus in freshwater sediments: A synthesis of recent works [J]. Fresenius Journal of Analytical Chemistry, 2001,370:224-228.
[12] 国家环境保护总局.水和废水监测分析方法 [M]. 北京:中国环境科学出版社, 1998:234-245.
[13] 陈建勋,王晓峰.植物生理学实验指导 [M]. 广州:华南理工大学出版社, 2000,119-122.
[14] 徐德福,徐建民,王华胜,等.湿地植物对富营养化水体中氮、磷吸收能力研究 [J]. 植物营养与肥料学报, 2005,11(5):597-601.
[15] 任文君,胡晓波,刘 霞,等.白洋淀菹草对富营养化水体总磷的净化 [J]. 应用生态学报, 2011,22(4):1053-1058.
[16] 王圣瑞,金相灿,赵海超,等.沉水植物黑藻对上覆水中各形态磷浓度的影响 [J]. 地球化学, 2006,35(2):179-186.
[17] 华 涛,周启星. Cd-Zn对草鱼(Ctenopharyngodon idellus)的联合毒性及对肝脏超氧化物歧化酶(SOD)活性的影响 [J]. 环境科学学报, 2009,29(3):600-606.
[18] 刘周莉,何兴元,陈 玮.镉胁迫对金银花生理生态特征的影响[J]. 应用生态学报, 2009,20(1):40-44.
[19] 刘建康.高级水生生物学 [M]. 北京:科学出版社, 1999.
[20] Sharma A, Gupta M K, Singhal P K. Toxic effects of leachate of water hyacinth decay on the growth of Scenedesmus Obliquus (Chlorophyta) [J]. Wat. Res., 1996,30(10):2281-2286.
[21] 李敦海,史龙新,李根保,等.丝状绿藻腐烂过程对水质和沉水植物黑藻生长的影响实验研究 [J]. 环境科学与管理, 2006,31(6): 27-30.
[22] 潘慧云,李小路,徐小花,等.甲磺隆对沉水植物伊乐藻的生理生态效应研究 [J]. 环境科学, 2008,29(7):1844-1848.
[23] 薛 崧,汪沛洪,徐大全,等.水分胁迫对冬小麦 CO2同化作用的影响 [J]. 植物生理学报, 1992,18(1):1-7.
[24] 吴 娟,成水平,吴振斌.底泥厌氧环境和光照对菹草萌发和幼苗生理的影响 [J]. 长江流域资源与环境, 2009,18(5):482-488.
[25] Bowler C, Van C M , Inze D. Superoxide dismutase and stress tolerance [J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1992, 43:83-116.
[26] 金相灿,郭俊秀,许秋瑾,等.不同质量浓度氨氮对轮叶黑藻和碎花狐尾藻抗氧化酶系统的影响 [J]. 生态环境, 2008,17(1):1-5.
[27] 焦立新,王圣瑞,金相灿.穗花狐尾藻对铵态氮的生理响应 [J].应用生态学报, 2009,20(9):2283-2288.
Effects of organic matter decomposition on the growth and physiology of Myriophyllum spicatum.
YI Wen-li1,2, WANG Sheng-rui2*, YANG Su-wen2, JIN Xiang-can2, WANG Guo-dong3(1.Key Laboratory of Disaster Monitoring and Mechanism Simulating in Shanxi Province, Baoji University of Arts and Sciences, Baoji 721013, China;2.State key Laboratory of Environmental Criteria and Risk Assessment, State Environment Protection Key Laboratory for Lake Pollution Control, Research Center of Lake Eco-Environment, Chinese Research Academy of Environmental Science, Beijing 100012, China;3.College of Science, Northwest Agricultural and Forestry University, Yangling 712100, China). China Environmental Science, 2011,31(10):1718~1724
With the sediment applied with 0, 0.5%, and 1% organic matter (plant residues) as the substrate, a simulating experiment was conducted to study the impacts on the growth and physiology of Myriophyllum spicatum during the decomposition of plant residues. The growth of submerged plants was inhibited by adding plant residues into sediment at early stage. Comparing with those in control, the growth of the Myriophyllum spicatum at 0.5% addition treatment was promoted in the whole process, and their plant and root biomass were increased about 12.99% and 125.31%, respectively. In contrast, the growth of Myriophyllum spicatum was inhibited under the condition of 1% addition treatment. Total chlorophyll (Chla) and soluble protein (Pro) content of the plant decreased with the organic matter addition before 16d, while the syntheses of chlorophyll and protein were promoted in 0.5% addition treatment ultimately. At the 0.5% addition treatment, SOD activities increased all the time. With 1% organic matter addition and longer treatment time, the activities of SOD was increased firstly and decreased then. The malondialdehyde (MDA) content of plant in 1% addition treatment was increased about 20.13% in comparison with control at early stage, but had no significant changes with that of 0.5% addition treatment, these results indicate that a small amount of organic matter addition could promote the growth and physiology of Myriophyllum spicatum, but the physiology activities was negatively influenced by a large amount of organic matter addition.
organic matter;Myriophyllum spicatum;growth;physiological action
X503
A
1000-6923(2011)10-1718-07
2011-01-28
国家科学自然基金资助项目(40873079,40703017);陕西省教育厅项目(2010JS071);宝鸡文理学院重点项目(ZK0845)
* 责任作者, 研究员, wangsr@craes.org.cn
易文利(1975-),女,陕西汉中人,讲师,博士,主要从事湖泊富营养化研究.发表论文6篇.
