微波辅助酸功能化离子液体催化降解纤维素*
2011-12-17肖文军吴廷华
陈 沁, 肖文军, 吴 瑛, 吴廷华
(1.浙江师范大学物理化学研究所,浙江省固体表面反应化学重点实验室,浙江金华 321004;2.厦门大学材料学院,福建省防火阻燃材料重点实验室,福建厦门 361005)
近年来,由于对石油、煤炭等不可再生石化资源的过度开采,使其总量日益减少,因而人们将注意力逐渐转向对可再生资源的开发和利用.纤维素是自然界中年产量最丰富的生物大分子,将其降解得到的还原糖可直接利用或进一步转化为生物乙醇等燃料[1],是一种理想的可再生资源,许多国家,尤其是发达国家已将纤维素等可再生资源的转化利用列为经济和社会发展的重大战略.
纤维素的利用必须首先降解其为小分子,而其降解则需先溶解为均一溶液.然而,由于天然的纤维素中存在着大量的分子内和分子间氢键,加之纤维素的结晶度很高[2],使其具有难溶解、难融化和不可塑等特性,成为纤维素转化的最大障碍.寻找一种能溶解纤维素并且对环境友好的溶剂,成为纤维素降解的重要因素.2002年,Swatloski等[3]首次发现室温离子液体可以溶解纤维素,研究表明在100℃下1-丁基-3-甲基咪唑氯盐(BmimCl)最多可溶解10%的纤维素,为纤维素资源的“绿色”应用提供了一个崭新的平台.随后发现了一系列用于溶解纤维素的离子液体,而且溶解性能越来越好[4].之后,以离子液体为溶剂降解纤维素取得了不错的效果.文献[5]用BmimCl为溶剂对纤维素进行了降解,结果表明在纤维素离子液体体系中添加催化量的无机酸,油浴100℃下降解纤维素可以得到高产量的还原糖.但该体系采用无机酸作为催化剂,不可避免地会对环境造成污染,并且用传统的油浴加热所需的反应时间比较长.而将酸性基团引入离子液体后可以克服无机酸污染大的缺点.Cole等[6]首次报道了三苯基磷和咪唑阳离子上引入-SO3H后成为有较强Brosted酸性的功能化离子液体.这种功能化的酸性离子液体具有固体酸及液体酸的双重优点,近年来深受研究者的关注[7-9].因此,如何在绿色的反应介质中用绿色的催化剂降解纤维素是本文考虑的一个重点.
另外,微波加热法可以极大地促进有机反应,这种对环境友好的技术受到人们的广泛关注[10-11].并且,离子液体是一种良好的微波吸收介质.研究表明离子液体作为一种极性溶剂在微波中的加热速度会达到10℃/s,可极大地提高反应的效率[12],且对反应体系的压力影响不大.
综合上述两方面的因素,为了降低污染和提高效率,本实验以室温离子液体为溶剂,采用酸功能化离子液体为催化剂,辅以微波加热,实现对纤维素的高效降解.
1 实验部分
1.1 室温离子液体的制备
1.1.1 1-丁基-3-甲基咪唑氯盐(BmimCl)的制备
将82.1 g 1 mol甲基咪唑和97.2 g 1.05 mol氯代正丁烷加入500 mL三口瓶中,再加入200 mL乙腈,在氮气保护下回流反应48 h,冷却到室温,旋转蒸发掉溶剂后,残留物以乙腈/乙酸乙酯重结晶,得到纯白色晶体.1H NMR(400 MHz,CDCl3)δ:0.95 ~1.00(3H,t),1.34 ~1.46(2H,m),1.87 ~1.97(2H,m),4.15(3H,s),7.51(1H,s),7.61(1H,s),10.83(1H,s).
1.1.2 1-烯丙基-3-甲基咪唑氯盐(AmimCl)的制备
方法同上,用氯丙烯代替氯代正丁烷,产物室温下为棕色液体.1H NMR(400 MHz,CDCl3)δ:4.06(3H,s),4.94(2H,d),5.4(1H,d),5.91 ~5.97(1H,m),7.42(1H,s),7.65(1H,s),10.44(1H,s).
1.1.3 1-氢-3-甲基咪唑氯盐(HmimCl)的制备
冰水浴中往20 g甲基咪唑中慢慢滴加36%的盐酸30 g,室温下反应2 h,减压除水,真空干燥.1H NMR(400 MHz,CDCl3)δ:4.12(1H,s),7.17(1H,s),7.40(1H,s),9.75(1H,s),15.80(1H,s).
1.2 酸功能化离子液体的制备
1.2.1 1-甲基-3-(3-磺酸基丙基)咪唑硫酸氢盐(SFIL1)的制备
称取20 g 1,3-丙磺酸内酯溶解在150 mL甲苯中,磁力搅拌下缓慢滴加20 g甲基咪唑,之后升温至80℃反应2 h,得到白色的中间体.往白色中间体的水溶液中滴加9 g浓硫酸,80℃反应6 h,真空除水,用乙醚洗3次,真空干燥,所得浅黄色粘稠液体即为 SFIL1.1H NMR(400 MHz,D2O)δ:1.878(m,2H),2.490 ~2.493(t,2H),3.470(s,3H),3.928(t,2H),7.027(s,1H),7.091(s,1H),8.031(s,1H).
1.2.2 1-甲基-3-(3-磺酸基丙基)咪唑对甲基苯磺酸(SFIL2)和1-甲基-3-(3-磺酸基丙基)咪唑甲基磺酸(SFIL3)的制备
方法同上,分别用对甲基苯磺酸和甲基磺酸代替硫酸与中间体反应.产物SFIL2:1H NMR(400 MHz,D2O)δ:1.953(m,2H),2.011(s,3H),2.582(t,2H),3.5(s,3H),3.952(t,2H),6.975(d,1H),7.035(s,1H),7.110(s,1H),7.326(d,1H),8.316(s,1H).产物 SFIL3:1H NMR(400 MHz,D2O)δ:1.917(m,2H),2.397 ~2.527(t,2H),3.510(s,3H),3.968(t,2H),7.074(s,1H),7.138(s,1H),8.353(s,1H).
1.3 酸功能化离子液体的酸性比较
酸功能化离子液体和指示剂4-硝基苯胺一起溶解在水中,浓度分别为3×10-2和1.1×10-4mol/L.溶液混合均匀后用TU-1810紫外可见分光光度计进行波谱扫描,比较不同的酸功能化离子液体在最大吸收波长处的吸收值.
1.4 纤维素的微波降解
往2 g离子液体中加入0.1 g纤维素,100℃油浴,搅拌,完全溶解后加一定量的二甲基亚砜(DMSO),搅匀,再加少量水及一定量的酸功能化离子液体,混匀后置于微波炉中640 W加热.反应一段时间后,加水稀释,用NaOH中和,离心,取上清液进行总还原糖分析.
1.5 总还原糖的分析
按文献[5]配制3,5-二硝基水杨酸(DNS)试剂:将182 g酒石酸钾钠,6.3 g DNS及262 mL 2 mol/L NaOH溶液加入500 mL去离子水中,加热溶解后加5 g苯酚和5 g亚硫酸钠,溶解后冷却至室温,定容至1 000 mL,保存在棕色瓶中.
采用分光光度法测量总还原糖浓度时,取待测液1 mL与1 mL DNS试剂混合,在100℃水浴中加热5 min后,冷却至室温,稀释至10 mL,在紫外可见光谱仪上进行比色分析,固定波长540 nm进行测量.
总还原糖的收率按Y=0.9×MTRS/MCe计算,其中:MCe是纤维素的质量;MTRS是总还原糖的质量,MTRS=φ×V×ρ,φ为溶液稀释倍数,V为稀释后溶液的体积,ρ为测得的还原糖的质量浓度.
2 结果与讨论
2.1 离子液体及共溶剂的选择
在相同条件下,纤维素分别在AmimCl和BmimCl中降解,得到的总还原糖产率分别是63.1%和32.0%.可见,作为溶剂的离子液体对纤维素降解产率有一定的影响.比较2种室温离子液体,可知AmimCl的黏度比BmimCl的黏度低很多,这是由于前者的结构中含有一个双键所致.因此,用黏度较低的AmimCl溶解纤维素所得体系的黏度较低,在黏度较低的体系中纤维素大分子运动性更好、传质传热的效果更佳,催化剂有更多的机会进攻糖苷键,使得降解更彻底,从而提高了总还原糖的产率.
为了进一步降低体系的黏度以提高总还原糖的产率,本实验考察了不同的共溶剂对总还原糖产率的影响.据Seddon等[13]报道,只需加入20%的共溶剂就可以使离子液体的绝对黏度降低50%.本实验用AmimCl作为纤维素的溶剂,对几种常见的有机溶剂(如正己烷、四氯化碳、乙醇、二甲基亚砜、乙腈)进行了筛选,从而找出了最适合的共溶剂.
由于离子液体是极性溶剂,根据相似相溶原理,共溶剂也应该是极性的.对于那些带有活泼氢的极性溶剂,会与离子液体之间形成氢键,它们形成的氢键强于纤维素与离子液体间的氢键,从而阻止了纤维素在离子液体中的溶解.因此,往溶解了纤维素的离子液体中添加醇类,将使原已溶解的纤维素析出.经筛选,只有二甲基亚砜和乙腈符合以上要求,但考虑到降解反应在微波炉中进行,其反应温度将会超过100℃,乙腈的沸点只有82℃,而二甲基亚砜的沸点为189℃,适合于高温反应,所以本实验选用二甲基亚砜作为共溶剂.

图1 二甲基亚砜添加量对降解反应的影响
图1 表明了二甲基亚砜的添加量对总还原糖产率的影响.当反应体系中没有添加二甲基亚砜时,总还原糖产率只有43.5%.随着二甲基亚砜添加量的增大,总还原糖产率明显提高.当二甲基亚砜的添加量为0.6 g时,总还原糖产率达到 59.2%;继续添加二甲基亚砜,总还原糖产率上升的趋势减小.因此,可以确定二甲基亚砜的最佳添加量为 0.6 g.
2.2 不同催化剂对纤维素降解的影响
本实验在相同条件下考察了不同的催化剂对降解反应的影响,比较了浓硫酸和各种酸功能化离子液体对纤维素的降解效果,结果见图2.

图2 不同催化剂对降解反应的影响
从图2可以看出:用HmimCl催化降解纤维素得到的总还原糖产率最低,只有49.5%;酸功能化离子液体的降解效果较好,其中SFIL1的降解效果甚至高于浓硫酸.推测它们的催化降解效果应该与酸性大小是相关的.离子液体的酸性可以有效地通过Hammett指示剂法[9,14-15]计算,其计算公式如下:

其中:I代表碱性指示剂,pKaq(I)是指示剂在水溶液的 pKa值;[I]和[IH+]分别代表未质子化和质子化指示剂的物质的量浓度.
本实验用4-硝基苯胺为指示剂(pKaq(I)=0.99)比较了酸功能化离子液体的酸性.未质子化的4-硝基苯胺水溶液在380 nm处有最大吸收峰,根据380 nm处的最大吸收峰值可以测定添加不同酸功能化离子液体后[I]/[IH+]的值,以此计算出H0的值,计算结果见表1.从表1可以看出酸功能化离子液体在水中有很强的酸性.
根据表1中的H0值可知:非功能化的离子液体(如HmimCl)的酸性比磺酸化的离子液体的酸性低;酸功能化离子液体中SFIL1的酸性(H0=1.28)最高,接近浓硫酸的酸性(H0=1.24).酸功能化离子液体的酸性主要是由其阴离子决定的,其酸性大小的顺序为:SFIL1>SFIL3>SFIL2>HmimCl,这个顺序与它们催化降解纤维素的效果顺序一致.由于SFIL1的催化效果最好,因此,后续实验都采用这种催化剂.

表1 Hammett法计算比较不同酸功能化离子液体的酸性
2.3 催化剂用量对纤维素降解的影响
图3表明了催化剂用量对纤维素降解反应的影响,可以看出:当催化剂用量为0.02 g时,纤维素降解的速度较慢,直到70 s时总还原糖产率才达到峰值59%;当加入0.05 g催化剂时,降解速度加快,反应60 s时即可达到峰值,还原糖产率也增加到69%;进一步增加催化剂的用量至0.08 g,降解速度进一步加快,只需50 s总还原糖产率即可达最大值,但随着反应时间的延长,其总还原糖产率反而下降.考虑到酸功能化离子液体催化剂的价格及降解的效果,催化剂 SFIL1的适宜用量定为0.05 g.因此,在以下实验中催化剂的用量均为0.05 g.
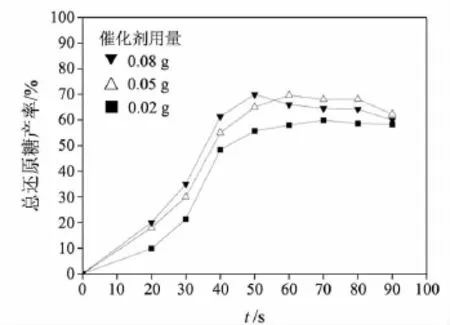
图3 催化剂用量对降解反应的影响
2.4 水含量对纤维素降解的影响
图4显示了不同水含量时的还原糖产率.从图4可知,水含量对纤维素降解反应有一定的影响.当体系中没有添加水时,降解速率比较缓慢,即使反应了60 s,其还原糖产率也只有49.7%.这是由于降解反应必须在有水的情况下才能顺利进行,水含量太低会严重限制降解反应的进行,并且在这种缺水情况下生产的少量葡萄糖容易发生脱水反应生成 5-羟甲基糠醛[1].
当添加0.02 g水时,体系初期的反应速率略有提高,50 s之后总还原糖产率明显高于无水条件下的总还原糖产率,反应70 s时总还原糖产率达到最大值59.9%.当水的添加量为0.04 g时,起始的反应速率显著提高,在20 s时总还原糖收率即可达35.4%,当反应40 s后总还原糖产率已达到65.5%,之后随着反应的继续进行总还原糖产率并没有明显下降.但是,当水含量增加至0.10 g时,总还原糖产率反而低于水含量为0.04 g时的总还原糖产率,这可能是因为过量水的稀释作用导致体系的酸性降低所致.由此可见,当水的添加量为0.04 g时纤维素的降解效果较好.

图4 水含量对降解反应的影响
3 结论
以室温离子液体AmimCl为溶剂,溶解5%的纤维素,二甲基亚砜为共溶剂以降低体系黏度,用1-甲基-3-(3-磺酸基丙基)咪唑硫酸氢盐为催化剂,用微波加热,可以实现纤维素的均相高效降解.在微波640 W 下,催化剂用量 0.05 g,水 0.04 g,DMSO 0.6 g,反应 60 s,纤维素的降解效果最佳.
[1]姜锋,马丁,包信和.酸性离子液中纤维素的水解[J].催化学报,2009(4):279-283.
[2]Nishiyama Y,Sugiyama J,Chanzy H,et al.Crystal structure and hydrogen bonding system in cellulose Iαfrom synchrotron X-ray and neutron fiber diffraction[J].J Am Chem Soc,2003,125(47):14300-14306.
[3]Swatloski R P,Spear S K,Holbrey J D,et al.Dissolution of cellose with ionic liquids[J].J Am Chem Soc,2002,124(18):4974-4975.
[4]Wu Jin,Zhang Jun,Zhang Hao,et al.Homogeneous acetylation of cellulose in a new ionic liquid[J].Biomacromolecules,2004,5(2):266-268.
[5]Li Changzhi,Zhao Zongbao.Efficient acid-catalyzed hydrolysis of cellulose in ionic liquid[J].Advanced Synthesis & Catalysis,2007,349(11/12):1847-1850.
[6]Cole A C,Jensen J L,Ntai I,et al.Novel bronsted acidic ionic liquids and their use as dual solvent-catalysts[J].J Am Chem Soc,2002,124(21):5962-5963.
[7]Liu Xiumei,Liu Min,Guo Xinwen,et al.SO3H-functionalized ionic liquids for selective alkylation of m-cresol with tert-butanol[J].Catalysis Communications,2008,9(1):1-7.
[8]Zhao Yingwei,Long Jinxing,Deng Fanguo,et al.Catalytic amounts of Brønsted acidic ionic liquids promoted esterification:Study of acidity-activity relationship[J].Catalysis Communications,2009,10(5):732-736.
[9]Duan Zhiying,Gu Yanlong,Zhang Juan,et al.Protic pyridinium ionic liquids:Synthesis,acidity determination and their performances for acid catalysis[J].Journal of Molecular Catalysis A:Chemical,2006,250(1/2):163-168.
[10]Perreux L,Loupy A.A tentative rationalization of microwave effects in organic synthesis according to the reaction medium,and mechanistic considerations[J].Tetrahedron,2001,57(45):9199-9223.
[11]Dallinger D,Kappe O.Microwave-assisted synthesis in water as solvent[J].Chemical Reviews,2007,107(6):2563-2591.
[12]Kappe O.Controlled microwave heating in modern organic synthesis[J].Angew Chem Int Ed,2004,17(43):6250-6284.
[13]Seddon K,Stark A,Torres M.Influence of chloride,water,and organic solvents on the physical properties of ionic liquids[J].Pure Appl Chem,2000,72(12):2275-2287.
[14]Thomazeau C,Olivier-Bourbigou H,Magna L,et al.Determination of an acidic scale in room temperature ionic liquids[J].J Am Chem Soc,2003,125(18):5264-5265.
[15]Xing Huabin,Wang Tao,Zhou Zhenhuan,et al.The sulfonic acid-functionalized ionic liquids with pyridinium cations:Acidities and their acidity-catalytic activity relationships[J].Journal of Molecular Catalysis A:Chemical,2007,264(1/2):53-59.
