SDS与THF对水合物法分离CO2+N2混合气的影响
2011-12-15李玉星陈玉亮
李玉星 陈玉亮
1.中国石油大学(华东)储运与建筑工程学院 2.中国石油西气东输管道分公司
SDS与THF对水合物法分离CO2+N2混合气的影响
李玉星1陈玉亮2
1.中国石油大学(华东)储运与建筑工程学院 2.中国石油西气东输管道分公司
水合物添加剂在一定程度上能够解决纯水体系下水合物分离混合气存在选择性低、水合速率不高和水合物生成条件苛刻等问题,为了系统地研究十二烷基硫酸钠(SDS)及四氢呋喃(THF)对水合物分离特性的影响,采用自行设计的水合物分离实验装置,分别进行了浓度为0、100 mg/kg、300 mg/kg、500 mg/kg、1 000 mg/kg的SDS溶液及摩尔分数为0、0.5%、1.0%、3.0%的THF溶液体系下,水合物法分离摩尔分数为59%的CO2和摩尔分数为41%的N2混合气的实验。实验结果表明:SDS能够提高水合物的生成速率及储气密度,随着SDS浓度的增大,CO2分离率与N2损失率都呈现先增大后减小的趋势,分离因子呈现先减小后增大的趋势,在初始压力为5.0 M Pa、温度为1.4℃的情况下, SDS浓度为0~100 mg/kg时水合物分离效果较佳;THF有效地降低了水合物的相平衡压力,THF本身生成Ⅱ型水合物并占据水合物的大孔穴,CO2优先于N2占据水合物的小孔穴,当初始压力为4.8 MPa、温度为1.4℃时,THF摩尔分数约为1.0%时能够较好地改善水合物的分离效果。
水合物分离法 混合气 SDS THF 分离特性 分离率 损失率 分离因子
随着温室效应的日益加剧,CO2的减排和分离回收成为可持续发展的必然要求[1],CO2的分离技术业已成为世界范围内的研究热点,其中水合物法分离混合气体技术近年来越来越受到关注[2-4]。但在研究过程中发现,水合物法分离混合气存在着分离选择性低、水合速率不高和生成条件苛刻等缺点,影响了水合物法分离技术工业化的进程。为了克服纯水体系下水合物分离法的缺点,实验中经常使用添加剂来加快水合物的生成速率,降低其生成压力。由于添加剂的使用,水合物体系的物性(表面张力、活度等)会发生很大的变化[5-7],有的添加剂(四氢呋喃 THF、四丁基溴化铵TBAB等)本身也会生成水合物,因此研究添加剂对水合物分离法的影响具有重要的工业意义[8-17]。
十二烷基硫酸钠(SDS)是常用的水合物动力学促进剂,能有效地降低水的表面张力,加快水合物的生成速率。四氢呋喃(THF)是常用的水合物热力学促进剂,能有效地降低水合物的生成压力。为了系统地研究SDS及THF对水合物分离特性的影响,以CO2+ N2混合气为例,进行了不同浓度SDS与 THF溶液体系下的水合物分离混合气实验。
1 分离效果评价指标
采用Linga等提出的CO2分离率和分离因子作为水合物分离效果的评价指标[18],同时,为了直观地说明N2组分的变化,笔者将N2损失率(水合物相的N2与原料气中N2的物质量之比)也作为分离效果评价指标之一。
2 实验装置
使用自行设计的变体积搅拌高压反应釜进行水合物法混合气分离实验,实验装置如图1所示。为适应实验的需求,反应釜的设计最高承压为15 M Pa,可变容积由手动计量泵控制,容积可变范围为312.7~765.2 m L;反应釜内温度由Pt100温度传感器实时测量,压力由罗斯蒙特3051型差压式压力变送器实时测量,实验所用的混合气由纯度为99.99%的CO2和N2配制;气相组成的摩尔分数由瓦里安CP3800气相色谱仪测得。

图1 水合物法混合气分离实验装置图
3 实验结果及分析
为了分析不同浓度SDS与THF溶液体系下混合气水合物的生成速率、相平衡条件及分离效果,配制了100 mg/kg、300 mg/kg、500 mg/kg和1 000 mg/kg的SDS溶液与摩尔分数分别为0.5%、1.0%和3.0%的THF溶液,以59%CO2+41%N2(摩尔分数)的混合气作为原料气进行水合物分离实验。
3.1 SDS体系下的混合气水合物分离效果
分别注入220 mL不同浓度的SDS反应溶液,将初始组成59%CO2+41%N2(摩尔分数)的混合气注入反应釜,设定初始压力为5.0 M Pa,温度为1.4℃,测得气相CO2的摩尔分数随时间的变化情况如图2所示。
由图2可以看出,在SDS反应溶液体系中,初始的气相CO2摩尔分数下降很快,说明在较高的系统压力下,大量的CO2迅速地溶解在水中,而N2的溶解度较小,此时CO2的摩尔分数可以达到1个极小值。当溶解在液相中的气体组分达到一定的浓度时,水合物开始生成,溶解在水中的CO2会转移到水合物相中,同时也会有部分N2进入水合物相。由于液相中CO2的摩尔分数大于水合物中CO2的摩尔分数,而且随着反应溶液的消耗,溶解在水中CO2的量受到限制,因此随着水合物的生成,气相CO2的摩尔分数会出现由低转高的趋势。另外,SDS溶液与纯水体系相比,气体溶解速率与水合物生成速率都有一定程度的提高,因为SDS是一种表面活性剂,它的加入能使溶液“发泡”,降低水的表面张力,使气体迅速溶入水中,生成的水合物不像在纯水体系中那样附着在反应容器的表面,而是均匀地分散在整个溶液中,因此可以很快地达到气—液—水合物的平衡。

图2 不同浓度SDS溶液体系下气相CO2摩尔分数随时间的变化图
图3为不同SDS浓度下系统压力随时间的变化。由图3可以看出在同一温度、同一初始压力下,SDS溶液体系的水合物相平衡压力比纯水体系的水合物相平衡压力要低。理论上SDS作为一种动力学促进剂不会影响水合物生成的热力学条件[19],但当大量水合物生成时,随着水的消耗,SDS的浓度可能变得很大,当SDS的浓度超过一定值且影响到水的活度时,就会影响水合物的相平衡条件。
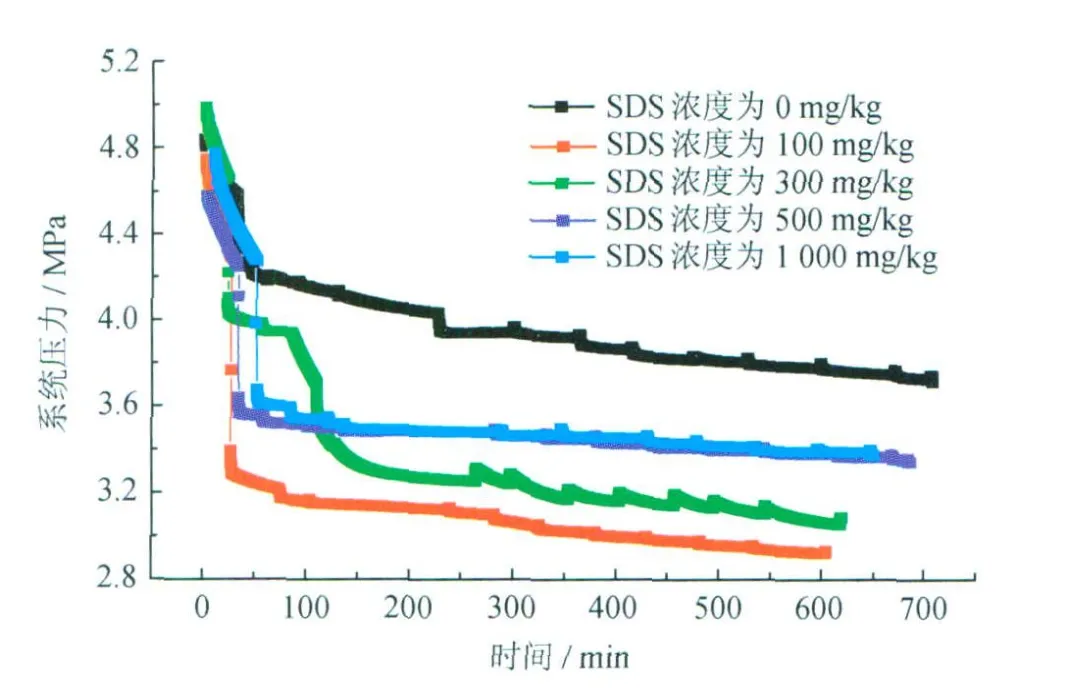
图3 不同SDS浓度下系统压力随时间的变化图
对于密闭体系来讲,SDS的大量存在会在水中形成胶粒子,使气体分子“溶液化”,每个胶粒子都可能成为“成核核心”。因此,加入SDS的溶液生成水合物的反应不像纯水那样只发生在气液接触面,也有可能发生在液相内部。当水合物颗粒移动到液相表面时, SDS分子会吸附在水合物颗粒表面,“憎水基”留在气相中,这样就大大降低了颗粒的表面自由能,使水合物颗粒不容易聚集。由SDS溶液生成的水合物呈颗粒状,这样就保证了气相与固相的良好接触,所消耗的气体的量也比纯水体系要多,水合物生成速率大,气—固相平衡可以快速达到,且水合物相中的组分均匀[8]。由图3还可以看出 SDS浓度在100 mg/kg与300 mg/kg时,由于反应溶液浓度比较靠近SDS的临界胶束浓度(230 m g/kg),对水合物的促进作用最明显,因此100 mg/kg与300 mg/kg的SDS溶液消耗的气体量最多。
由图2可以看出不同浓度SDS溶液体系下平衡气相CO2的浓度会有所差别,由图3可以看出不同浓度SDS溶液体系下平衡压力相差更大,因此,CO2分离率、N2损失率及分离因子会有很大的不同。图4为不同SDS浓度下的混合气水合物分离效果图。由图4可知,纯水时CO2的分离率约为55%,N2的损失率约为5%,分离因子为9;100 mg/kg SDS时CO2的分离率增至67%,但N2的损失率同时增至25%,分离因子降为5.5。因此,SDS的加入并非都利于混合气的分离,虽然100 mg/kg与300 mg/kg的SDS溶液消耗的气体量最多,但并不能说在此溶液体系下水合物分离效果最好。SDS的加入对CO2分离率与N2损失率的影响类似,CO2分离率增大或减小的同时,N2损失率也不同程度地增大或减小。随着SDS浓度的增大, CO2分离率和N2损失率也不断地增大,分离因子不断减小;当达到SDS临界胶束浓度时,CO2分离率和N2损失率达到极大值,分离因子达到极小值;SDS浓度继续增大时,CO2分离率和N2损失率逐渐减小,分离因子逐渐增大。综合考虑,在增大CO2分离率的同时要控制N2损失率,总体上提高分离因子,因此SDS浓度选择在0~100 mg/kg时比较合适。

图4 不同SDS浓度下的混合气水合物分离效果图
3.2 THF体系下混合气水合物的分离效果
分别注入220 m L不同浓度的THF反应溶液,将初始组成59%CO2+41%N2(摩尔分数)的混合气注入反应釜,设定初始压力为4.8 M Pa,温度为1.4℃,测得气相CO2的摩尔分数随时间的变化情况如图5所示。

图5 不同浓度THF溶液体系下气相CO2摩尔分数随时间的变化图
由图5可以看出,与纯水体系相比,THF的加入能够明显降低气相CO2的摩尔分数。达到平衡时,纯水体系下气相CO2的摩尔分数约为42%,在摩尔分数为1.0%和3.0%的 THF溶液体系下气相CO2的摩尔分数达到最低,约为35%。THF作为一种水合物热力学促进剂,本身能生成Ⅱ型水合物,而且它的生成压力比较低,能在较温和的条件下生成水合物,因此, CO2+N2混合气在 THF溶液体系下生成水合物时, THF分子会优先与水分子生成 Ⅱ型水合物,其中THF分子占据Ⅱ型水合物的大孔穴,为了保证水合物的稳定性,CO2或N2进入Ⅱ型水合物的小孔穴。CO2的分子直径为0.330 nm,N2的分子直径为 0.364 nm,Ⅱ型水合物的大孔穴直径为0.473 nm,Ⅱ型水合物的小孔穴直径为0.391 nm,Ⅰ型水合物大孔穴直径为0.433 nm,小孔穴直径为0.395 nm[20],因此,CO2和N2分子都可以进入Ⅱ型水合物的大、小孔穴。Ⅱ型水合物中小孔穴与大孔穴的数量比为 16∶8,1 molTHF生成水合物的同时,要有2 mol的气体分子进入水合物的小孔穴[21],同一温度下CO2的相平衡压力远低于N2的相平衡压力,说明CO2水合物稳定性更好,因此,可以推断CO2分子会优先进入Ⅱ型水合物的小孔穴。
图6为不同THF浓度下系统压力随时间的变化图。由图6可以看出,随着 THF浓度的增加,水合物相平衡压力越来越低。纯水体系下相平衡压力约为3.75 M Pa,3.0%(摩尔分数)THF体系下的相平衡压力约为1.5 M Pa,说明 THF是一种有效的热力学促进剂,能大大降低水合物的相平衡压力,提高水合物的储气密度。

图6 不同THF浓度下系统压力随时间的变化图
图7为不同THF浓度下的混合气水合物分离效果图。由图7可知,CO2分离率随 THF浓度的升高而升高,说明更多 THF分子占据Ⅱ型水合物大孔穴的同时,会有更多CO2分子占据水合物的小孔穴。N2损失率随THF浓度的升高出现先升高后减小再升高的趋势。在纯水体系下CO2的分离率与N2的损失率都较低,但分离因子最大;摩尔分数为0.5%的 THF溶液体系下CO2分离率与N2损失率都大增,但分离因子较低;摩尔分数为1.0%的THF溶液体系下CO2分离率增大,N2损失率减小,分离因子增大;摩尔分数为3.0%的THF溶液体系下CO2分离率与N2损失率都增大,尤其是N2损失率大增,分离因子降低。分析其原因为:Ⅱ型水合物的理论分子式为8X·16Y· 136H2O(X为大分子,Y为小分子)[20],可以看出Ⅱ型水合物中大分子与小分子的摩尔数比为1∶2,假定CO2分子优先于N2分子进入水合物孔穴,THF完全进入水合物相,因此当进入水合物相的 THF与CO2的物质的量之比为1∶2时,就认为是到达最佳分离效果的THF浓度。
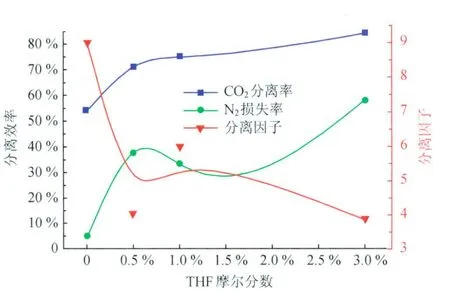
图7 不同THF浓度下的混合气水合物分离效果图
由图7可知,当 THF摩尔分数为0~0.5%时, THF生成Ⅱ型水合物,其分子占据水合物的大孔穴, CO2分子占据水合物的小孔穴,由于 THF不足,CO2与N2可以继续占据Ⅰ、Ⅱ型水合物的大、小孔穴,此时CO2分离率和N2损失率都较大;当THF摩尔分数为0.5%~1.5%时,THF生成Ⅱ型水合物,其分子占据水合物的大孔穴,CO2分子占据混合气水合物的小孔穴且水合物相CO2与 THF摩尔数之比逐渐接近2∶1,此时CO2分离率增大,N2损失率减小;当 THF摩尔分数为1.5%~3.0%时,THF过量,THF生成Ⅱ型水合物,其分子占据水合物的大孔穴,同时水合物小孔穴的数量大增,CO2与N2分子可以同时占据水合物的小孔穴,此时CO2分离率和N2损失率同时增大。通过以上对比可知,对于初始压力为4.8 M Pa,温度为1.4℃,初始组成59%CO2+41%N2(摩尔分数)的混合气,THF摩尔分数约为1.0%时能够较好地改善混合气水合物的分离效果。
4 结论
1)采用自行设计的水合物分离实验装置,以59% CO2+41%N2(摩尔分数)的混合气为例,进行了不同浓度SDS与THF溶液体系下水合物分离混合气的实验,系统地分析了SDS及 THF对水合物分离特性的影响。
2)SDS能够提高水合物的生成速率和储气密度,随着SDS浓度的增大,CO2分离率与N2损失率都呈现先增大后减小的趋势。当SDS浓度达到临界胶束浓度230 mg/kg时,对水合物的促进作用最明显,在临界胶束浓度附近,CO2分离率和N2损失率达到最大,分离因子最小。综合考虑,在初始压力为 5.0 M Pa、温度为1.4℃的分离条件下,SDS浓度为0~100 mg/kg时水合物分离效果较佳。
3)THF能够降低水合物的相平衡压力,提高其储气密度,THF生成Ⅱ型水合物,其分子占据水合物的大孔穴,CO2优先于N2分子占据水合物的小孔穴。当进入水合物相的THF与CO2的物质的量之比等于Ⅱ型水合物理论分子式大小分子数之比时,水合物分离效果较好。综合考虑,在初始压力为4.8 M Pa、温度为1.4℃的分离条件下,THF摩尔分数为1.0%左右时能够较好地改善水合物的分离效果。
[1]费维扬,艾宁,陈健.温室气体CO2的捕集和分离——分离技术面临的挑战与机遇[J].化工进展,2005,24(1):1-4.
[2]李士凤,樊栓狮,王金渠,等.CO2水合分离研究进展[J].化工进展,2009,28(5):741-744.
[3]唐建峰,陈玉亮,王琳,等.水合物法分离CO2与N2混合气的实验[J].天然气工业,2010,30(9):113-116.
[4]韩永嘉,王树立,张鹏宇,等.CO2分离捕集技术的现状与进展[J].天然气工业,2009,29(12):79-82.
[5]王秀林,陈杰,宋波,等.水合物法分离CH4—C2H6—H2O体系的相平衡研究[J].石油与天然气化工,2011,40(1): 15-17.
[6]江承明,阳涛,郭开华.CO2—CH4混合气体水合物相平衡实验研究[J].石油与天然气化工,2011,39(5):371-373.
[7]杨传,付东.PC—SAFT理论对CO2—甲烷体系相平衡的研究[J].石油与天然气化工,2011,39(4):273-276.
[8]DOU Bin,JIANG Guosheng,WU Xiang,et al.Research of surfactants effect on methane hydrate formation[C]∥paper 103689-MS p resented at the SPE International Oil&Gas Conference and Exhibition,5-7 December 2006,Beijing, China.New York:SPE,2006.
[9]KALOGERAKIS N,JAMALUDD IN A K M,DHOLABHA P D,et al.Effect of surfactants on hydrate fo rmation kinetics[C]∥paper 25188-MS p resented at the SPE International Symposium on Oilfield Chemistry,2-5 March 1993,New Orleans,Louisiana,USA.New York:SPE, 1993.
[10]L INK D D,LADNER E P,ELSEN H A,et al.Fo rmation and dissociation studies fo r op timizing the up takeof methane by methane hydrates[J].Fluid Phase Equilibria,2003, 211(1):1-10.
[11]袁吉,李金平,王林军,等.表面活性剂对水合反应物两相界面张力的影响[J].中国科学技术大学学报,2008,38 (4):419-420.
[12]张保勇,吴强,朱玉梅.THF对低浓度瓦斯水合化分离热力学条件促进作用[J].中国矿业大学学报,2009,38(2): 204-207.
[13]鲁涛,张郁,李小森,等.CO2—N2—TBAB和CO2—N2—THF体系的水合物平衡生成条件[J].过程工程学报, 2009,19(3):541-542.
[14]KANG S P,LEE H,LEEC S,et al.Hydrate phase equilibria of the guestmixtures containing CO2,N2and tetrahydrofuran[J].Fluid Phase Equilibria,2001,185(1/2): 101-109.
[15]刘妮,ZHANG Guochang,ROGERS R E.添加剂对CO2水合物生成的影响[J].天然气工业,2008,12(12):104-105.
[16]孙长宇,陈光进.(氮气+四氢呋喃+水)体系水合物的生长动力学[J].石油学报:石油加工,2005,8(21):99-100.
[17]张凌伟.水合物法分离裂解气的实验及模拟研究[D].北京:中国石油大学,2005.
[18]L INGA P,KUMAR R,ENGLEZOS P.Gas hydrate formation from hydrogen/carbon dioxide and nitrogen/carbon dioxide gas mixtures[J].Chemical Engineering Science, 2007,62(16):4268-4276.
[19]PA KULSKIM.Accelerating effect of surfactants on gas hydrates formation[C]∥paper 106166-MS p resented at the SPE International Symposium on Oilfield Chemistry, 28 February - 2 March 2007,Houston,Texas,USA.New York:SPE,2007.
[20]陈光进,孙长宇,马庆兰.气体水合物科学与技术[M].北京:化学工业出版社.2007.
[21]L INGA P,KUMAR R,ENGLEZOS P.The clathrate hydrate p rocess for post and p re-combustion cap ture of carbon dioxide[J].Journal of Hazardous Materials,2007,149 (3):625-629.
Effects of SDSand THF on the separation of CO2+N2m ixed gases based on the hydratemethod
Li Yuxing,Chen Yuliang
(School of Storage and A rchitectural Engineering,China University of Petroleum - East China,Qingdao, Shandong 266555,China)
NATUR.GAS IND.VOLUM E 31,ISSUE 7,pp.82-86,7/25/2011.(ISSN 1000-0976;In Chinese)
Hydrate additives can be used to solve such p roblem s as low selectivity,low fo rmation rate and harsh formation condition of gasmixture separation in pure water system.Thus,in order to investigate into how the sodium dodecyl sulfate(SDS)and tetrahydrofuran(THF)affect the hydrate separation performance,we adop ted our self-designed apparatus for such experiments.The gas mixture of 59%CO2and 41%N2were separated in the p repared solutionsof 0,100,300,500,and 1000 ppm(mg/kg)sodium dodecyl sulfate(SDS)and 0,0.5,1.0,and 3.0 mol%tetrahydrofuran(THF)respectively.The results show that SDS can accelerate hydrate fo rmation rate and gas sto rage capacity.With the increment of SDS concentration,the CO2separation rate and N2loss rate both increase at first but then decrease.The CO2separation rate and N2loss rate rise high to themaximum,the separation factor reduces to theminimum w hen the SDS concentration is about 230 ppm.In short,the separation effect is passable w hen the SDS concentration is 0 - 100 ppm at 5.0 M Pa(initial p ressure)and 1.4℃.THF can lower hydrate phase equilibrium p ressure,the reason of w hich is that THF can fo rm structure II hydrate and occupy large cage(51264),CO2has p recedence to N2to occupy small cage (512).The separation effect is satisfactory w hen themolar ratio between THF and CO2is 1∶2 in hydrate phase.In short,the separation effect is passable w hen the THF concentration is about 1.0 mol%at 4.8 M Pa(initial p ressure)and 1.4℃.
hydrate separation,mixed gas,SDS,THF,separation performance,separation efficiency,loss rate,separation factor DO I:10.3787/j.issn.1000-0976.2011.07.020
李玉星等.SDS与 THF对水合物法分离CO2+N2混合气的影响.天然气工业,2011,31(7):82-86.
DO I:10.3787/j.issn.1000-0976.2011.07.020
国家自然科学基金“水合物颗粒聚集动力学及流动安全研究”(编号:51006120),山东省自然科学基金“含水合物的相平衡体系中气体溶解度研究”(编号:ZR2009FM 036),教育部新世纪人才支持计划(编号:NCET-07-0847)。
李玉星,1970年生,教授,副院长,博士后;主要从事油气混输工艺技术、输气管道运行模拟仿真技术、天然气水合物技术、液化天然气技术等方面的研究工作。地址:(266555)山东省青岛市经济技术开发区长江西路66号中国石油大学(华东)储运与建筑工程学院油气储运系。电话:13370809333。E-mail:liyx@upc.edu.cn
(修改回稿日期 2011-05-05 编辑 何 明)
L iYuxing,p rofesso r,born in 1970,ismainly engaged in technical research of oil-gasmix transpo rtation,simulation of gas pipeline operation natural gas hydrate,and LNG related technical studies,etc.
Add:No.66,West Changjiang Rd.,Economic&Technical Development Zone,Qingdao,Shandong 266555,P.R.China
Mobile:+86-13370809333 E-mail:liyx@upc.edu.cn
