荧光定量PCR对微小RNA的检测及应用
2011-12-08龚文容赵建华程正江
龚文容 ,赵建华,程正江
(1. 襄樊学院 医学院, 湖北 襄阳 441053; 2. 襄樊学院附属医院 医学检验部,湖北 襄阳 441021; 3. 华中科技大学同济医学院附属同济医院 妇产科, 湖北 武汉 430030)
荧光定量PCR对微小RNA的检测及应用
龚文容1,2,赵建华3,程正江2
(1. 襄樊学院 医学院, 湖北 襄阳 441053; 2. 襄樊学院附属医院 医学检验部,湖北 襄阳 441021; 3. 华中科技大学同济医学院附属同济医院 妇产科, 湖北 武汉 430030)
目的:建立一种定量、简单、快速、敏感的微小RNA(miRNA,miR)检测方法,并用其观察一些病理状态下有关miRNA的变化. 方法:通过特殊设计的茎环结构的反转录引物,对miRNA进行反转录,然后用相应miRNA的正反向引物对该miRNA进行定量检测,观察重复性和特异性. 用此法检测了人巨细胞病毒(HCMV)对滋养细胞(HPT-8)细胞内miR-513表达水平的影响,也检测了结直肠癌组织miR-145水平. 结果:用该法扩增miRNA特异性强,结果重复性好,该法检测到HCMV感染对miR-513表达的梯度效应. 也发现癌组织和正常组织间miR-145的表达有明显的差异. 结论:用荧光定量PCR可以对微小RNA快速有效的检测,在临床工作中可得到很好的应用.
荧光定量PCR;miRNA;人巨细胞病毒;滋养细胞;结肠癌
微小RNA(miRNA,miR)是近年来发现的长度大约为22个核苷酸的小分子非编码RNA. 它主要通过与靶基因3末端非转录顺序(3’-UTR)的完全或不完全配对,抑制靶基因的翻译或降解靶基因mRNA起作用.实验证明,miRNA在多种病理过程中如肿瘤,病毒感染等情况时表达水平发生异常,可在肿瘤的发生、发展中起癌基因或抗癌基因的作用,在病毒感染时影响一些基因的表达,目前认为引起miRNA表达异常的原因有染色体重组、基因扩增、突变及表现遗传学改变等[1-2].
miRNA在结直肠癌的发生、发展中起着非常重要的作用,研究发现miR-143、miR-145、miR-34a和let-7等在癌细胞中表达较正常粘膜上皮细胞明显降低[1-3],而miR-21,31的表达则明显升高[3-5]. 在一些其它病理生理过程miRNA也起重要作用,如在短管上皮癌免疫共抑制分子B7-H1的表达调控中,miR-513有重要作用[6]. miRNA是一种非转录的内源性RNA分子,过去对其检测主要依赖芯片和原位杂交技术,但因所用方法繁杂,昂贵和需要放射性同位素等,这些方法未能广泛应用. 荧光定量PCR是检测RNA的最为简洁,快速,有效的手段,但在miRNA的检测上存在困难,因miRNA仅有22个核苷酸左右,与所用PCR引物大小相近,无法检测,我们利用miRNA的特征性茎环结构在反转录时将miRNA增加到60个核苷酸左右,然后进行荧光定量PCR检测,取得了良好结果,现予以报道.
1 材料和方法
1.1 一般资料
用于RNA提取的Trizol来自Invitrogen公司. MMLuV反转录试剂盒购自Fermentas公司. 用于荧光定量PCR的SYBR 试剂源自Takara公司. miR-145、miR-513、U6的反转录和PCR引物由广东锐博公司提供. 人巨细胞病毒(HCMV)AD169株来自美国模式培养物集存库(American type culture collection,ATCC),滋养细胞HPT-8细胞株来自第四军医大学预防医学系流行病教研室. 结肠癌标本均在手术切除后即刻采集,取癌组织和远离癌组织的正常组织各100mg,迅速置于1ml Trizol中,保存于液氮中直到RNA提取. 所有病例的手术切除标本都做了常规病理性检查,以确定癌症的诊断,详细记录病人相关资料. 癌症病人88例,男56例,女32例,年龄在43-84岁间,平均为63岁,病理上均为腺癌,其中肿瘤位于直肠46 例,乙状结肠10例,升结肠 11例,降结肠9例,横结肠7例,结肠肝曲2例,脾曲3例. 远处转移或浸润邻近器官共19例,其中转移或浸润至肝9例,浸润卵巢,胰腺,肾脏各2例,浸润阴道后壁4例.
1.2 HCMV AD169毒株感染性滴度测定
取生长良好的HEL细胞,经0.25%胰酶消化后,收集细胞并将细胞密度调整为2×105个/ml,按0.1ml/孔加入96孔板中,放入CO2培养箱中培养24-48h;细胞贴壁后,吸净各孔培养液,将新扩增的HCMV病毒悬液按10倍梯度从10-1稀释到10-77个不同浓度,每个浓度接种6孔,每孔0.1ml,另设正常细胞对照6孔,培养7天;逐日观察记录细胞病变情况. 细胞病变程度判定标准:(—)细胞无病变,(+)~25%细胞出现病变,(++)~50%细胞出现病变,(+++)~75%细胞出现病变,(++++)~100%细胞出现病变. Reed-Muench法公式计算半数细胞感染量 (TCID50):TCID50=10a. 其中,a=高于 50%细胞死亡百分率病毒稀释度的对数+距离比例×稀释系数的对数,距离比例=(高于50%的细胞死亡百分数—50)/(高于50%的细胞死亡百分数—低于50%的细胞死亡百分数). 用含3%胎牛血清的DMEM培养基将人巨细胞病毒(HCMV)稀释为不同浓度作为实验组作用于生长良好的HPT-8细胞. 以含3%胎牛血清的DMEM培养基作为空白对照组.培养24h后,进行荧光定量PCR对miR-513的检测.
1.3 RNA提取
大约106个HPT-8细胞或100mg结直肠组织用1ml Trizol处理,匀浆器捣碎,根据操作要求经氯仿分离,异丙醇沉淀,75%乙醇清洗后用DEPC水溶解,测定浓度后,-70℃冻存.
1.4 反转录和荧光定量PCR
miRNA的cDNA第1链合成用3 μg的RNA,62.5nmol/L的miR-145和U6反转录引物各2 μl,按Fermentas的M-MuLV反转录试剂盒的步骤进行,总体积为40 μl,-20℃保存. 用ABI 7500荧光定量PCR仪相对定量检测miR-145的水平,SYBR green作为荧光染料,每管中加入5 μmol/L的正向反向引物各2 μl,2 μl的miRNA cDNA第1链,PCR反应的总体积为20 μl,利用miRNA的 茎环结构对miR-145予以扩增,miR-145和U6的PCR引物由广东锐博公司提供,U6基因为内参. miR-145和U6用相同的条件进行扩增,反应条件为50℃ 2 min,95℃ 10 min,40个循环的95℃ 15 sec,60℃ 60sec. 用熔解曲线检测引物的特异性. PCR产物予以测序.
1.5 统计学方法
应用SPSS17.0 统计学软件分析, 所有数值以均数±标准差表示. 组间差异性采用Student’s t检验和单因素方差分析.
2 结果
2.1 荧光定量PCR检测miRNA技术的建立
采用相对定量PCR方法能对miR-513或miR-145在组织中的表达水平进行灵敏、稳定的检测,如图1所示,miR-145在本实验中得到较好的扩增,熔解曲线表明了引物的特异性和产物的单一性,PCR产物经测序技术进行了进一步的证实,结果为GUCCAGUUUUCCCAGGAAUCCCU,证实为miR-145. 在HPT-8细胞我们也有效地建立了miR-513的检测方法. 产物也经过了DNA测序证实.
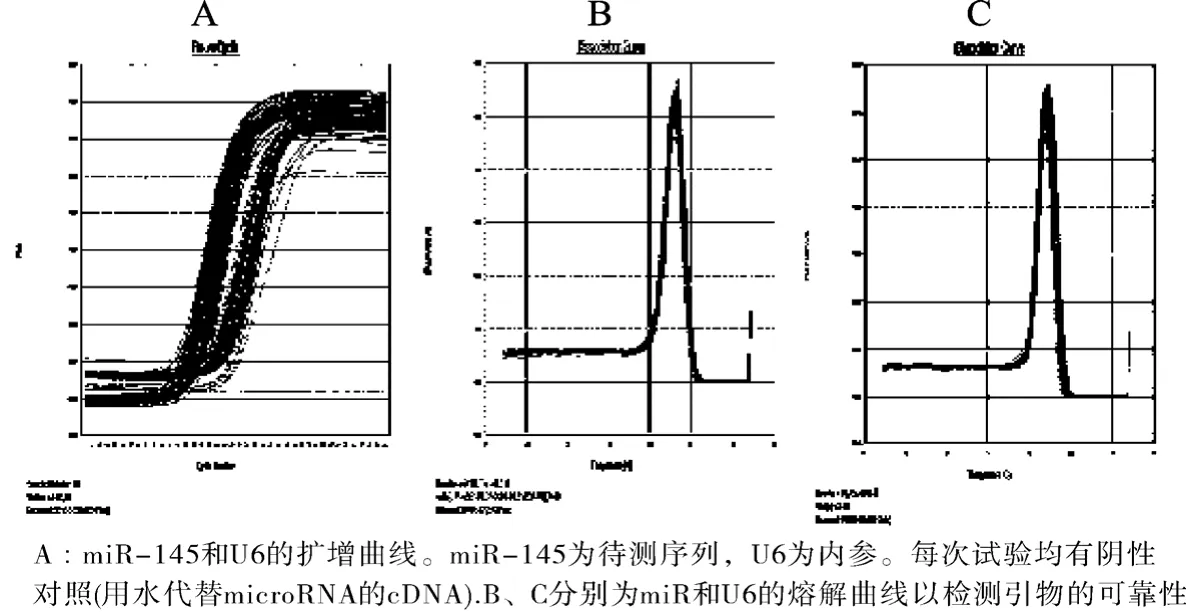
图1 荧光定量PCR技术测定miR-145
2.2 HCMV AD169毒株感染性滴度测定及HCMV对HPT-8细胞miR-513表达的影响
连续观察7d后,正常细胞对照组的细胞生长良好. 接种病毒的10-1浓度各孔均出现细胞病变,10-2、10-3、10-4浓度分别有 5孔、4孔、3孔出现细胞病变,10-5、10-6、10-7浓度各孔未出现细胞病变. 根据Reed-Muench公式计算得出,HCMV AD169标准株的TCID50=10-3.29. 用含3%胎牛血清的DMEM培养基将人巨细胞病毒(HCMV)稀释为不同浓度作为实验组作用于生长良好的HPT-8细胞. 以含3%胎牛血清的DMEM培养基作为空白对照组. 培养24h后,进行miR-513的检测(图2).
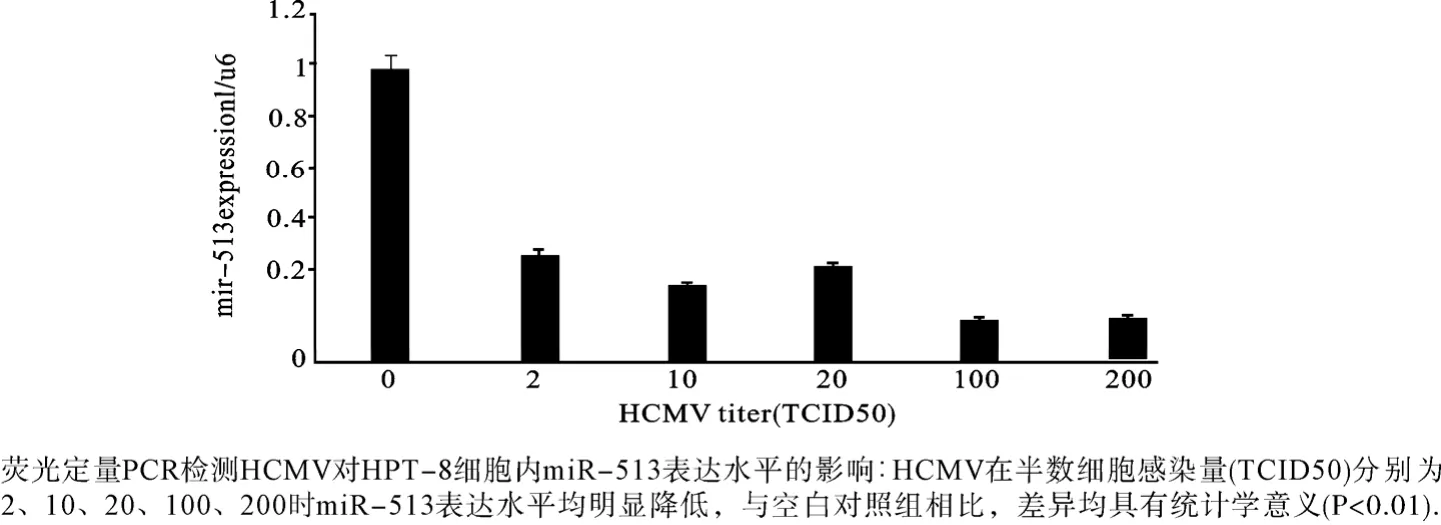
图2 HCMV在不同浓度时对HPT-8细胞表达miR-513的影响
荧光定量PCR见,HCMV抑制HPT-8细胞内miR-513的表达. 随着HCMV浓度的增加,miR-513的表达水平降低,与空白对照组相比,差异有统计学意义(图2,P<0.01). 以空白组miR-513的表达量为1,2TCID50、10TCID50、20TCID50、100TCID50、200TCID50病毒滴度组的miR-513的表达量为0.358、0.254、0.315、0.138、0.149;
2.3 结直肠癌miR-145表达水平的检测
如图3所示,miR-145在结直肠癌组织的表达水平为31.65±27.97,在正常组织中为189.39±159.30,差异有统计学意义,P <0.01.
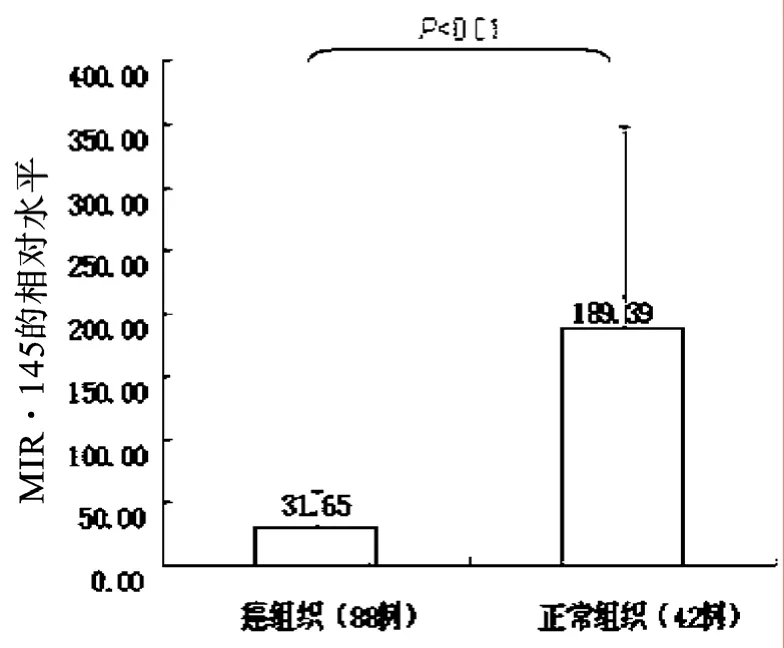
图3 miR-145在结直肠癌和正常组织的相对水平
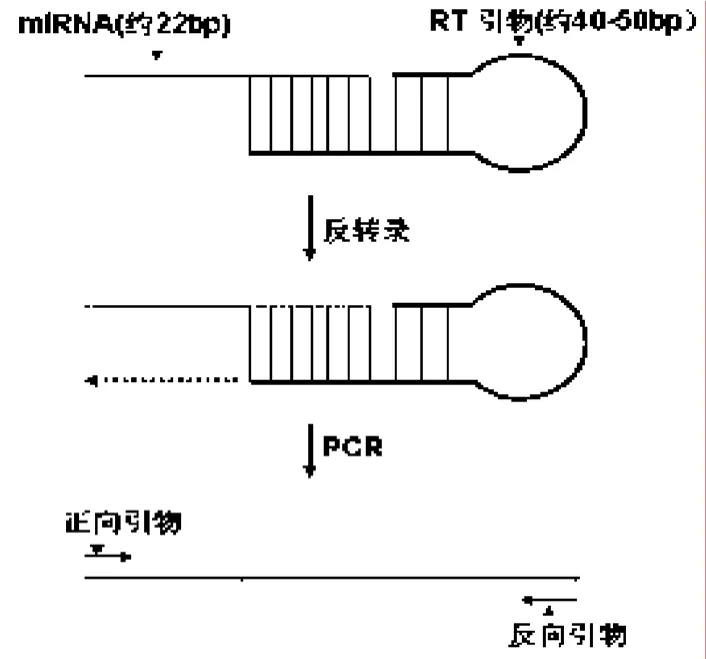
图4 利用miRNA的茎环结构设计的RT引物及其作用机理示意图
3 讨论
大量研究表明,miRNA与多种生理,病理过程存在密切相关. 例如,它可以通过转录后机制调控一些基因表达[6],它也可以通过调控抑癌基因,癌基因或其它肿瘤相关基因的表达,对肿瘤的产生,生长,分化和转移等产生影响[2]. 因此,对miRNA的检测是十分热门的课题. miRNA是一种非转录的内源性RNA分子,过去对其检测主要依赖芯片和原位杂交技术,但因所用方法繁杂,昂贵和需要放射性同位素等,这些方法未能广泛应用. 我们利用miRNA的茎环结构对miR-145予以反转录和定量扩增. 其作用机理如图4所示.
该法简单,灵敏,快速,费用低而且重复性强,可在实际中广泛应用. 目前主要进行了两个项目的研究,一是检测HCMV对HPT-8细胞表达miR-513的影响. 二是检测结直肠癌miR-145 表达水平[7],两者均取得了满意的结果.
[1] Croce CM. Causes and consequences of microRNA dysregulation in cancer[J]. Nat Rev Genet, 2009, 10(10): 704-714.
[2] Visone R, Croce CM. MiRNAs and cancer[J]. Am J Pathol, 2009, 174(4): 1131-1138.
[3] Michael MZ, SM OC, van Holst Pellekaan NG, Young GP, James RJ. Reduced accumulation of specific microRNAs in colorectal neoplasia[J]. Mol Cancer Res, 2003, 1(12): 882-891.
[4] Wang CJ, Zhou ZG, Wang L, Yang L, Zhou B, Gu J, et al. Clinicopathological significance of microRNA-31, -143 and -145 expression in colorectal cancer[J]. Dis Markers, 2009, 26(1): 27-34.
[5] 于振涛, 蔡 星, 尚晓滨. microRNA在结肠癌组织的表达及其临床意义[J]. 中华实验外科杂志, 2008, 25(7): 894-896.
[6] Gong AY, Zhou R, Hu G, Li X, Splinter PL, O'Hara SP, et al. MicroRNA-513 regulates B7-H1 translation and is involved in IFN-gamma-induced B7-H1 expression in cholangiocytes[J]. J Immunol, 2009, 182(3): 1325-1333.
[7] 龚文容, 卢晓明, 陈志松, 等. miR-145 在结直肠癌组织的表达及临床意义[J]. 中华实验外科杂志, 2011, 28(1): 35-36.
(责任编辑:徐 杰)
MicroRNA's Detection with Fluorescence Quantitative PCR and Its Clinical Usage
GONG Wen-rong1,2, ZHAO Jian-Hua3, CHENG Zheng-jiang2
(1. Medical College, Xiangfan University, Xiangyang 441053, China; 2. Department of Clinical Laboratory, the Affiliated Hospital of Xiangfan University, Xiangyang 441021, China; 3. Department of Gynecology, Tongji Medical School of Huazhong University of Science and Technology, Wuhan 430030, China)
Purpose: To establish a quantitative, sensitive, simple and rapid method for the detection of microRNA(miRNA, miR)and the use of this method in some clinical situations. Method:Take use of the hairpin structure of miRNA, we designed specialized primer for the reverse transcription of corresponding miRNA and amplified the miRNA by using real time PCR. We used this method in detecting miR-513 in human cytotrophoblast cell line - HPT-8 after human cytomegalovirus infection. We also detected miR-145 in colorectal cancer tissues. Results: With our method, fmiRNA could be specifically amplified and the result was repeatable. By using this method, we could observe miR-513 change in HPT-8 cells after different titers human cytomegalovirus infection. We found also that miR-145 changed in colorectal tumors compared with normal colorectal tissues. (P <0.01). Conclusion: Real time PCR can be a very effective method in detecting miRNA. This method has vast utilities in clinical practices.
Fluorescence quantitative PCR; icroRNA; Human cytomegalovirus; Cytotrophoblast; Colon cancer
R-331
A
1009-2854(2011)05-0082-04
2011-04-22
龚文容(1963— ), 男, 湖北襄阳人, 襄樊学院医学院研究员, 博士, 主要研究方向: 分子生物学.
