ABH1融合蛋白表达载体的构建及表达纯化
2011-12-07李红俊翟明霞高艳锋
李红俊,翟明霞,高艳锋#
1)郑州大学生物工程系郑州 450001 2)北京生命科学研究所北京 102206
#通讯作者,男,1980年10月生,博士,副教授,研究方向:肿瘤免疫与抗肿瘤药物,E-mail:gaoyf@zzu.edu.cn
ABH1融合蛋白表达载体的构建及表达纯化
李红俊1,2),翟明霞1),高艳锋1)#
1)郑州大学生物工程系郑州 450001 2)北京生命科学研究所北京 102206
#通讯作者,男,1980年10月生,博士,副教授,研究方向:肿瘤免疫与抗肿瘤药物,E-mail:gaoyf@zzu.edu.cn
ABH1;表达纯化;核酸结合蛋白
目的:构建ABH1重组蛋白原核表达载体及建立ABH1蛋白纯化技术。方法:应用PCR技术从人的cDNA文库扩增出ABH1基因片段,并加入限制性内切酶位点和终止子,进而将其插入到原核表达质粒pET-15b中,构建ABH1/15b原核表达克隆,最后用IPTG诱导其在大肠杆菌BL21(DE3)中表达,用镍柱亲和纯化,离子交换层析及凝胶过滤层析三步法纯化ABH1蛋白,并采用电泳迁移率实验(EMSA)检测所纯化蛋白的DNA结合活性。结果:PCR鉴定和诱导表达阳性结果表明ABH1基因被成功构建入载体pET-15b中,测序分析显示,插入片段全长为1 189 bp,插入位点、终止位点及阅读框都完全正确。经IPTG诱导表达和纯化后,从转入ABH1/15b质粒的BL21菌株中提取并纯化了45 000的ABH1融合蛋白,经EMSA检测ABH1是一个核酸结合蛋白。结论:成功构建了重组ABH1/15b的原核表达载体,最终得到了高纯度蛋白,为进一步研究ABH1的功能和活性机制提供了实验材料。
所有的生物体都拥有多种DNA修复酶来维持它们的遗传信息的完整性[1]。大肠杆菌的AlkB蛋白在α-酮戊二酸(2-oxoglutarate,2OG)和Fe2+存在的情况下,可以羟化DNA和RNA中的1-甲基腺嘌呤(1-MeA)或3-甲基胞嘧啶(3-MeC),生成不稳定的中间产物,裂解释放出甲醛,甲基化的碱基恢复成原来的腺嘌呤和胞嘧啶[2]。人体内有8种AlkB的同源蛋白ABH1~ABH8[3],其中ABH2和ABH3具有与AlkB基本相同的功能,它们具有共同的双重β-折叠核心结构域,但是核酸结合区完全不同[4-6]。ABH1比AlkB蛋白长173个氨基酸(N端71个,C端42个,其余的分布在序列内部)[7]。最新的研究[8]发现ABH1是一个多功能的酶,它具有依赖2OG和Fe2+修复3-MeC的功能,但是活性较弱,且不能修复1-MeA,此外,它还具有一个全新的酶活性——DNA无碱基位点裂解酶活性,而这一功能在所有的DNA修复机制中都有非常重要的作用。因此,作者拟将ABH1基因序列插入到原核表达载体上,构建重组克隆,以表达并纯化ABH1融合蛋白,用于ABH1的功能研究,为ABH1晶体学研究奠定基础。
1 材料与方法
1.1 实验材料 大肠杆菌BL21(DE3)为北京生命科学研究所柴继杰实验室保存,pET-15b表达载体购自Invitrogen公司,人cDNA、LA-Taq、高保真DNA聚合酶PFU购自TaKaRa公司,DNA限制性内切酶购自NEB公司,T4 DNA连接酶购自Promega公司,DNA胶回收试剂盒购自中科瑞泰公司,质粒小提试剂盒购自NCR生物公司。亲和层析介质Ni-NTA His-Bind Resin购自Novagen公司,肝素亲和柱HiTrapTMHeparin HP、离子交换柱Source Q HR15/5和凝胶过滤层析预装柱Superdex 200购自Pharmacia公司。
1.2 引物设计与合成 根据ABH1在GenBank中NM_006020.2基因序列,设计一对引物,扩增1 189 bp完整的阅读框,下划线部分为NdeⅠ和XhoⅠ酶切位点。引物由上海生工生物工程技术服务有限公司合成。P1:5’-GGAATTCATATGGGGAAGATG GCAGCGGCC-3’;P2:5’-GGAATTCTCGAGTCAGCT GTCAGGGTTTAT-3’。
1.3 目的基因的PCR扩增及产物的纯化 首先以人的cDNA为模板,用PCR方法扩增得到ABH1的基因片段。PCR反应体系:10×反应缓冲液2 μL,dNTP(各2.5 mmol/L)0.8 μL,上、下游引物各25 μmol/L,模板0.5 μL,DNA聚合酶0.75 U,补水至20 μL。PCR反应条件:95℃4 min;94℃1 min,52℃30 s,72℃2 min,30个循环;最后72℃延伸10 min。PCR产物经10 g/L琼脂糖凝胶电泳,DNA胶回收试剂盒进行纯化,操作方法按产品说明书进行。
1.4 ABH1/15b克隆载体的构建及鉴定 回收目的基因片段后,用NdeⅠ和XhoⅠ双酶切,10 g/L琼脂糖凝胶电泳,回收酶切产物,将酶切产物与载体pET-15b连接,转化BL21(DE3)感受态细胞。采用双筛选法鉴定ABH1/15b阳性克隆,吸取各个单克隆对应的菌液1 μL作为PCR鉴定的模板进行菌液PCR鉴定。同时于各管菌液中加入1 μL 0.6 mol/L的IPTG后,在37℃ 200 r/min振荡环境中继续培养并进行目的蛋白的诱导表达,SDS-PAGE电泳鉴定。选取并保存双阳性结果的ABH1/15b单克隆,并对阳性结果进行测序,确保基因序列的完全正确。1.5 ABH1蛋白的提取和纯化 将携带有表达ABH1/15b载体的BL21(DE3)在LB培养基中37℃220 r/min培养;当A(600 nm)为0.8时,将摇床温度调低至15℃;当培养基温度平衡至15℃时,加入IPTG至终浓度为0.5 mmol/L,继续培养4 h;收集菌体,加入终浓度为1 mmol/L的蛋白酶抑制剂苯甲基磺酰氟(PMSF);在冰水浴中用超声波破碎,至菌悬液澄清;16 000 r/min高速离心50 min,取上清。按照三步法纯化ABH1蛋白:第一步,镍柱亲和纯化,洗脱缓冲液(25 mmol/L Tris-HCl,50 mmol/L NaCl,250 mmol/L咪唑)洗脱体积为60 mL。第二步,离子交换纯化,利用快速液相色谱,过阴离子交换层析柱,选取峰尖蛋白,利用30 000浓缩管浓缩至约2 mL。第三步,凝胶过滤层析纯化,换用凝胶过滤层析柱,对上一步得到的2 mL蛋白进行最终纯化。
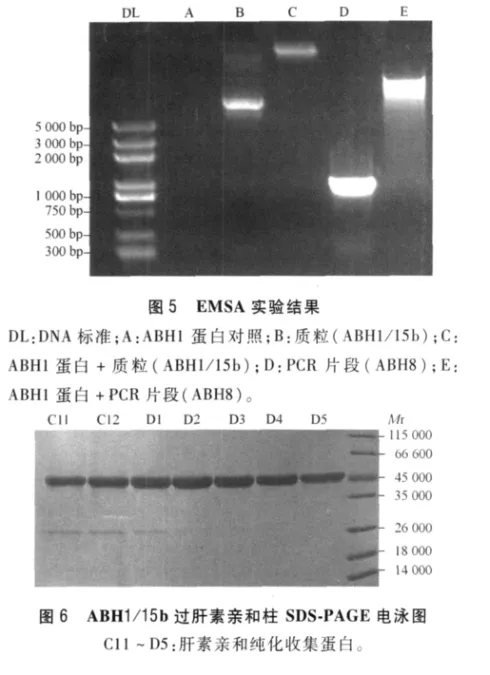
1.6 蛋白功能检测 采用电泳迁移率实验(electrophoretic mobilty shift assay,EMSA)检测其与质粒DNA和PCR片段的结合活性。首先将20 μL 0.1 mmol/L的质粒DNA和PCR片段与0.15 mmol/L的ABH1等体积充分混匀,冰上放置15 min,然后10 g/L琼脂糖凝胶电泳检测蛋白与核酸的相互作用。再采用肝素亲和柱纯化该蛋白。
2 结果
2.1 双筛选法鉴定ABH1/15b阳性克隆 挑选4个单克隆,菌液PCR鉴定结果均为阳性,产物大小为1 189 bp(图1)。诱导表达鉴定显示表达明显且表达量较多,大小约45 000,与其理论相对分子质量43 800接近(图2)。同时,对阳性菌株提取质粒进行测序,测序结果完全正确。ABH1/15b克隆构建成功。
2.2 表达纯化结果 镍柱亲和层析纯化后,蛋白纯度较低;过阴离子交换层析柱后,获得了很好的纯化效果,出峰时的电导为10 mS/cm,峰形比较理想(图3)。凝胶过滤层析柱纯化的蛋白出峰位置在C7、 C8,所纯化的ABH1应该以非聚合形式存在(图4)。

2.3 蛋白功能检测结果 EMSA实验结果显示,ABH1与质粒DNA相互作用明显,与蛋白结合的质粒DNA和PCR产物在凝胶电泳中迁移速度明显变慢(图5)。肝素亲和纯化实验结果显示,ABH1与肝素亲和柱具有较强的亲和能力,需要约30 mS/cm的电导才可以洗脱下来(图6)。
3 讨论
目前,研究蛋白质功能的最佳材料是从天然来源中分离。然而,大多数蛋白质在天然来源中含量很低,从中纯化出大量可用于研究的量非常困难。现代分子生物学技术提供了非常实用的工具,使大量表达纯化重组蛋白成为现实。利用这些方法大量表达并纯化的ABH1蛋白具有高纯度、高均一性,可以用于酶动力学和晶体结构的研究[9-10]。
ABH1在体内主要分布在心脏和骨骼肌组织,这些组织均富含线粒体,预测ABH1可能是一个线粒体核酸甲基化修复酶,与线粒体功能紊乱和衰老有紧密的联系。线粒体DNA损伤及修复方面的研究[11]受到国内外科学家的高度关注。另有研究[12]表明,ABH1在体内与Mrj具有很强的相互作用,Mrj是一个在胎盘表达的蛋白,它通过对组蛋白的去乙酰化调节基因表达,这也提示ABH1可能在基因调控中发挥作用。
根据目前的研究现状,在所有哺乳动物的AlkB同源蛋白中,ABH1是第一个被发现同时具有DNA/ RNA甲基化修复活性和DNA无碱基位点裂解酶活性的蛋白[13]。ABH1全长有389个氨基酸。结构预测显示片段115~300氨基酸为依赖2OG和Fe2+的去甲基化酶活性结构域,可能与去甲基活性有关;蛋白序列比对显示N端1~72氨基酸与其他的哺乳动物AlkB同源物没有明显的同源性,它可能与无碱基裂解酶活性相关[14]。该实验也表明体外表达纯化的ABH1可以与DNA结合。作者下一步将尝试ABH1蛋白单独及与DNA复合的晶体学研究。
[1]Wood RD,Mitchell M,Sgouros J,et al.Human DNA repair genes[J].Science,2001,291(5507):1284
[2]Falnes Pφ,Johansen RF,Seeberg E.AlkB-mediated oxidative demethylation reverses DNA damage in Escherichia coli[J].Nature,2002,419(6903):178
[3]Drablφs F,Feyzi E,Aas PA,et al.Alkylation damage in DNA and RNA-repair mechanisms and medical significance[J].DNA Repair,2004,3(11):1389
[4]Yu B,Edstrom WC,Benach J,et al.Crystal structures of catalytic complexes of the oxidative DNA/RNA repair enzyme AlkB[J].Nature,2006,439(7078):879
[5]Yang CG,Yi C,Duguid EM,et al.Crystal structures of DNA/RNA repair enzymes AlkB and ABH2 bound to dsDNA[J].Nature,2008,452(7190):961
[6]Sundheim O,Vagbo CB,Bjoras M,et al.Human ABH3 structure and key residues for oxidative demethylation to reverse DNA/RNA damage[J].EMBO J,2006,25(4):3389
[7]Falnes Pφ.Repair of 3-methylthymine and 1-methylguanine lesions by bacterial and human AlkB proteins[J].Nucleic Acids Res,2004,32(21):6260
[8]Müller TA,Meek K,Hausinger RP.Human AlkB homologue 1(ABH1)exhibits DNA lyase activity at abasic sites[J].DNA Repair,2010,9(1):58
[9]赵玉霞,杨国俊,章涵,等.幽门螺杆菌UreB-Omp11融合蛋白的表达、纯化与免疫学活性检测[J].郑州大学学报:医学版,2009,44(1):125
[10]王会岩,田海山,赵宏鑫,等.人成纤维细胞生长因子-21基因的克隆表达及蛋白的纯化[J].吉林大学学报:医学版,2010,36(1):81
[11]Westbye MP,Feyzi E,Aas PA,et al.Human AlkB homolog 1 is a mitochondrial protein that demethylates 3-methylcytosine in DNA and RNA[J].J Biol Chem,2008,283(36):25046
[12]Pan Z,Sikandar S,Witherspoon M,et al.Impaired placental trophoblast lineage differentiation in Alkbh1 (-/-)mice[J].Dev Dyn,2008,237(2):316
[13]Law JA,Jacobsen SE.Establishing,maintaining and modifying DNA methylation patterns in plants and animals[J].Nat Rev Genet,2010,11(3):204
[14]Wu SC,Zhang Y.Active DNA demethylation:many roads lead to Rome[J].Nat Rev Mol Cell Biol,2010,11(9):607
Cloning and expression of ABH1 and purification of recombinant protein
LI Hongjun1,2),ZHAI Mingxia1),GAO Yanfeng1)1)Department of Bioengineering,Zhengzhou University,Zhengzhou 450001 2)National Institute of Biological Sciences,Beijing 102206
ABH1;expression and purification;DNA-binding protein
Aim:To construct prokaryotic expression system for expressing ABH1 and establishing purification technology of it.Methods:With human cDNA as template,ABH1 gene fragments were obtained by PCR.The ABH1 cDNA fragment was inserted into the multi-cloning site of pET-15b to construct ABH1/15b.ABH1/15b expression in E.coli BL21 (DE3)was induced by IPTG and the fusion protein was purified by Ni-NTA affinity chromatography,iron exchange chromatography and gel filtration chromatography,and DNA binding activity was tested by electrophoretic mobility shift assay (EMSA).Results:PCR screen and test expression confirmed that the cDNA sequence of ABH1 had been correctly inserted into the multi-cloning site of pET-15b.DNA sequencing showed that in the prokaryotic expression cassette,the inserted sequence,inserted site,stop codon and reading frame of ABH1 were all correct.ABH1(45 000)was successfully extracted and purified from E.coli BL21 after IPTG induction,and the result of EMSA showed that ABH1 was a DNA-binding protein.Conclusion:Prokaryotic expression vector for expression of ABH1 was successfully constructed.The target protein of high purity was obtained.It provided the materials for further investigation of the function and mechanism of ABH1.
Q78
(2010-11-15收稿 责任编辑姜春霞)
