Gemini表面活性剂与DNA在气/液界面上的相互作用
2011-11-30康雪丽陈启斌尚亚卓刘洪来
康雪丽 陈启斌 尚亚卓 刘洪来
(华东理工大学,结构可控先进功能材料及其制备教育部重点实验室,上海200237)
Gemini表面活性剂与DNA在气/液界面上的相互作用
康雪丽 陈启斌*尚亚卓 刘洪来
(华东理工大学,结构可控先进功能材料及其制备教育部重点实验室,上海200237)
在气/液界面上,阳离子表面活性剂可以通过静电作用与阴离子型的脱氧核糖核酸(DNA)分子形成复合膜,并压缩沉积得到LB(Langmuir-Blodget)膜.利用表面压-表面积(π-A)曲线、原子力显微镜(AFM)和石英晶体微天平(QCM)研究了阳离子Gemini表面活性剂([C18H37(CH3)2N+-(CH2)s-N+(CH3)2C18H37]·2Br-,简写为18-s-18,s=3,4,6,8,10,12)与DNA(双链DNA(dsDNA),单链DNA(ssDNA))之间的相互作用,并对18-s-18在不同下相表面的分子面积进行了比较.实验结果表明连接基团和下相的DNA对Gemini表面活性剂在气/液界面上的性质有很大影响.此外,Gemini表面活性剂在界面上对DNA的吸附能力与它们之间的相互作用方式密切相关.
Gemini表面活性剂;脱氧核糖核酸;π-A等温线;原子力显微镜;石英晶体微天平
1 引言
目前,基因转染技术已广泛应用于基因组功能(基因表达调控、基因功能、信号转导和药物筛选研究)和基因治疗研究中.1基因疗法是利用载体将具有生物功能的核酸转移或运送至细胞内并在细胞内维持其生物功能.由于病毒在基因转染过程中的转染效率高,它们通常作为载体使用,但它们也因存在免疫原性、致癌性等弊端而在使用中受到限制.2目前开发新型的非病毒载体及探索其与DNA的相互作用成了基因转染的一个研究热点.一般地,高效的基因转染载体需要满足以下几个条件:①压缩DNA,②保护DNA(避免DNA的降解),③高效地铆接于细胞膜,④穿越细胞膜.DNA不仅是一种具有双螺旋结构的生物大分子,还是一种聚阴离子电解质.目前,已有很多与DNA和阳离子脂质体、3-5互补碱基衍生物6-9及寡核苷酸10,11之间的静电作用和氢键作用相关的报道.其中,DNA与阳离子表面活性剂特别是Gemini表面活性剂之间的相互作用研究对基因转染有着重要的意义,因为后者具有特殊的结构和性能,且用量更少.研究发现, Gemini表面活性剂中连接基团的性质和构型对DNA的压缩影响很大.Gemini双亲分子与DNA之间主要包括静电、氢键和疏水作用.Liu等12-14较为细致地研究了Gemini表面活性剂与DNA在气液界面上的性能,结果发现连接基团和尾链对称性对气液界面上复合膜结构形貌的影响较大.近年来也有利用QCM研究阳离子表面活性剂与DNA相互作用的报道.15,16QCM是一种非常灵敏的质量检测仪器,其测量精度可达纳克级,理论上可以测到的质量变化相当于单分子层或原子层的几分之一.17它具有结构简单、成本低、振动Q值大、灵敏度高、测量精度高等优点而被广泛应用于化学、物理、生物、医学和表面科学等领域中,用以进行气体、液体的成分分析,以及微质量的测量、薄膜厚度的检测等.18-20然而,Gemini表面活性剂与DNA的相互作用机制仍然不是十分清楚.本文利用Langmuir膜天平、AFM和QCM研究了18-s-18/DNA复合膜的气/液界面性质,考查了二者之间的相互作用.
2 实验部分
2.1 实验试剂与仪器
所用试剂有:季铵盐阳离子型Gemini表面活性剂,简写为18-s-18,按照Zana等21的方法合成;鲑鱼精DNA使用前未进一步处理(Sigma),固体钠盐,长度为4500碱基对(bp),分子质量约为2997000 g· mol-1,磷酸根所占比重为2.84%(w);溴化钠,分析纯,购于上海凌峰化学试剂有限公司;氯仿,分析纯,上海化学试剂有限公司生产;实验用水为超纯水(电阻率为18.2 MΩ·cm);实验所用铺展液为表面活性剂的氯仿溶液,浓度为5.0×10-4mol·L-1.
所用仪器有:D612型LB拉膜仪(NIMA,英国),原子力显微镜(AJ-Ш,中国),CHI440A系列石英晶体微天平(上海).
2.2 实验方法
2.2.1 DNA溶液的紫外光谱测定
为了确定在实验中DNA的构型,我们对DNA溶液进行紫外表征.准确称取2.07 mg的DNA定溶于500 mL容量瓶中,标记为①号瓶;再次称取2.01 mg的DNA溶解于另一500 mL的容量瓶并加入溴化钠,使溴化钠的浓度为10 mmol·L-1,标记为②号瓶.两瓶DNA溶液过夜,以Shimadzu UV-3100测其紫外吸收光谱.
2.2.2 表面压-表面积(π-A)等温线测定
20°C时,准确量取50 μL的18-s-18氯仿溶液铺展于气/液界面,静置40 min后开始压缩,压缩速率为10 cm·min-1.
2.2.3 LB膜的制备及AFM表征
LB膜的制备.将干净的云母片浸入下相中,然后滴加50 μL的18-s-18氯仿溶液,在20 mN·m-1的表面压下采用垂直沉积法制得LB膜,控制下相温度为20°C、提拉速率为5 mm·min-1.
AFM表征.待LB膜干燥后,使用长100µm,弹性常数为48 N·m-1的三角微悬臂探针,在室温环境中,利用原子力显微镜在轻敲模式下进行扫描,可得LB膜的表面形貌图.本文中所示图像均为高度图及沿形貌图中直线的横截面图.
2.2.4 石英晶体微天平表征
对于刚性沉积物,QCM的谐振频率变化Δf正比于工作电极上沉积物的质量改变Δmf.通过Sauerbrey方程可得到QCM电极表面的质量变化:22

式中f0为石英晶体的基频,n为泛频数,ρq和hq分别是石英晶体的密度和厚度,C=ρqhq/nf0.对于一台特定的石英晶体微天平,C为常数.本实验中C=1.34× 10-9g,故Δmf=-1.34×10-9Δf.
QCM测定.先测得干净石英晶片的基频f0,待将单层膜或复合膜转移并干燥后,再测得其频率f.具体过程如下:在纯水表面上,记录18-s-18表面上表面压(π)为20 mN·m-1时的分子面积A;将干净的石英晶片浸入下相浓度为4 mg·L-1的DNA溶液,并慢慢滴加50 μL 18-s-18的氯仿溶液,等待40 min后开始压缩;以A为目标面积(DNA的加入会改变相应面积的表面压,为了与纯表面活性剂进行对比, QCM实验没有以20 mN·m-1作为目标压力),压缩速度为10 cm·min-1,拉膜速度为2 mm·min-1.由此可得到晶片上单层膜和复合膜的质量:Δmf=-1.34× 10-9Δf=-1.34×10-9×(f-f0).从复合膜中减去表面活性剂的量就可得到其中DNA的质量,每个样品测三次,取平均值.
3 结果与讨论
3.1 溶液中DNA构型的确定
Rosa等23研究了平均长度为700 bp DNA的溶液性质,结果发现,当浓度较低时,超纯水溶液中DNA是以单链形式存在的,但当加入少量NaBr(1 mmol·L-1)后,分解的两条DNA单链便会重新结合形成双螺旋结构.为了考查Gemini表面活性剂与单链DNA(ssDNA)和双链DNA(dsDNA)之间的相互作用,首先利用紫外-吸收光谱确定了溶液中DNA的构型.在DNA浓度较低、溶液中离子强度较小时, DNA分子很容易变性并进而分解为单链,导致DNA状态及其电荷密度和柔韧性发生变化.这就是说少量盐即可稳定DNA的双螺旋结构.通常,变性的双螺旋DNA在260 nm处的紫外吸收值会增加,即生产“增色效应”.当其完全分解为单链后,吸收值可达到最大,此时的A260nm较双链DNA的值可增加40%.DNA溶液在加NaBr前后的紫外吸收光谱如图1所示.
在DNA溶液中加入10 mmol·L-1NaBr时,A260nm= 0.059;未加NaBr的DNA溶液中,A260nm=0.084.后者的吸收值较前者增加了42%.这表明在浓度为4 mg·L-1、不加NaBr的溶液中,DNA是以单链形式存在的,加入10 mmol·L-1NaBr后,DNA是双链螺旋结构.

图1 DNA水溶液在不同NaBr浓度下的紫外吸收光谱Fig.1 UV absorption spectra of DNAsolutions withdifferent NaBr concentrations
3.2 π-A等温线
20°C时,季铵盐型Gemini表面活性剂18-s-18 (s=3,4,6,8,10,12)在ssDNA和dsDNA溶液表面上的π-A等温线如图2所示.
由图2可看出,尽管Gemini连接基团的长度有所不同,但复合膜π-A等温线的形状却十分相似.随连接基团碳原子数目的增加,π-A曲线整体向右侧移动.这说明在同一表面压下,连接基团越大,每个分子所占的平均分子面积越大.在二维体系的压缩过程中,如果处于相转变区域,等温线就会出现一个明显的平台,也就是说表面压几乎不变.图2中的等温线并没有出现这一平台,这表明复合膜在压缩过程中没有出现明显的相转变区,直至其破裂.此外,复合膜的崩溃压随连接基团碳原子数目的增加也有一定程度的降低,这是因为随着s的增大,复合膜的稳定性越来越差.

图2 20°C时18-s-18(s=3,4,6,8,10,12)在不同下相的π-A等温线Fig.2 π-Aisotherms of 18-s-18(s=3,4,6,8,10,12)on the surfaces of different subphases at 20°C(a)4 mg·L-1ssDNAsolution;(b)4 mg·L-1dsDNAsolution; ssDNA:single-strand DNA;dsDNA:double-strand DNA
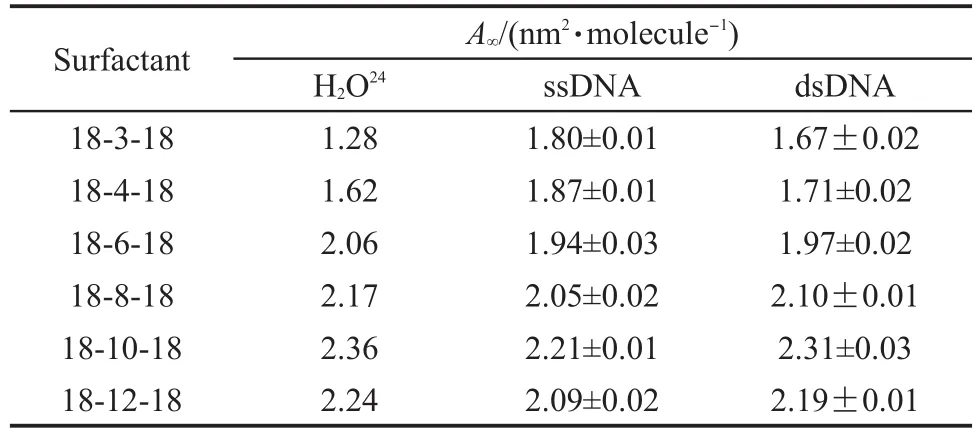
表1 18-s-18在纯水、ssDNA、dsDNA下相表面的极限分子面积Table 1 Limiting molecular areas of 18-s-18 on the surfaces of pure water,ssDNAand dsDNAsubphases
在π-A等温线中,沿曲线斜率最大处作切线,并反向延长至π=0 mN·m-1,可得极限分子面积,A∞.将18-s-18、18-s-18/ssDNA和18-s-18/dsDNA(s=3,4,6, 8,10,12)的极限分子面积列于表1.
由表1可看出,DNA的加入对18-s-18在界面上的分子面积有较大影响:s=3,4时,A∞,H2O<A∞,DNA;当s≥6时,A∞,H2O>A∞,DNA.在DNA加入下相前,我们已探讨了Gemini表面活性剂在气、液界面上的结构.24,25对于18-s-18体系,当连接基团s≤6时,连接基团线性平躺于界面上,随着连接基团长度的继续增加,链的柔软性和疏水排斥作用增强,会使它们产生逃离水侧界面的趋势而嵌入到气相一侧并形成弧形甚至是倒U型构象.在较高表面压下,18-s-18难于形成均匀的单分子膜,而倾向于形成表面胶束和多层聚集体,但是除了少量表面胶束和多层聚集体之外,多数分子仍然平躺于界面上.一方面,当Gemini与DNA在气、液界面上形成复合膜时,DNA分子可以进入表面活性剂的单分子层,使其分子面积增大.26另一方面,Gemini表面活性剂的分子面积主要受分子内头基和相邻分子的间距的影响,它们主要取决于头基之间的静电排斥作用.当溶液含有DNA时,Gemini表面活性剂的头基与磷酸根相互作用后可降低其静电排斥作用,有利于分子面积的减少.在18-3-18与18-4-18分子中,连接基团具有相对刚性,呈短棒状,有利于DNA分子进入单分子层.其次,由于连接基团具有一定的刚性,分子内头基的间距受静电作用的影响较小,其变化不大.因此当连接基团s=3,4时,分子面积的增加主要是由于DNA分子进入了单层膜,而致使单分子膜更扩张.当s≥6时,头基与磷酸根之间的静电作用更利于连接基团的弯曲,甚至使其形成倒“U”字形的结构,从而使得分子内的头基间距降低,分子排列更加紧密,因而分子面积减小.
由表1还可看出,在ssDNA和dsDNA溶液上的Gemini分子面积也存在一定差别:当s=3,4时, A∞,ssDNA>A∞,dsDNA;当s≥6时,A∞,ssDNA<A∞,dsDNA.其根本原因在于dsDNA是双螺旋且相对刚性的分子,而ssDNA是相对柔性的分子.在溶液中,双螺旋结构DNA分子中两个相邻磷酸之间的距离约为0.77 nm.当DNA分解为单链时,其则由刚性分子变为柔性分子,由于骨架的弯曲而利于相邻两个磷酸之间的距离变小.因此,对于ssDNA,具有较短连接基团(s=3,4)的Gemini表面活性剂的两个头基也有机会与两个相邻的磷酸根发生作用.对于dsDNA而言,主要是以取代表面活性剂反离子的形式而进入单层膜中的.与dsDNA相比,ssDNA的碱基为支链,且相对疏水并暴露在外,因此其碱基倾向于插入单分子层的尾链区域.当s=3,4时,复合膜中ssDNA的分子面积比较大是由于较多的ssDNA分子进入到了单分子膜中;而s≥6时,由于连接基团和ssDNA分子都是柔性的,易发生弯曲,从而使其复合膜的分子面积较dsDNA的小.其中,前者可以从3.4节的QCM得到证实.
3.3 AFM表征
图3给出了20°C时在20 mN·m-1下18-s-18/ss-DNA和18-s-18/dsDNA复合膜的AFM图像.在图3 (a-f)中,18-s-18/ssDNA复合膜的表面结构都是纤维结构,但纤维的高度却不等,大约在1.0-1.7 nm之间,且这些纤维的高度和宽度均随着连接基团的增加而增加.当连接基团较小时,复合膜的纤维结构具有相互平行的趋势,而随着连接基团的增加,复合膜的形貌变成类似于树枝状的结构.图3(A-F)给出了18-s-18/dsDNA复合膜的表面形貌.其结构大致可分为三类,相互平行的纤维结构、相对无规的纤维结构及含少量纤维的片状结构.在图3(A,B)中,纤维结构明显彼此平行,高度约4 nm.在18-6-18/dsDNA复合膜中,纤维结构的量进一步减少,且出现了明显的树枝状结构,高度为4-6 nm.其中,纤维结构虽倾向于同一个方向排列,但是它们由支链连接起来而形成了网络结构,如图3C所示.当s≥8时,除了少量的纤维结构,复合膜主要形成了片状结构(图3(D-F)),且片状结构的高度大约为1.3-1.4 nm.

图3 复合膜在20 mN·m-1表面压下的AFM图Fig.3 AFM images of complex at surface pressure of 20 mN·m-1 (a-f)18-s-18/ssDNA,s:(a)3,(b)4,(c)6,(d)8,(e)10,(f)12;(A-F)18-s-18/dsDNA,s:(A)3,(B)4,(C)6,(D)8,(E)10,(F)12

表2 18-s-18/DNA复合膜的QCM结果Table 2 QCM measurements for 18-s-18/DNAcomplex monolayer
通常情况下,表面活性剂与DNA分子的作用要经过两个阶段:①表面活性剂通过静电吸引作用与下相中DNA分子结合,在低压时,疏水尾链杂乱地躺在水面上;②随着压力的增加,碳氢链开始通过疏水作用(分子间和分子内疏水作用)聚集.14在双螺旋DNA分子中,两个相邻磷酸根之间的距离是一定的;同时,还存在大沟和小沟,且两者的宽度分别为2.2和1.2 nm.因此,为了与dsDNA分子的静电作用达到最大,表面活性剂分子将在界面上发生重排.当s=3,4时,连接基团的长度只有0.52和0.65 nm,小于dsDNA中相邻两个磷酸之间的距离(0.77 nm),因此Gemini表面活性剂中只有一个头基作用于一个dsDNA分子上,而另外一个头基则悬挂于dsDNA分子外.在压缩过程中,另一个头基很容易在任意方向上与另一条dsDNA分子作用.当s=6时,连接基团的长度为0.90 nm,可以与dsDNA中相邻磷酸根的间距匹配,这使得18-6-18分子的两个头基可以作用于dsDNA分子中的同一条核苷酸链上,且尾链可以指向水面上方的任意方向.因此当s≤6时,通过Gemini表面活性剂的静电和疏水作用,dsDNA在提拉时可同时出现横向聚集和侧向堆积,形成的纤维结构具有较高的高度(4-6 nm).当s≥8时,18-s-18中两个头基可同时作用于dsDNA分子中两条互补的核苷酸链上.高压时成膜分子在疏水作用下进行横向聚集,形成片状结构(高度为1.4 nm).在18-s-18/ssDNA体系中,表面活性剂的头基与磷酸根通过静电作用,碱基与尾链之间可发生疏水作用.图3 (a-f)中的纤维结构可归因于这种疏水作用,且连接基团越长,疏水作用越强,形成纤维越宽.
当s较小时,在18-s-18/dsDNA体系中纤维结构的高度比较大(4-6 nm),而s≥8时,则出现平台状结构,此时其高度只有1.3-1.4 nm.在此需要指出的是,dsDNA分子的钠盐在湿度为95%时的直径为2.0 nm,因此在18-s-18/dsDNA的LB膜中,DNA结构性质还有待进一步研究.
3.4 表面活性剂/DNA复合膜的QCM表征
20°C时用QCM分别测定了dsDNA和ssDNA作用于18-3-18和18-10-18单分子膜上的量,结果列于表2中.
对于在18-3-18/dsDNA和18-10-18/dsDNA的复合膜中,DNA的质量分别为62.98和44.22 ng,也就是1 mol的18-3-18和18-10-18可分别结合约1135和923 g的dsDNA分子.这表明具有较短连接基团的Gemini表面活性剂结合DNA的量较大.当s=3时,连接基团的长度为0.52 nm,小于双螺旋DNA中两个相邻磷酸根之间的距离(0.77 nm), 18-3-18分子只能有一个头基作用于一个dsDNA分子,而另一个头基可作用于另一个dsDNA分子;当s=10时,Gemini表面活性剂的两个头基倾向于作用在同一个dsDNA分子上.因此,在相同情况下,18-3-18对dsDNA的吸附量较18-10-18高.这也说明连接基团在Gemini表面活性剂与DNA分子的相互作用中起到了非常重要的作用.
对于柔性ssDNA分子,其在18-3-18/ssDNA和18-10-18/ssDNA复合膜中的质量分别为855和783 g.一方面,二者的值较为接近,这是因为ssDNA是柔性分子,相邻两个磷酸之间的距离有所减小,即使是在连接基团s=3时,18-3-18的两个头基也可以作用于一个ssDNA分子,因此与18-10-18对ssDNA的吸附量相差不大.另一方面,对于同一表面活性剂,它们结合dsDNA分子的能力似乎大于ssDNA的,即1 mol的18-3-18可以结合1135 g dsDNA分子,而只能结合 855 g ssDNA;1 mol的18-10-18可以吸附923 g的dsDNA,而只能吸附783 g的ssDNA.然而,就分子数量而言,18-3-18结合的ssDNA数量是dsDNA的1.5倍;18-10-18是1.7倍.由此可见,ssDNA更易于与Gemini表面活性剂结合.这也证实了极限分子面积的结果.
4 结论
利用π-A等温线、AFM和QCM研究了连接基团及ds/ssDNA对18-s-18/DNA复合膜在气/液界面上结构和性质的影响.Gemini表面活性剂中连接基团的性质会显著影响到复合膜的性质,连接基团的大小会产生不同的构象,从而影响到Gemini与DNA的作用方式及复合物的形貌;连接基团越大,复合物的疏水作用越强,它们更容易形成较宽的聚集体.此外,在含有DNA的下相溶液中,DNA分子即可以插入单分子层,使分子面积增大,又会屏蔽两个头基之间的静电斥力,使得表面活性剂排列得更加紧密.然而,由于dsDNA是刚性分子,而ssDNA是柔性分子,它们与表面活性剂间的作用有所不同,前者与DNA之间主要是静电相互作用,后者除静电作用外,还存在碱基与尾链的疏水作用.
(1) Lisa,K.;Marcel,C.P.J.Colloid Interface Sci.2002,252,290.
(2) Crystal,R.G.Science 1995,270,404.
(3) Okahata,Y.;Kobayashi,T.;Tanaka,K.Langmuir 1996,12, 1326.
(4)Ijiro,K.;Shimomura,M.;Tanaka,M.;Nakamura,H.;Hasebe, K.Thin Solid Films 1996,284-285,780.
(5) Kago,K.;Matsuoka,H.;Yoshitome,R.;Yamaoka,H.;Ijiro,K.; Shimomura,M.Langmuir 1999,15,5193.
(6) Shimomura,M.;Nakamura,F.;Ijiro,K.;Taketsuna,H.;Tanaka, M.;Nakamura,H.;Hasebe,K.J.Am.Chem.Soc.1997,119, 2341.
(7)Miao,W.G.;Du,X.Z.;Liang,Y.Q.Langmuir 2003,19,5389.
(8)Wang,Y.C.;Du,X.Z.;Miao,W.G.;Liang,Y.Q.J.Phys. Chem.B 2006,110,4914.
(9) Li,C.;Huang,J.G.;Liang,Y.Q.Langmuir 2000,16,7701.
(10) Haruta,O.;Matsuo,Y.;Hashimoto,Y.;Niikura,K.;Ijiro,K. Langmuir 2008,24,2618.
(11)Kim,T.W.;Kim,Y.J.;Chung,H.;Kwon,I.C.;Sung,H.C.; Jeong,S.Y.Journal of Controlled Release 2002,82,455.
(12) Chen,X.D.;Wang,J.B.;Shen,N.;Luo,Y.H.;Li,L.;Liu,M. H.;Thomas,R.K.Langmuir 2002,18,6222.
(13) Chen,X.D.;Li,L.;Liu,M.H.Langmuir 2002,18,4449.
(14) Chen,X.D.;Wang,J.B.;Liu,M.H.J.Colloid Interface Sci. 2005,287,185.
(15)Ramakrishnan,V.;D′Costa,M.;Ganesh,K.N.;Sastry,M. J.Colloid Interface Sci.2004,276,77.
(16) Ebara,Y.;Mizutani,K.;Okahata,Y.Langmuir 2000,16,2416.
(17)Wang,C.;Wang,Z.Y.;Ke,W.Corrosion Science and Protection Technology 2008,20,367.[汪 川,王振尧,柯 伟.腐蚀科学与防护技术,2008,20,367.]
(18) Dmitri,I.;Ihab,A.H.;Plamen,A.;Ebtisam,W.Biosensors and Bioelectronics 1999,14,599.
(19) Renee,L.B.;Eric,J.J.;Jefrey,J.R.Talanta 1998,46,1223.
(20)Ma,H.W.;He,H.W.;Zhu,Z.Q.;Fan,C.H.Chinese Journal of Analytical Chemistry 2009,37,69.[马宏伟,何建安,朱志强,樊春海.分析化学,2009,37,69.]
(21) Zana,R.;Benrraou,M.;Rueff,R.Langmuir 1991,7,1072.
(22) Liu,G.M.;Zhang,G.Z.Polymer Bulletin 2008,8,174. [刘光明,张广照.高分子通报,2008,8,174.]
(23)Rosa,M.;Dias,R.;Da Graca,M.M.;Lindman,B. Biomacromolecules 2005,6(4),2164.
(24) Chen,Q.B.;Zhang,D.Z.;Li,R.;Liu,H.L.Thin Solid Films 2008,516,8782.
(25) Chen,Q.B.;Liang,X.D.;Wang,S.L.;Xu,S.H.;Liu,H.L.; Hu,Y.J.Colloid Interface Sci.2007,314,651.
(26)Antipina,M.N.;Schulze,I.;Dobner,B.;Langner,A.; Brezesinski,G.Langmuir 2007,23,3919.
November 18,2010;Revised:March 5,2011;Published on Web:April 20,2011.
Interaction between Gemini and DNA at the Air/Water Interface
KANG Xue-Li CHEN Qi-Bin*SHANG Ya-Zhuo LIU Hong-Lai
(Key Laboratory for Advanced Materials,East China University of Science and Technology,Shanghai,200237,P.R.China)
Monolayers may be obtained by an electrostatic force between cationic surfactants and anionic electrolyte deoxyribonucleic acid(DNA)molecules,and a corresponding Langmuir-Blodgett(LB) complex monolayer can be fabricated by compression and deposition of the monolayer at the air/water interface.In this work,the interaction between cationic Gemini surfactants([C18H37(CH3)2N+-(CH2)s-N+(CH3)2-C18H37]·2Br-,abbreviated 18-s-18,s=3,4,6,8,10,12)and double-strand DNA(dsDNA)/single-strand DNA (ssDNA)was investigated by surface pressure-surface area(π-A)isotherms,atomic force microscope (AFM),and Quartz crystal microbalance(QCM).Moreover,the limiting molecular areas of 18-s-18 on different subphases were compared.We found that the spacer and the subphase greatly influence the properties of the Gemini surfactants at the air/water interface.In addition,we conclude that the adsorption capacity of the Gemini surfactants with DNA is closely related to their interaction modes.
Gemini surfactant;Deoxyribonucleic acid;π-A isotherm;Atomic force microscope; Quartz crystal microbalance
O648
∗Corresponding author.Email:qibinchen@ecust.edu.cn;Tel:+86-21-64252767.
The project was supported by the National Natural Science Foundation of China(20806025,20706013),Creative Team Development Project of
Ministry of Education of China(IRT0721),Scientific Research Foundation for the Returned Overseas Chinese Scholars,State Education
Ministry and Fundamental Research Funds for the Central Universities,China.
国家自然科学基金(20806025,20706013),长江学者创新团队(IRT0721),教育部留学回国人员科研启动基金和中央高校基本科研业务费资助
