金属螯合物印迹聚邻苯二胺膜的电化学合成及表征
2011-11-30汪莲艳吴福全顾仁敖姚建林张海禄邓宗武
汪莲艳 陆 枫 吴福全 顾仁敖 姚建林 张海禄 邓宗武,*
(1中国科学院苏州纳米技术与纳米仿生研究所,江苏苏州215123;2苏州大学材料与化学化工学部,江苏苏州215123; 3苏州市环境监测中心站,江苏苏州215004)
金属螯合物印迹聚邻苯二胺膜的电化学合成及表征
汪莲艳1陆 枫2吴福全3顾仁敖2姚建林2张海禄1邓宗武1,*
(1中国科学院苏州纳米技术与纳米仿生研究所,江苏苏州215123;2苏州大学材料与化学化工学部,江苏苏州215123;3苏州市环境监测中心站,江苏苏州215004)
以邻苯二胺(o-PD)为功能单体,乙二胺四乙酸铜离子螯合物(Cu(II)-EDTA)为模板分子,利用循环伏安法(CV)合成了Cu(II)-EDTA分子印迹聚合物(MIPs).通过紫外-可见(UV-Vis)光谱、X射线光电子能谱(XPS)、差分脉冲伏安法(DPV)、石英晶体微天平(QCM)等手段对合成的聚合物进行了表征.UV-Vis光谱分析表明当溶液的pH≥5.0时有利于邻苯二胺电聚合形成聚合度较高的聚合物;XPS结果证明Cu(II)-EDTA螯合物被成功地包覆在聚合物膜中,且推断出模板分子和聚合物之间可能主要靠氢键相互作用;DPV实验结果证明模板分子能够被有效洗脱;QCM的测试结果表明此方法合成的Cu(II)-EDTA印迹聚合物膜对Cu(II)-EDTA具有良好的响应度.
邻苯二胺;螯合物;分子印迹聚合物;循环伏安法;石英晶体微天平
1 引言
分子印迹聚合物(MIPs)模拟了生物界抗体与抗原以及酶与底物之间的相互作用,它的合成方法是将模板分子、功能单体、交联剂及引发剂在适当的溶剂中混合,模板分子和功能单体通过共价键或非共价键相互作用,然后功能单体和交联剂发生聚合,将模板分子固定在聚合物的三维网状结构中,除去模板分子后,聚合物中便留下了与模板分子空间结构及结合位点相匹配的孔穴,这样合成的聚合物对模板分子具有高亲和力和高选择性.1-4由于分子印迹聚合物具有构效预定性、特意识别性和广泛实用性等优点,使之在化学仿生传感器、5-7色谱分离、8固相萃取、9,10天然抗体模拟、11,12模拟酶催化、13控缓释药物14等研究领域得到广泛应用.
目前关于金属离子印迹聚合物的研究报道有很多,15-17但由于单个金属离子体积小,结构特征不明显,所以文献中一般都选用能和金属离子形成配位键的功能单体,使功能单体和金属离子通过配位键形成特定的结构.此外,很多金属离子具有较高的电化学活性,所以不宜利用电化学方法来合成金属离子印迹聚合物.本文利用螯合剂乙二胺四乙酸盐(EDTA)与铜离子形成螯合物(Cu(II)-EDTA),降低了铜离子的电化学活性,然后以Cu(II)-EDTA螯合物为模板,采用循环伏安法原位合成了Cu(II)-EDTA印迹聚合物膜,并对合成的聚合物进行了表征.
2 实验部分
2.1 试剂与仪器
邻苯二胺(分析纯,阿拉丁试剂有限公司)使用前重结晶提纯,乙二胺四乙酸二钠盐(EDTA)、硫酸铜、硫酸钠、冰醋酸、乙酸钠、硫酸等试剂均为分析纯(国药集团化学试剂有限公司),实验用水为Milli-Q超纯水(18.2 MΩ·cm,密理博(上海)贸易有限公司,美国).
CHI 440电化学石英晶体微天平(上海辰华仪器有限公司);8 MHz石英晶体金盘电极(晶体直径14 mm,金盘电极直径5 mm,上海辰华仪器有限公司)或ITO导电玻璃(南玻集团)为工作电极,铂丝电极为辅助电极,饱和KCl甘汞电极(SCE)为参比电极; Sartorius PB-10 pH计(赛多利斯科学仪器有限公司,德国)用于测量溶液的pH值;Lambda-25紫外-可见分光光度计(Perkin Elmer,美国),X射线光电子能谱仪(岛津KratosAXIS Ultra DLD,日本).
2.2 实验方法
2.2.1 工作电极的处理
石英晶体金盘电极在使用前用Piranha溶液(30%H2O2和浓硫酸以1:3体积比混合)浸泡5 min,然后用超纯水冲洗干净立即使用.ITO导电玻璃分别用乙醇、丙酮和超纯水超声清洗.当用紫外-可见(UV-Vis)光谱和X射线光电子能谱(XPS)表征电极表面的聚合物膜时,ITO导电玻璃作为基底.
2.2.2 电解质溶液的选择
由于醋酸盐缓冲液的可调pH值范围较窄,所以在研究溶液的pH值对邻苯二胺电聚合的影响时使用的是不同pH值的H2SO4+0.2 mol·L-1Na2SO4作为电解质溶液;而Cu(II)-EDTA螯合物在弱酸盐缓冲液中更稳定,所以在制备Cu(II)-EDTA印迹聚合物时我们使用0.2 mol·L-1的醋酸盐缓冲液作为电解质溶液.
2.2.3 印迹聚合物膜的制备
按螯合比1:1配制0.08 mol·L-1的Cu(II)-EDTA螯合物溶液,溶剂为0.2 mol·L-1的醋酸盐缓冲液(pH 6.0),然后称取一定量的邻苯二胺溶于上述溶液中,使邻苯二胺的浓度为0.01 mol·L-1.电化学聚合采用三电极体系,循环伏安扫描范围为0-0.8 V,扫描段数为30(相当于15圈),扫描速率为30 mV·s-1.聚合完成后得到的聚合物膜用0.2 mol·L-1的醋酸溶液浸洗2 h,再用超纯水淋洗1 min以除去包覆在聚合物中的模板分子.在同样的实验条件下,不加入Cu(II)-EDTA制备非印迹膜作比较.
2.2.4 石英晶体微天平检测方法
将修饰了Cu(II)-EDTA印迹聚合物膜的石英晶体置于50 mL背景液中(pH 6.0,0.2 mol·L-1的醋酸盐缓冲液),对背景液施加恒速磁力搅拌.等频率变化5 min内小于1 Hz时,记录的振动频率为f0,然后用微量注射器往背景液中注入一定量的Cu(II)-EDTA标准溶液,继续监测振动频率,直至达到稳定值fi,则整个过程的频率变化Δf=fi-f0.根据Sauerbray方程,18,19石英晶体的振动频率变化和吸附在其表面的物质的质量变化呈线性关系:

其中,Δf为石英晶体的振动频率变化(Hz),f为石英晶体的固有振动频率(本实验使用的是8 MHz的石英晶体),Δm为质量变化(g),A为金电极的面积(0.196 cm2),ρq为石英晶体的密度(2.684 g·cm-3),μ为石英晶体的剪切模量(2.947×1010g·cm-1·s-2).利用这种线性关系,就可以通过监测石英晶体振动频率的变化来获得Cu(II)-EDTA印迹聚合物膜和Cu(II)-EDTA的相互作用信息.
3 结果与讨论
3.1 Cu(II)-EDTA的电化学稳定性
图1为在0.2 mol·L-1的醋酸盐缓冲溶液(pH 6.0)中铜离子和EDTA螯合前后在金电极上的CV曲线.由图1可以看出,游离的铜离子在-0.4-0.9 V之间有明显的氧化还原峰,而当铜离子和EDTA形成螯合物后,氧化还原峰消失,说明Cu(II)-EDTA螯合物的电化学窗口很宽,从而抑制了铜离子对邻苯二胺电聚合的干扰.
3.2 邻苯二胺电聚合
图2为邻苯二胺在不同pH值的H2SO4+0.2 mol·L-1Na2SO4溶液中在金电极上电聚合的CV曲线.如图2所示,溶液的pH值对邻苯二胺电聚合的CV曲线有显著的影响,这和文献20,21中的报道相似.在pH=1.0的溶液中,当电位从0 V到0.80 V时,在0.55 V有一氧化峰,且当电位往回扫时,无还原峰出现,说明邻苯二胺发生了不可逆氧化.随着扫面段数的增加,氧化峰电位逐渐正移,且氧化电流逐渐减小,说明形成的聚合物导电性差,抑制了反应进一步发生.当溶液的pH值从1.0依次增大至3.0、5.0、7.0时,邻苯二胺的氧化电位从0.55 V依次减小至0.45、0.34、0.32 V,且在扫描过程中氧化电流急剧减小.这是因为在低pH值溶液中,邻苯二胺被质子化,导致它较难被氧化,所以需要较高的氧化电位;而在较高pH值溶液中,由于H+浓度低,缺乏质子掺杂,所以得到的聚合物电活性和导电性都很差,22在聚合物的循环伏安曲线中表现出氧化电流急剧减小.
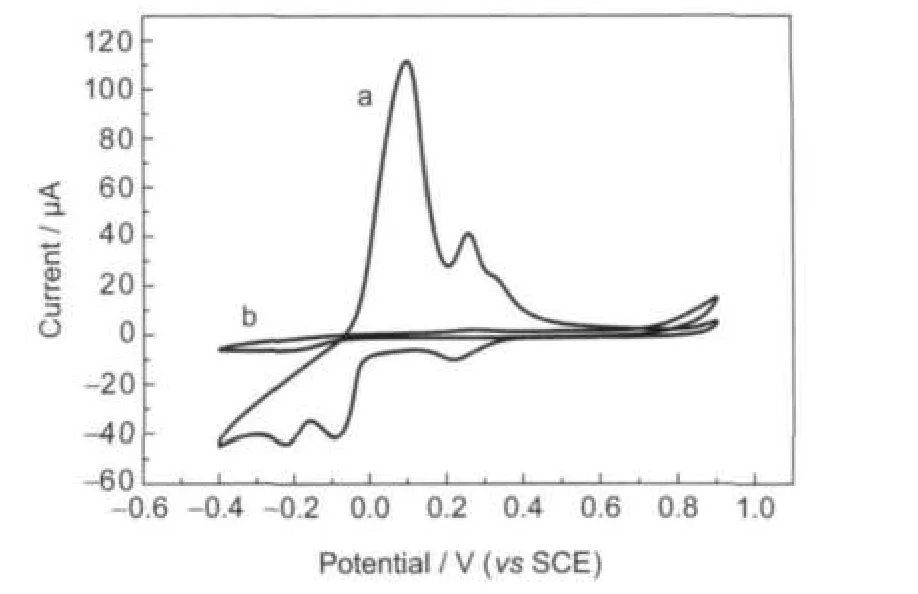
图1 铜离子(a)和Cu(II)-EDTA螯合物(b)在0.2 mol·L-1的醋酸盐缓冲溶液(pH 6.0)中在金电极上的循环伏安曲线Fig.1 Cyclic voltammograms of Cu(II)(a)and Cu(II)-EDTAchelate(b)on theAu electrode in 0.2 mol·L-1acetate buffer solution(pH 6.0)scan rate:30 mV·s-1
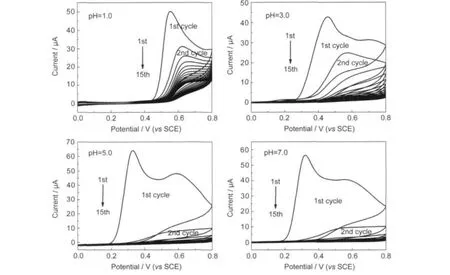
图2 邻苯二胺在不同pH值的H2SO4+0.2 mol·L-1Na2SO4溶液中在金电极上电聚合的CV曲线Fig.2 Cyclic voltammograms of o-phenylenediamine(o-PD)polymerization on theAu electrode in H2SO4+0.2 mol·L-1 Na2SO4aqueous solutions with different pH valuesscan rate:30 mV·s-1
为了进一步研究溶液pH值对邻苯二胺电聚合的影响,还需对聚合物膜及残留在电解质溶液中的低聚物进行表征.图3为邻苯二胺在不同pH值的H2SO4+0.2 mol·L-1Na2SO4溶液中电聚合生成的可溶性低聚物的紫外-可见光谱.从图3中可以看出,当溶液pH值从1.0依次增大至3.0、5.0、7.0时,低聚物的吸收峰从487 nm依次蓝移至453、446、418 nm,说明随着pH值的增大,残留在溶液中的低聚物的聚合度逐渐降低.图4为在不同pH溶液中沉积到ITO电极上的高聚物膜的固体UV-Vis光谱,图中分别在353和500 nm附近出现了两个吸收带,分别归属于图5中邻苯二胺的两种结构:线性聚苯胺类结构和梯形吩嗪环结构.23后者的吸收峰随着溶液的pH值从1.0增大至3.0和5.0时,从490 nm依次红移至500和510 nm,且当pH大于5.0后,不再变化.这和低聚物吸收峰随pH的变化趋势相反.聚合物膜吸收峰红移是由于聚合物共轭程度增大,说明聚合度高,结构更稳定,这有利于对模板分子的包覆.
综上所述,当溶液pH≥5时,更有利于在电极表面形成高聚合度的聚邻苯二胺,而使聚合度较低的低聚物残留在溶液中,表现在低聚物的吸收峰随溶液pH值增大而蓝移.因此在制备Cu(II)-EDTA印迹聚邻苯二胺时所用的醋酸盐缓冲液的pH值定为6.0.此外我们也比较了电解质组成对聚合的影响,发现邻苯二胺在相同pH值的醋酸盐缓冲液、硫酸钠溶液和对甲基苯磺酸钠溶液中聚合时的电化学过程以及聚合产物的紫外-可见光谱均无明显差别,说明相同pH值的溶液对邻苯二胺的电聚合起到的效果相同.

图3 邻苯二胺在不同pH值的H2SO4+0.2 mol·L-1Na2SO4溶液中电聚合生成的低聚物的紫外-可见光谱Fig.3 UV-Vis spectra of oligomers obtained from the electropolymerization of o-PD in H2SO4+0.2 mol·L-1 Na2SO4aqueous solutions with different pH values

图4 在不同pH值的H2SO4+0.2 mol·L-1Na2SO4溶液中沉积于ITO导电玻璃上的聚邻苯二胺膜的固体紫外-可见光谱Fig.4 UV-Vis spectra of PoPD films deposited on ITO electrodes obtained from H2SO4+0.2 mol·L-1Na2SO4 aqueous solutions with different pH values
3.3 XPS表征
图6为高分辨Cu 2p3/2,1/2,O 1s和C 1s的X射线光电子能谱,其中曲线(a)为非印迹膜,曲线(b)为Cu(II)-EDTA印迹膜.由图6A看出,印迹膜在934.5和954.3 eV处有两个峰,分别归属于Cu 2p3/2和Cu 2p1/2.24图6B中O 1s信号可能来自醋酸根、Cu(II)-EDTA或H2O中的氧,如果来自前两者,则相应的在C 1s谱中约288 eV处会出现羧基C的峰,而图6C中非印迹膜在约288 eV处并无出峰,说明非印迹膜中并没有掺杂醋酸根离子,所以非印迹膜中的氧应该来自残留的H2O,而印迹膜中的氧则来自残留的H2O或Cu(II)-EDTA.图6C中C 1s谱峰主要出现在284.8和285.8 eV处,前者归属于C-C或C-H,后者归属于C-N.25和非印迹膜相比,印迹膜还在288.2 eV处多出了一个微弱的肩峰,说明印迹膜中含有羧基,并且285.8 eV处的C-N峰相对强度增强,反映出印迹膜中C-N含量增加.此外,图6B中印迹膜的O 1s峰强度明显强于非印迹膜.由以上信息可以推断印迹膜中含有EDTA结构(每个EDTA都含有4个羧基,6个C-N和8个O).而Cu(II)-EDTA螯合物在0-0.8 V之间电化学稳定,由此可以推断出聚合物膜中包覆有Cu(II)-EDTA螯合物.

图5 聚邻苯二胺的两种化学结构Fig.5 Two kinds of Chemical structures of PoPD(a)polyaniline-like structure;(b)ladder structure with phenazine units

图6 在0.2 mol·L-1的醋酸盐缓冲液(pH 6.0)中沉积于ITO导电玻璃上的非印迹(a)和Cu(II)-EDTA印迹(b)聚邻苯二胺膜的Cu 2p1/2,3/2(A),O 1s(B)和C 1s(C)的X射线光电子能谱图Fig.6 Cu 2p1/2,3/2(A),O 1s(B),and C 1s(C)XPS spectra of(a)non-imprinted and(b)Cu(II)-EDTAimprinted PoPD films deposited on ITO electrodes in 0.2 mol·L-1acetate buffer solution(pH 6.0)
3.4 模板的洗脱
对于游离的铜离子,用金电极在-0.4 V恒电位富集200 s后在0.2 V左右能检测到明显的铜的差分脉冲溶出峰(图7a).为了证明Cu(II)-EDTA是否能被洗脱,我们用金电极在-0.4 V恒电位下在洗脱液中富集铜离子200 s,然后在空白溶液中以差分脉冲伏安法检测是否有铜的溶出峰,结果没有观察到0.2 V左右有峰(图7c),而当富集电位调至-0.6 V时,则检测到了铜的溶出峰(图7b),因此我们可以推断洗脱液中含有铜离子,而且是以Cu(II)-EDTA螯合物的形式存在的,因为Cu(II)-EDTA螯合物的电化学窗口较宽,所以富集电位需负移至-0.6 V.此外,根据溶出峰电流的大小判断,经过2 h的浸洗,模板分子基本能被有效洗脱.

图7 金电极在不同溶液中恒电位富集铜离子200 s后的差分脉冲伏安曲线Fig.7 Differential pulse voltammograms ofAu electrode after potentiostatic preconcentration of Cu(II)for 200 s in different solutions
3.5 聚合物与模板间的作用力

图8 Cu(II)-EDTA印迹膜(a)和非印迹膜(b)修饰的石英晶体对不同浓度的Cu(II)-EDTA溶液的频率响应曲线Fig.8 Frequency responses of the quartz crystal modified with(a)Cu(II)-EDTAimprinted PoPD and(b)nonimprinted PoPD to Cu(II)-EDTAsolutions of different concentrations
XPS的表征结果证明了非印迹聚合物中并没有掺杂醋酸根离子,而聚合物的导电性又很差,因此得到的应该是本征态的聚邻苯二胺.当往聚合液中加入Cu(II)-EDTA后,XPS证明聚合物中确实含有Cu(II)-EDTA,但得到的印迹聚合物的导电性仍然很差,且印迹聚合物的电化学过程和印迹聚合物的紫外吸收光谱较之非印迹聚合物均无明显差异,说明Cu(II)-EDTA的掺入并没有改变聚合物的导电性和结构,因此我们认为Cu(II)-EDTA螯合物可能是通过其自身的氧原子和聚邻苯二胺的氨基形成氢键相互作用,从而被包覆在聚合物中.
3.6 分子印迹膜对模板的响应度
图8为修饰了Cu(II)-EDTA印迹膜和非印迹膜的石英晶体对不同浓度的Cu(II)-EDTA溶液的频率响应曲线,每条曲线对应的浓度即为Cu(II)-EDTA溶液的浓度.从图中可以看出,随着Cu(II)-EDTA的浓度从3.31 μmol·L-1增加到130 μmol·L-1时,修饰了印迹膜的石英晶体的振动频率变化从5 Hz增加到了65 Hz,而在这过程中修饰了非印迹膜的石英晶体振动频率变化最大只有7 Hz左右,说明本实验合成的Cu(II)-EDTA印迹聚邻苯二胺膜对Cu(II)-EDTA具有很好的响应度.此外,对于Cu(II)-EDTA印迹聚邻苯二胺膜的性能在文献26中已有更详尽的描述.
4 结论
本文利用循环伏安法,以o-PD为功能单体, Cu(II)-EDTA螯合物为模板,成功地合成了Cu(II)-EDTA分子印迹聚合物.UV-Vis表征结果表明,当溶液的pH≥5.0时有利于o-PD在电极表面形成聚合度较高的聚邻苯二胺;XPS证明了Cu(II)-EDTA被成功地包覆在聚合物中,并推断出模板分子和聚合物之间可能主要通过氢键相互作用;差分脉冲伏安法证明了模板分子能够被有效洗脱;QCM测试结果表明了合成的分子印迹膜和模板分子具有明显的相互作用.此外,根据不同金属离子的特性,我们还能选择不同的螯合剂来达到不同的印迹效果,以提高聚合物膜对模板的特异性结合能力,此方面工作正在进一步开展中.目前的初步研究结果为此类方法用于重金属的实时快速检测提供了实验依据.
(1)Wulff,G.;Sarhan,A.Angew.Chem.1972,84,364.
(2) Ramstrom,O.;Ansell,R.J.Chirality 1998,10(3),195.
(3) Alexander,C.;Andersson,H.S.;Andersson,L.I.;Ansell,R.J.; Kirsch,N.;Nicholls,I.A.;O′Mahony,J.;Whitcombe,M.J. J.Mol.Recognit.2006,19(2),106.
(4) Kandimalla,V.B.;Ju,H.Anal.Bioanal.Chem.2004,380(4), 587.
(5) Haupt,K.;Mosbach,K.Chem.Rev.2000,100(7),2495.
(6) Zuo,Y.J.;Yu,J.H.;Huang,Q.B.;Zhao,J.J.;Pan,Y.;Lin,Y. Acta Phys.-Chim.Sin.2003,19(6),528.[左言军,余建华,黄启斌,赵建军,潘 勇,林 原.物理化学学报,2003,19(6), 528.]
(7) Uludağ,Y.;Piletsky,S.A.;Turner,A.P.F.;Cooper,M.A.FEBS Journal 2007,274(21),5471.
(8) Turiel,E.;Martin-Esteban,A.Anal.Bioanal.Chem.2004,378 (8),1876.
(9) Geng,L.N.;Kang,N.;Ning,Z.Y.;Wu,L.Q.;Li,Y.;Sun,L. Q.;Luo,A.Q.Acta Phys.-Chim.Sin.2008,24(1),25.[耿利娜,康 宁,宁周云,武利庆,李 琰,孙立权,罗爱芹.物理化学学报,2008,24(1),25.]
(10) Peng,C.;Liu,W.J.;Zhang,C.T.;Zhang,L.;Zhang,Z.C. Chemical Journal of Chinese Universities 2009,30(11), 2159.[彭 畅,刘维娟,张春涛,张 玲,张智超.高等学校化学学报,2009,30(11),2159.]
(11) Ye,L.;Haupt,K.Anal.Bioanal.Chem.2004,378(8),1887.
(12) Wulff,G.Angew.Chem.Int.Edit.1995,34(17),1812.
(13) Wulff,G.Chem.Rev.2002,102(1),1.
(14) Bo,S.;Lin,H.Q.;Li,X.W.Herald of Medicine 2010,29(5), 633. [卜 水,林华庆,李欣蔚.医药导报,2010,29(5),633.]
(15) Zhu,L.Y.;Zhang,R.H.;Zhu,Z.L.Chemstry 2010,73(4), 326. [朱琳琰,张荣华,朱志良.化学通报,2010,73(4),326.]
(16) Rao,T.P.;Kala,R.;Daniel,S.Anal.Chim.Acta 2006,578(2), 105.
(17)Wang,Z.Q.;Shen,Y.Y.;Wu,G.H.;He,C.Y.Chinese Journal of Analytical Chemistry 2009,37(3),449.[汪竹青,沈玉永,吴根华,何池洋.分析化学,2009,37(3),449.]
(18) Marx,K.A.Biomacromolecules 2003,4(5),1099.
(19) Mecea,V.M.Sensors and Actuator A 2006,128(2),270.
(20) Losito,I.;Giglio,E.D.;Cioffi,N.;Malitesta,C.J.Mater. Chem.2001,11(7),1812.
(21) Losito,I.;Palmisano,F.;Zambonin,P.G.Anal.Chem.2003,75 (19),4988.
(22) Tu,X.M.;Xie,Q.J.;Xiang,C.H.;Zhang,Y.Y.;Yao,S.Z. J.Phys.Chem.B 2005,109(9),4053.
(23) Chiba,K.;Ohsaka,T.;Ohnuki,Y.;Oyama,N.J.Electroanal. Chem.1987,219(1/2),117.
(24) Lin,M.;Cho,M.S.;Choe,W.S.;Lee,Y.Biosens.Bioelectron. 2009,25(1),28.
(25)Rahman,M.A.;Won,M.S.;Shim,Y.B.Anal.Chem.2003,75 (5),1123.
(26)Lu,F.;Wang,L.Y.;Wu,F.Q.;Ying,X.F.;Gu,R.A.;Yao,J.L.; Zhang,H.L.;Deng,Z.W.Microchimica Acta DOI:10.1007/ s00604-011-0595-2.
January 14,2011;Revised:April 12,2011;Published on Web:May 9,2011.
Electrosynthesis and Characterization of Metal Chelate Imprinted Poly-o-Phenylenediamine Films
WANG Lian-Yan1LU Feng2WU Fu-Quan3GU Ren-Ao2YAO Jian-Lin2ZHANG Hai-Lu1DENG Zong-Wu1,*
(1Suzhou Institute of Nano-tech and Nano-bionics,Chinese Academy of Sciences,Suzhou 215123,Jiangsu Province,P.R.China;2College of Chemistry,Chemical Engineering and Materials Science,Soochow University,Suzhou 215123,Jiangsu Province,P.R. China;3Suzhou Environmental Monitor Centre,Suzhou 215004,Jiangsu Province,P.R.China)
Novel molecularly imprinted polymers(MIPs)were synthesized by the electrochemical polymerization of o-phenylenediamine(o-PD)using cyclic voltammetry in the presence of Cu(II)-ethylenediaminetetraacetate chelate(Cu(II)-EDTA),which acted as a template.The resultant polymers were characterized by UV-Vis spectroscopy,X-ray photoelectron spectroscopy(XPS),differential pulse voltammetry(DPV),and quartz crystal microbalance(QCM).UV-Vis spectral analysis indicated that a higher degree poly-o-phenylenediamine(PoPD)was obtained at pH≥5.0.XPS analysis clearly showed the successful embedding of a Cu(II)-EDTA chelate in the PoPD film and,therefore,hydrogen bonding was a major interaction between the template and the PoPD film.DPV analysis confirmed the successful removal of the template from the PoPD film.The QCM test showed that the Cu(II)-EDTA imprinted PoPD film had good Cu(II)-EDTAchelate sensitivity.
o-Phenylenediamine;Chelate;Molecularly imprinted polymer;Cyclic voltammetry; Quartz crystal microbalance
O641
∗Corresponding author.Email:zwdeng2007@sinano.ac.cn;Tel:+86-512-62872559.
The project was supported by the National Natural Science Foundation of China(21073226)and Science and Technology Planning Project of Suzhou,China(SS0852).
国家自然科学基金(21073226)及苏州市科技计划项目(SS0852)资助
