深绿木霉T2菌株对百合疫霉拮抗作用及机制
2011-11-30梁巧兰魏列新徐秉良
梁巧兰, 王 芳, 魏列新, 徐秉良
(甘肃农业大学草业学院/草业生态系统教育部重点实验室,中-美草地畜牧业可持续发展研究中心,兰州 730070)
百合疫霉(Phytophthor a nicotianae Bredeet de Haan)是危害百合茎基部的主要病原菌,引起百合疫病。近年来在百合种植区发生普遍,大棚种植区发病率为11.8%,而露地种植区发病率为19.1%,严重影响百合产业的经济效益[1]。目前,采用化学药剂防治效果不理想,同时还引起农药残留、农药污染及抗药性菌株出现等问题,因此,有必要大力开展生物防治植物病害研究。
木霉 (Trichoder ma spp.)是一类较理想的生防菌。人们已相继发现木霉对18个属29种病原真菌表现出拮抗作用[2],其中对一些土传植物病原菌具有很好的防治效果,包括丝核菌属(Rhizoctonia)、小核菌属(Sclerotium)、镰刀菌属(Fusariu m)、腐霉属(Pythiu m)、疫霉属(Phytophthor a)等12个属的病原菌[3-4]。木霉的作用机制包括抗生、寄生、溶菌、竞争和诱导抗性,并具有促进植物生长的作用[3]。木霉用于防治百合疫霉病的研究国内外尚未见报道。为此,对具有拮抗作用的深绿木霉(Trichoderma atroviride)对百合疫霉拮抗作用及其机制进行了研究,现将结果报道如下。
1 材料与方法
1.1 试验材料
深绿木霉T2菌株、百合疫霉由甘肃农业大学植物病理实验室分离保存;培养基:PDA(马铃薯葡萄糖固体培养基)、PDB(马铃薯葡萄糖液体培养基)。
1.2 试验方法
1.2.1 深绿木霉T2菌株与百合疫霉菌对峙培养
制备PDA培养基,将培养2 d、直径为5 mm的深绿木霉菌块与百合疫霉菌块对接于直径90 mm的培养皿边缘,另将深绿木霉、百合疫霉菌块分别接于培养皿中央的纯培养作为对照,每处理设6个重复。28℃恒温培养,定期观察两菌的生长情况,记录生长半径。
1.2.2 深绿木霉T2菌株对百合疫霉菌拮抗作用方式观察
在PDA培养基中央放置一块20 mm×20 mm无菌盖玻片,在左侧距盖玻片40 mm处接种深绿木霉,右侧距盖玻片20 mm处接种百合疫霉。28℃恒温培养。设置12个重复。分别在两种菌培养24、36、48、60 h时,取下盖玻片,放在载玻片上,显微观察两种菌丝之间的作用方式,并用数码显微照相仪照相。
1.2.3 深绿木霉T2菌株发酵液对百合疫霉病菌菌丝的抑制作用
将培养3 d的深绿木霉发酵液8 000 r/min离心10 min,分别将15 mL上清液倒入培养皿中,接入百合疫霉菌块。浅层培养5 d后观察性状。以灭菌的上清液中培养百合疫霉菌块为对照。每处理设6个重复。
1.2.4 深绿木霉T2菌株代谢产物对百合疫霉病菌抗生作用
1.2.4.1 深绿木霉T2菌株发酵液对百合疫霉病菌的抗生作用
试验设PDB直接发酵和在PDB中加入20 g百合疫霉干菌丝进行发酵2个处理,在装有100 mL上述2种PDB的三角瓶中分别接入直径5 mm深绿木霉T2菌块。在28℃、150 r/min条件下发酵,设6个重复,分别于2、4、7 d取样,在无菌条件下将发酵液先用滤纸过滤,再用直径35 mm的细菌过滤器过滤,将10 mL两种滤液分别加入90 mL PDA中(50℃左右),摇匀倒成平板,接上直径5 mm的百合疫霉菌块,设置6个重复。28℃恒温培养,5 d时观察、测量并记录生长情况。
1.2.4.2 深绿木霉T2菌株易挥发性代谢产物对百合疫霉的拮抗作用
对扣培养法测定[5]:在PDA平板上接种已活化2 d、直径为5 mm的深绿木霉菌块,28℃恒温培养2d后,在其上方蒙上双层无菌的圆形玻璃纸(玻璃纸直径比培养皿直径大10 mm),再将刚接种过直径为5 mm百合疫霉菌块的PDA平板(与接种深绿木霉菌块的PDA同样大小)倒扣其上,封口膜密封后,28℃恒温培养。以空白PDA平板与百合疫霉平板对扣培养作对照。设6个重复。接种后每隔24 h用十字法交叉测量百合疫霉菌落大小,计算其菌丝生长抑制率,连续测5 d。菌丝生长抑制率计算方法如下:

1.2.4.3 深绿木霉T2菌株难挥发性代谢产物对百合疫霉的拮抗作用
圆盘滤膜 法 测 定[5-6]:铺双层无菌玻璃纸于PDA平板上,在玻璃纸中央接种已活化2 d、直径为5 mm的深绿木霉菌块,28℃恒温培养。设置6个重复。待深绿木霉菌丝长满玻璃纸前,将玻璃纸移去。在平板中央接种已活化5 d的百合疫霉菌块,28℃下恒温培养。以不接深绿木霉菌块的PDA平板接种百合疫霉作对照。接种后每隔24 h用十字交叉法测定菌落直径,计算其菌丝生长抑制率,计算方法同上。
1.3 深绿木霉T2菌株溶菌酶β-1,3-葡聚糖酶活性的测定
待测酶液的准备:将1~8 d的深绿木霉发酵液,8 000 r/min离心20 min去除菌丝,以上清液作为酶液放置于4℃冰箱中备用。
发酵液中β-1,3-葡聚糖酶活力的测定:参考El Ghaouth[7]和中国科学院上海植物生理研究所[8]的方法进行,每处理3个重复,每个重复测5次,以每s产生还原糖1 n mol的酶量为1个酶活单位(U)。
2 结果与分析
2.1 深绿木霉T2菌株对百合疫霉菌拮抗作用
对峙培养中两菌的生长速率均比各自在单独培养时有所减弱,但深绿木霉T2生长速率随培养时间的延长逐渐增大,与纯培养的生长势相同;而百合疫霉的生长速率逐渐减小,与纯培养的生长势相反。并且在对峙培养60 h时,深绿木霉T2与百合疫霉的生长速率比值达到3.68,远远高于纯培养中两者的比值2.36(图1)。
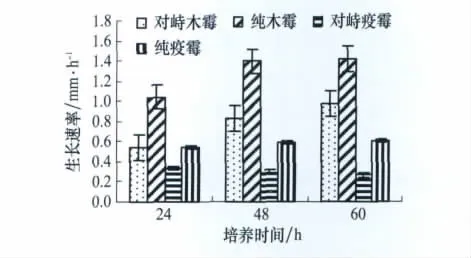
图1 深绿木霉、百合疫霉生长速率比较
PDA平板上的深绿木霉T2与百合疫霉接触后,两者菌丝在交界处互相缠绕,深绿木霉T2的菌丝在百合疫霉菌落边缘菌丝上打成许多绿色结。且深绿木霉T2相对于百合疫霉来说,生长速度要快得多,覆盖了平板的4/5(图2a),表明深绿木霉T2在营养和空间上具有明显的竞争优势。
深绿木霉对百合疫霉拮抗作用方式研究表明:24 h时深绿木霉T2与百合疫霉菌各自生长,在盖玻片边缘均能看到两菌菌丝,但还未接触,只是深绿木霉菌丝较百合疫霉菌丝长,且数量多。36 h时在显微镜下可以观察到两者菌丝相接触,但接触面小,从外观上还看不到木霉抑制疫霉生长的现象;到48 h时便可以明显看到深绿木霉T2沿着百合疫霉菌丝或缠绕在百合疫霉菌丝上生长,并在疫霉菌丝上产生大量的分支,此时深绿木霉T2已经产生吸器伸入到疫霉菌丝内(图2b,c);60 h时深绿木霉T2明显抑制了百合疫霉菌丝的生长,其菌丝降解、不能继续扩张(图2d)。
2.2 深绿木霉T2菌株发酵液对百合疫霉病菌菌丝的抑制作用
在未灭菌的深绿木霉T2上清液中培养的疫霉菌块,仅在初期长出细小菌丝后便无法继续生长,而在灭菌后的上清液中,疫霉菌块仍可以继续生长,形成大块菌丝团。从而证实深绿木霉发酵液能够抑制百合疫霉菌丝(图2e)。
2.3 深绿木霉T2菌株对百合疫霉病菌抗生作用测定
10%深绿木霉T2发酵液对百合疫霉的抑制效果随发酵时间的延长而逐渐增强,其中发酵2 d的抑制效果为31.17%,而发酵7 d的抑制率已升至46.61%。说明深绿木霉能够通过产生抗生物质来抑制百合疫霉菌的生长。但在加有百合疫霉菌丝的PDB中进行发酵处理时,与PDB发酵相比,其抑制率呈递减的趋势,发酵7 d的抑制率仅为用PDB发酵的31.43%,这表明百合疫霉菌丝对深绿木霉产生抗生物质并没有诱导作用(表1)。方差分析表明2、4、7 d的深绿木霉PDB发酵液和含有百合疫霉菌丝的深绿木霉PDB发酵液对百合疫霉的抑制率之间均存在极显著差异(图2f,g)。
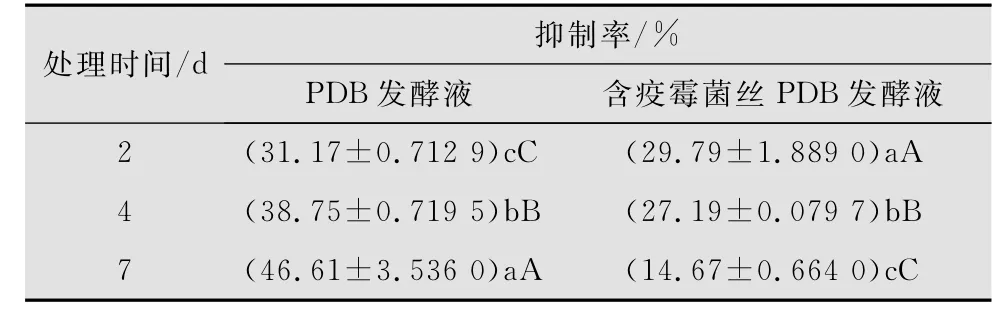
表1 10%深绿木霉发酵液对百合疫霉病菌的抑制效果1)
2.4 深绿木霉T2菌株代谢产物对百合疫霉的拮抗作用
圆盘滤膜法和对扣培养法培养结果表明,深绿木霉T2产生的难挥发性和易挥发代谢产物对百合疫霉菌丝生长均有明显的抑制作用,且在72 h时抑菌率均达到最大值,分别为88.24%和80.00%,以后菌落直径不再增大。方差分析表明深绿木霉两种代谢产物在24 h和72 h对百合疫霉抑菌率均存在极显著差异,难挥发代谢产物48 h的抑菌率介于两者之间,易挥发代谢产物48 h的抑菌率和72 h的差异不显著(图2h,i,表2)。

图2 深绿木霉T2对百合疫霉的拮抗作用

表2 深绿木霉代谢产物对百合疫霉菌的影响1)
2.5 深绿木霉T2菌株溶菌酶β-1,3-葡聚糖酶活性测定
深绿木霉T2发酵液中可产生能够溶解真菌细胞壁的β-1,3-葡聚糖酶,且发酵时间对酶活性有一定影响。随着发酵时间的延长,酶活整体呈现先增高后降低的趋势。在5 d达到峰值,为18.54 U(图3)。
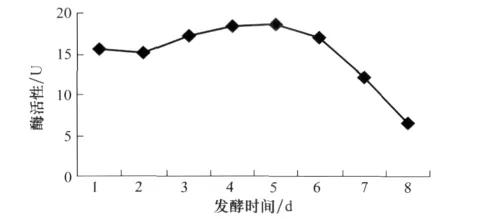
图3 发酵时间与β-1,3葡聚糖酶活性的关系
3 讨论
据报道木霉菌的有些种如绿色木霉(Trichoderma viride)和哈茨木霉(T.har zianu m)的拮抗机制主要是通过重寄生发挥其防病作用[9]。辛雅芬等[10]研究认为拮抗木霉菌的生防机制包括竞争作用、重寄生作用、抗生作用、诱导抗病性和协同拮抗作用。李梅云等[11]研究发现不同木霉菌株对同一病原菌的作用机制不同,如木霉菌株TR13、TR14、TR17对烟草疫霉(Phytophthora parasitica var.nicotianae)的作用机制中TR13、TR14的竞争作用较好;3个木霉菌株均产生β-1,3葡聚糖酶、纤维素酶并参与烟草疫霉细胞壁的消解,以TR13与TR14酶的活性较高;本研究也发现竞争作用、重寄生作用、抗生作用和溶菌作用是深绿木霉T2对百合疫霉拮抗作用的主要机制;另外,深绿木霉T2产生的β-1,3葡聚糖酶对百合疫霉菌细胞壁的消解也起到了重要作用。对于深绿木霉T2能否产生纤维素酶参与百合疫霉细胞壁的消解等问题本试验尚未涉及还有待于进一步研究。
试验中还发现深绿木霉易挥发性与难挥发性代谢产物均能抑制百合疫霉病原菌的生长,多种拮抗作用方式并存对于深绿木霉抑制百合疫霉病原菌生长起到了关键作用,这与木霉菌株TR17既可产生非挥发性物质又可产生挥发性物质分别通过抑制孢子萌发和菌丝生长的作用方式影响烟草疫霉生长的研究结果相一致[11]。但究竟这两种抗生物质何种占主导地位、抗生物质以何种作用方式起抑菌作用、抗生物质定性分析以及其对动物与植物有无毒性等问题还有待于进一步探讨。
另外有研究发现培养基种类及培养基厚度均对木霉的生长和重寄生有重要影响,减少培养基中葡萄糖含量可以增强木霉的重寄生作用和抑菌效果。因此筛选适用的基质对于制备深绿木霉生防制剂具有重要意义[12]。
[1] 徐秉良,马书智.百合疫病病原菌的鉴定及培养基的筛选[J].植物保护学报,2005,32(3):287-290.
[2] 产祝龙,丁克坚,苏贤岩,等.哈茨木霉对水稻恶苗病菌的拮抗作用[J].植物保护学报,2003,29(3):35-39.
[3] 鲁素云.植物病害生物防治学[M].北京:北京农业大学出版社,1993.
[4] 李淼,产祝龙,檀根甲,等.木霉菌防治植物真菌病害研究进展[J].生物技术通讯,2009,20(2):286-290.
[5] Whipps J M,Magan N,Effects of nutrient stat us and water potential of media on f ungal growth and antagonist-pathogen interactions[J].EPPO Bulletin,1987,17(4):581-591.
[6] 龚国淑,张浩,曾国强,等.Trichoder ma longibr achiatum Rifai对Botr ytis cinerea的拮抗机制研究[J].云南农业大学学报,1998,13(1):93-96.
[7] El Ghaout h A,Wilson C L,Callahan A M.Induce of chitinase,β-1,3-glucanase and phenylalanine ammonia lyase in peach fruit by UV-C treat ment[J].Phytopathology,2003,93(3):349-355.
[8] 中国科学院上海植物生理研究所,上海植物生理学会.植物生理实验指南[M].北京:科学出版社,1999.
[9] 陈涛.有害生物的微生物防治原理和技术[M].武汉:湖北科学技术出版社,1995:362-363.
[10]辛雅芬,商金杰,高克祥.拮抗木霉菌的生防机制研究进展[J].东北林业大学学报,2005,33(4):88-91.
[11]李梅云,李天飞,王革,等.木霉对烟草黑胫病菌的拮抗机制[J].植物保护学报,2002,29(4):309-312.
[12]胡东维,王源超,徐颖.木霉对辣椒疫霉菌抑制作用的超微结构与细胞化学[J].菌物系统,2003,22(1):95-100.
