Na+,K+-ATP酶参与大鼠皮层神经元NMDA电流的调节
2011-11-29郭会彩张丽男王永利
刘 倩,郭会彩,2,张丽男,王永利
脑缺血缺氧性疾病在临床上具有发病率高、致残率高、死亡率高的特点,严重威胁着人类的健康。目前认为谷氨酸介导的兴奋性细胞毒性在脑缺血缺氧的病理过程中起重要作用[1]。在神经元缺血缺氧时,NMDA受体是介导神经毒性最主要的受体[2-4],谷氨酸通过NMDA受体在缺血缺氧所致的神经元损伤中起关键作用[5]。
我室的前期研究已证明[6],缺血缺氧后,脑组织不仅兴奋性氨基酸释放增多,而且Na+,K+-ATP酶活性明显降低,其高亲合力α2亚基和α3亚基,无论在mRNA水平还是蛋白水平均明显降低,而低亲和力的α1亚基则无明显改变[7],提示Na+,K+-ATP酶高亲合力α亚基参与了脑缺血缺氧性损伤。本实验选取对缺血较敏感的皮层神经元,旨在探讨缺氧条件下Na+,K+-ATP酶是否参与神经元缺氧损伤所致的NMDA受体过度激活。
1 材料与方法
1.1 材料 脑片膜片钳系统系德国HEKA公司产品。出生12~16 d的SD乳大鼠,由河北医科大学动物中心提供。矾酸钠(vanadate)批号:13721-39-6,购自 AlfaAesar公司;双氢哇巴因(Dihydroouabain,DHO)批号:214-663-0,购自 Sigma公司。
人工脑脊液(ACSF)的配制(mmol·L-1):NaCl 125,KCl 3,MgCl21,NaH2PO41.25,D-Glucose 10,NaHCO325,调节渗透压为310 mOsm。使用前以体积分数为95%O2和5%CO2混合气充气饱和1 h,可调节ACSF的pH值在7.4左右。
电极内液(mmol·L-1):KCl 110,NaCl 10,HEPES 10,EGTA 0.2,Na2ATP 5,TEACL 10,用CsOH调节pH值至7.2,渗透压为310 mOsm。
1.2 方法
1.2.1 大鼠皮层脑片的制备 取出生12~16 d的SD乳大鼠,2%戊巴比妥钠腹腔注射麻醉(0.1 ml/只),将麻醉好的大鼠断头并迅速切取其前2/3的脑组织,利用震动切片机将脑组织切成厚约300 μm的脑片,即可用于脑片膜片钳记录。
1.2.2 NMDA电流记录 电极由四步玻璃微电极拉制仪(P97,Sutter,美国)拉制而成,拉制好的电极充灌电极内液后电阻为4~8 MΩ。整个实验在室温下(23±2)℃进行,设置钳制电压为-60 mV。所有药物均选择灌流给药方法。NMDA电流(INM)为灌流含有NMDA(80 μmol·L-1)的ACSF液体所得到的诱发电流,此电流作为对照电流。孵育DHO、vanadate后的电流为INM’,两者比较即可得到电流的抑制率。
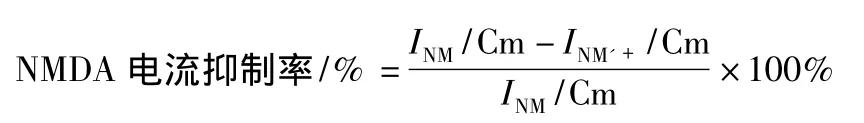
神经元缺氧模型的制作:在实验前,用自制的通气系统在ACSF中预先持续通以体积分数为95%N2,5%CO2气体至少30 min,以驱除灌流液中所溶解的氧气。取脑片,置于正常的ACSF中,实施封接,形成全细胞记录模式后,在保持GΩ封接阻抗的条件下,用灌流系统持续、缓慢灌流经上述处理过的不含氧的ACSF,造成细胞急性缺氧,观察脑片在急性缺氧环境下通道电活动的变化。实验中保持通气灌流状态。
2 结果
2.1 皮层神经元NMDA电流鉴别 在本实验条件下记录的NMDA电流为一个内向移动电流,在灌流NMDA受体的特异性阻断剂AP-5或MK-801后,此电流内向移动可被基本阻断。其中AP-5、MK-801对NMDA电流的抑制率分别为94.95%、89.17%,表明所记录到的内向电流确为NMDA电流,见Fig 1。
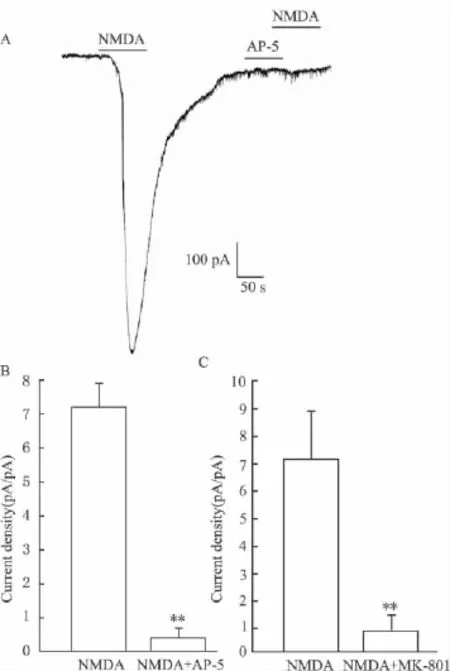
Fig 1 Effect of AP-5 or MK-801 on the NMDA current of neurons from cortical slicesA,B:NMDA current density of neurons after incubated with AP-5;C:NMDA current density of neurons after incubated with MK-801.**P<0.01 vs NMDA.
2.2 DHO对NMDA电流的调节 与对照NMDA电流相比较,无论在正常或缺氧条件下,不同浓度的DHO均能明显抑制皮层神经元的NMDA电流,见Fig 2,随着 DHO 浓度(10-11~10-3mol·L-1)的不断升高,其NMDA电流逐渐减小,而抑制率则逐渐增大。且在缺氧情况下,神经细胞的电流密度明显增大,见Tab 1。
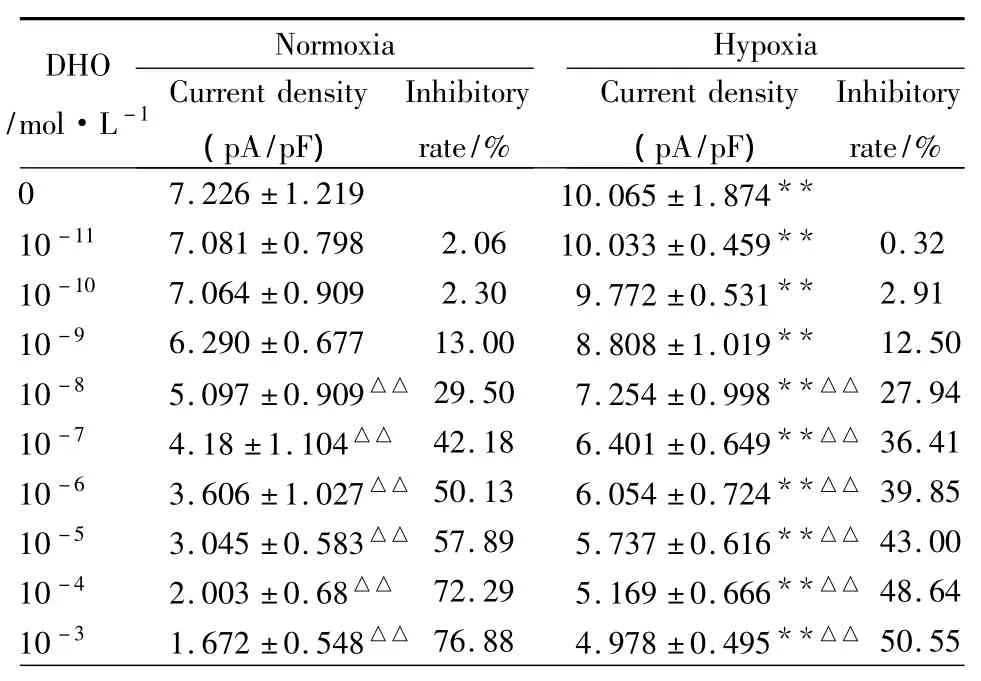
Tab 1 Effects of different doses of DHO on the NMDA current of neurons from cortical slices
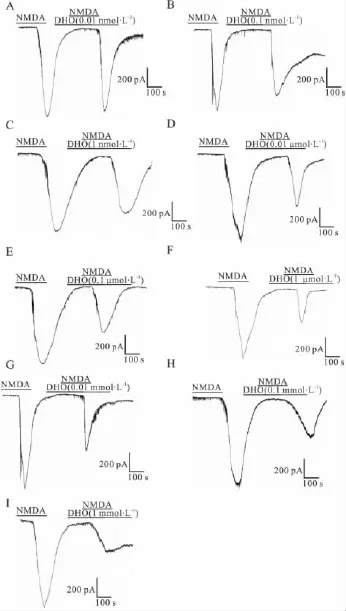
Fig 2 Effects of different doses of DHO on the NMDA current of neurons from cortical slices.
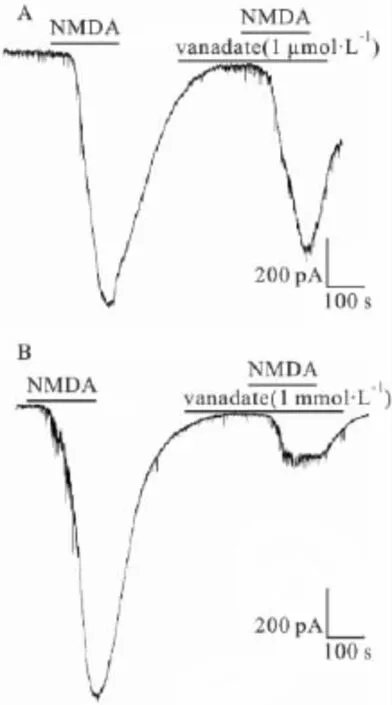
Fig 3A.The NMDA current after incubated with vanadate(1 μmol·L -1)in brain slices;B.The NMDA current after incubated with vanadate(1 mmol·L -1)in brain slices
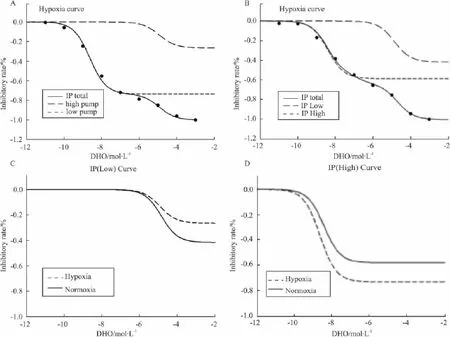
Fig 4 The fit curve before and after hypoxia
以上数据表明,神经元钠钾泵参与了NMDA电流的调节,其功能强弱与NMDA电流大小密切相关。但在无糖低氧处理后,孵育各浓度DHO后的NMDA电流密度均较缺氧前明显增大,提示缺氧时神经元NMDA电流的调节可能主要取决于兴奋性氨基酸的释放而非钠钾泵的功能。
2.3 vanadate对 NMDA 电流的调节 1 μmol·L-1和1 mmol·L-1vanadate能明显抑制NMDA电流,其抑制率分别为49.25%和76.4%。进一步说明NMDA电流的调节与钠钾泵功能密切相关,见Fig 3。
2.4 钠钾泵调节NMDA电流的机制研究 我们对DHO调节NMDA电流量效关系曲线的拟合结果显示(Fig 4),大鼠皮层神经元具有两种不同亲和力的钠泵,即高亲和力泵和低亲和力泵。常氧灌流时的拟合参数是:kh=3.8143×10-9,kl=1.3671×10-5,fh=0.5839,fl=0.4161;缺氧情况下是:kh=2.3311 ×10-9,kl=1.1735 ×10-5,fh=0.7353,fl=0.2647。通过对拟合曲线的分析,发现钠泵的高低亲和力亚基均参与了DHO对NMDA电流的调节;缺氧前后高亲合力泵发生改变明显,而低亲合力泵改变不明显。
3 讨论
Na+,K+-ATP酶又称为钠泵,是一类广泛存在于真核生物细胞膜中的跨膜蛋白。对保持细胞体积及pH、肌肉和神经细胞的细胞膜兴奋性等生理过程具有重要作用[8]。多年的研究发现:Na+,K+-ATP酶的活性在脑缺血的早期即有明显下降,并且随缺血时程而递降,从而证明脑缺血后早期Na+,K+-ATP酶活动的减低,导致了细胞内外的离子失衡,并与细胞毒性水肿的发生有着直接的关系。
神经细胞在孵育DHO后,NMDA电流会减小,且随着DHO浓度的升高,NMDA电流的减小程度逐渐增加,呈浓度依赖性。另外,用Na+,K+-ATP酶的另一抑制剂vanadate灌流神经细胞时,亦可得到相同结果。这些结果表明,NMDA电流的下调作用与抑制Na+,K+-ATP酶的活性密切相关。另外,缺氧缺血加重了细胞内外的离子紊乱,进一步扰乱了细胞的正常功能;加上内源性氨基酸的过量释放,兴奋神经细胞的NMDA受体[9],因此在缺氧缺血的情况下,DHO对NMDA电流的抑制不如在正常情况下明显。
总之,无论在正常或缺氧条件下,DHO均能浓度依赖性抑制皮层神经元的NMDA电流,提示钠钾泵参与了神经元NMDA电流的调节,其功能强弱与NMDA电流大小密切相关。
[1]李 敏,黎海蒂,汪 涛,等.谷氨酸及其N-甲基-D-天冬氨酸受体1在大鼠前额叶执行控制中的作用机制[J].中国临床康复,2003,7(31):4202-3.
[1]Li M,Li H T,Wang T,et al.Study on the effect and mechanism of glutamic acid and NMDAR1 in prefrontal cortex executive control of rats[J].Chin J Clin Rehab,2003,7(31):4202-3.
[2]王 丹,戴体俊,马 涛,等.侧脑室注射荷包牡丹碱、NMDA对依托咪酯所致遗忘作用的影响[J].中国药理学通报,2009,25(11):1029-32.
[2]Wang D,Dai T J,Ma T,et al.Effects of intracerebroventricular injection of bicuculline or NMDA on the amnestic effect induced by etomidate[J].Chin Pharmacol Bull,2009,25(11):1029-32.
[3]陈远寿,罗孝美,陈 旻,等.NVP-AAM077和Ro25-6981对全脑缺血小鼠海马神经元损伤及BDNF表达的影响[J].中国药理学通报,2010,26(8):1010-3.
[3]Chen Y S,Luo X M,Chen Y,et al.Effect of NVP-AAM077 and Ro25-6981 on hippocampal neuronal injury and brain derived neurotrophic factor expression in global cerebral ischemic mice[J].Chin Pharmacol Bull,2010,26(8):1010-3.
[4]葛志军,吴伟强,居 刚,等.鞘内注射痛稳素对甲醛致痛大鼠脊髓PKCα与NMDA受体NR1亚单位磷酸化的影响[J].中国药理学通报,2010,26(5):693-4.
[4]Ge Z J,Wu W Q,Ju G,et al.Modulatory role of intrathecal adm inistration of nocistatin on protein kinase C dependent phospho rylations of the spinal cord PKCα and NMDA receptor subunit NR1 induced by formaldehyde in rat[J].Chin Pharmacol Bull,2010,26(5):693-4.
[5]Kumar A,Zou L,Yuan X,et al.N-methyl-D-aspartate receptors:Transient loss of NR1/NR2A/NR2B subunits after traumatic brain injury in a rodentmodel[J].J Neurosci Res,2002,67:781-6.
[6]Wang Y L,He R R.Effect of dipfluzine on cortical somatosensory evoked potentials and amino acid contents in ischemic rat brain[J].Acta Pharmacol Sin,1996,17:38-9.
[7]郭 芳,齐亚娟,王永利.大鼠缺血性全脑损伤Na+,K+-ATP酶活性及其α亚基表达的变化[J].中国药理学通报,2006,22(2):234-7.
[7]Guo F,Qi Y J,Wang Y L.The changes of Na+,K+-ATPase activity and α isoforms in rat neurons suffered from global ischemia[J].Chin Pharmacol Bull,2006,22(2):234-7.
[8]Scheiner-Bobis G.The sodium pump.It′s molecular properties and mechanics of ion transport[J].Eur J Biochem,2002,269(10):2424-33.
[9]顾 靖,李学君,孙凤艳.褪黑素抑制低氧引起的大鼠大脑皮层氨基酸递质释放[J].生理学报,1999,4:87-90.
[9]Gu J,Li X J,Sun F Y.Melatonin decreases the release of amino ascid transmitters in hypoxic rat cortical slice[J].Acta Physiol Sin,1999,4:87-90.
