黄芪注射液对缺氧缺糖/复氧复糖大鼠海马神经元caspase-3表达的作用
2011-11-29闫凤霞高维娟叶冬青任立群张雅丽侯志平
闫凤霞,高维娟,钱 涛,叶冬青,任立群,张雅丽,侯志平
脑血管病是临床常见病、多发病,是目前三大致死疾病之一是首位致残因素,且其发病率、病死率及致残率有逐年上升的趋势,其中缺血性脑血管病占绝大部分。黄芪是中医药治疗缺血性脑血管病的常用药物,具有清除自由基、减轻脑水肿、对抗炎症介质、缓解钙离子超载、改善神经元能量代谢、降低兴奋性氨基酸毒性等作用[1]。本课题组前期试验证实,黄芪注射液可减轻全脑缺血/再灌注损伤引起的大鼠海马神经元的凋亡,并可降低离体培养的大鼠海马神经元缺氧缺糖/复氧复糖后所致的凋亡[2],抑制凋亡相关基因JNK3[3],通过抑制JNK3信号通路而减少caspase-3的表达[4]。本研究通过对原代培养的大鼠海马神经元施加缺氧缺糖/复氧复糖因素,模拟脑缺血/再灌注损伤过程,观察黄芪注射液对缺氧缺糖/复氧复糖大鼠海马神经元半胱氨酸天冬氨酸蛋白酶3(cysteinyl aspartate specific protease,caspase-3)表达的影响,探讨黄芪注射液抑制缺氧缺糖/复氧复糖大鼠海马神经元凋亡的分子机制。
1 材料
1.1 实验材料 SD大鼠,新生24 h之内,♀♂兼有,2级动物,由河北省实验动物中心提供,合格证号:冀医动字第702003号。
1.2 试剂和仪器 兔抗caspase-3多克隆抗体、caspase-3蛋白免疫组化SP试剂盒、Western blot试剂盒购于北京中杉金桥公司;caspase-3 mRNA探针及原位杂交试剂盒均购自天津灏洋生物科技有限公司;BCA蛋白定量试剂盒购于上海申能博彩生物公司;DNaseⅠ、多聚赖氨酸、阿糖胞苷购自美国Sigma公司;胎牛血清、马血清由Hyclone公司生产;谷氨酰胺、胰蛋白酶购自华美生物工程公司;DMEM/F12培养基、B27由美国Gibco公司生产;黄芪注射液由成都地奥九泓制药厂生产;其他试剂为国产分析纯。主要仪器:HERA cell 150型CO2培养箱由德国Heraeus公司生产;Leica DMIL 090-135.001型倒置显微镜由德国Wetzlar GmbH公司生产;TDL-40B离心机购自上海安亭科学仪器制造厂;DYY-6B型稳压稳流电泳仪购自北京六一仪器厂。
2 方法
2.1 海马神经细胞的分离、培养及鉴定 培养方法参照Brewer的方法并做少许改良[5]。取新生24 h内的SD大鼠海马组织,6.25 mmol·L-1的胰蛋白酶消化,马血清终止消化后将组织块混合液移入离心管,加 D-Hanks液1 000 r·min-1离心5 min,去上清后加DMEM/F12溶液7 ml,吹打离散组织,制细胞悬液,以200目滤网过滤。取细胞悬液在100倍倒置显微镜下计数,以5×108·L-1密度接种在含有种植培养液(DMEM/F12培养基添加0.012 mol·L-1胎牛血清,0.014 mol·L-1马血清,0.1 g·L-1谷氨酰胺,0.1 U·L-1青霉素和0.1 g·L-1链霉素)的培养皿或培养瓶中。d 2用无血清培养液(DMEM/F12添加0.02 mol·L-1B27)代替种植液。d 4换液时添加0.005 g·L-1阿糖胞苷抑制胶质细胞生长,24 h后替换成新鲜无血清培养液。培养8 d后用NSE免疫组化染色法进行神经元纯度鉴定。
2.2 缺氧缺糖/复氧复糖模型的建立与实验分组参照 Bossenmeyer等[6]的方法建立缺氧缺糖/复氧复糖细胞模型:取原代培养8 d的大鼠海马神经细胞,用无糖Earle′s液冲洗两遍,然后加入与正常对照组培养液等体积的无糖Earle′s液,随即把培养皿(瓶)置于37℃温箱中的缺氧装置里,快速通入高纯氮气1 min以排尽缺氧装置中的空气,再使排气水瓶中的气体匀速缓慢连续排出。缺氧缺糖30 min后,换正常无血清培养液在37℃、5%CO2培养箱内继续培养。大鼠海马神经细胞随机分为4组:正常对照组、缺氧缺糖/复氧复糖组、黄芪注射液溶剂对照组和黄芪注射液组。缺氧缺糖/复氧复糖组模型制备方法同上;正常对照组正常培养,不进行任何处理;黄芪注射液组于缺氧缺糖同时加入黄芪注射液,终浓度为0.5 g生药/升[2],直至细胞培养结束;黄芪注射液溶剂对照组处理方法与黄芪注射液组相同,只是将黄芪注射液换为pH值7.4的等量黄芪注射液溶剂,即无菌去离子水。
各组在复氧复糖后 0、0.5、2、6、24、48、72 h 和120 h观察caspase-3蛋白的表达和mRNA阳性神经元数目。
2.3 免疫组织化学染色法检测caspase-3阳性神经元 将细胞用浓度为99.5%的4℃丙酮固定10 min,PBS洗3遍,3%H2O2阻断内源性过氧化物酶10 min,再用PBS洗3遍后放在湿盒中,用山羊血清封闭60 min,兔抗磷酸化caspase-3多克隆抗体(1∶100稀释)4℃过夜,PBS洗3遍,生物素标记的二抗和辣根过氧化物酶依次在37℃下作用20 min,PBS洗后用DAB显色,镜下观察核中出现黄色颗粒及胞质黄染后及时终止,苏木精复染7 min后用氨水反蓝5 min,梯度乙醇脱水、二甲苯透明两遍(各10 min)、中性树胶封固。PBS代替一抗作阴性对照。阳性细胞胞质和突起呈棕黄色,胞核有黄色颗粒。阳性细胞计数方法:高倍镜下计数5个非连续视野阳性细胞数之和,每组重复6次。
2.4 原位杂交法检测caspase-3 mRNA 将细胞用-20℃无水乙醇固定10 min,原位杂交专用0.01 mol·L-1PBS洗3遍,滴加3%双氧水20 min,以灭活内源性过氧化物酶,0.01 mol·L-1PBS洗3次。滴加复合消化工作液室温消化5 min,原位杂交用PBS缓冲液洗涤3次,0.2×SSC洗1次。滴加预杂交液37℃ 1 h并盖上原位杂交专用盖玻片,吸去预杂交液后去除原位杂交专用盖玻片,滴加caspase-3 mRNA杂交液(序列号 5′-TTCAG GTCCA CAGGT CCGTT CGTTC CAAAA-3′)37℃过夜并盖上原位杂交专用盖玻片,次日揭去盖玻片,2×SSC洗3次,每次5 min,0.5×SSC 冲洗3次,每次5 min,0.2×SSC冲洗3次,每次5 min,0.1 mol·L-1TBS 37℃冲洗5 min。滴加小鼠抗地高辛生物素标记的封闭液,37℃ 45 min。原位杂交用PBS冲洗、5 min×3次。滴加高敏过氧化物酶链亲和素工作液37℃ 45 min,原位杂交用PBS冲洗、5 min×3次。DAB室温显色,光镜下观察:细胞质黄染而与胞外背景色对比反差明显后,自来水冲洗终止显色;苏木精复染5 min,浸泡返蓝20 min。脱水、透明、中性树胶封片。阴性对照组取0.01 mol·L-1PBS代替杂交液,其余步骤同上,阳性细胞为胞质黄染而胞核蓝染。阳性细胞计数方法:高倍镜下计数5个非连续视野阳性细胞数之和,每组重复6次。
2.5 蛋白免疫印迹法检测细胞内caspase-3的表达收集细胞,用细胞裂解液(RIPA∶PMSF=100∶1)裂解、震荡,12 000 r·min-14 ℃离心20 min,提取胞质蛋白,用BCA法进行蛋白定量。取100 μg样品,加入蛋白体积1/4的loading buffer上样缓冲液混匀,在100℃沸水中煮7 min,同时65℃水中孵育蛋白Marker,以12%SDS聚丙烯酰胺凝胶电泳分离,分离的蛋白用半干电转移法转移到事先用甲醇激活的PVDF膜上,用配好的5%脱脂奶粉封闭液封闭,4℃过夜后加入用封闭液稀释的兔抗磷酸化caspase-3多克隆抗体(1∶100稀释)室温摇床放置2 h。洗膜液洗3次,首次15 min,后两次各10 min,用生物素标记的二抗(1∶14 000稀释)孵育1 h,洗膜液洗后用DAB法显色。以β-actin为内参照。实验重复6次,目的条带为32 ku。用Quantity one软件对各时间点蛋白条带灰度值进行分析。

Fig 1 SP immunohistochemical staining method,positive neuronal cells after hypoxia/hypoglycemia and reoxygenation in hippocampal neurons of rats(Immunohistochemistry of caspase-3 antibody)(×400).A:Hippocampal neurons stained with NSE;B:Normal group;C:Model group;D:Solution group;E:Astragalus group
3 结果
3.1 黄芪注射液对缺氧缺糖/复氧复糖大鼠海马caspase-3阳性神经元形态学的影响 免疫组织化学结果显示:正常对照组大鼠海马神经元核规整,细胞突起明显,有少许细胞胞质黄染。缺氧缺糖/复氧复糖组大鼠海马神经元核皱缩、突起回缩,大量细胞胞质黄染,胞核内有黄色颗粒,阴性对照组未见胞质和突起黄染的阳性神经元。黄芪注射液溶剂对照组海马神经元亦可见到明显的核皱缩、突起回缩和胞质黄染,海马caspase-3阳性神经元形态学的变化与缺氧缺糖/复氧复糖组相一致(P>0.05)。黄芪注射液组大鼠海马神经元有轻微核皱缩,可见部分神经元胞质黄染。随着复氧复糖时间的延长,缺氧缺糖/复氧复糖组、黄芪注射液溶剂对照组及黄芪注射液组均可见到阳性神经元胞核中黄色颗粒逐渐增多,于24 h达到高峰。见Fig 1。
3.2 黄芪注射液对缺氧缺糖/复氧复糖大鼠海马caspase-3阳性神经元数目和百分率的影响 免疫组织化学结果显示:与正常对照组相比,除0 h和0.5 h 之外,缺氧缺糖/复氧复糖组在 2、6、24、48、72 h和120 h各时间点海马caspase-3阳性神经元数目、占神经元总数的百分率及平均光密度值均明显增多(P<0.05),于24 h达到高峰。黄芪注射液溶剂对照组以上各个指标的变化趋势均与缺氧缺糖/复氧复糖组相一致(P>0.05)。除0 h和0.5 h之外,黄芪注射液组各时间点阳性神经元数目、占神经元总数的百分率及平均光密度值均比缺氧缺糖/复氧复糖组减少(P<0.05)。见Fig 2。
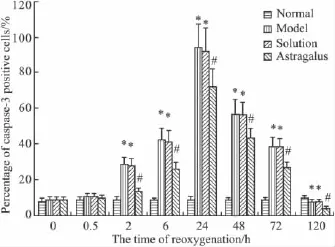
Fig 2 The effect of astragalus injection on the percentage of caspase-3 positive neuronal cells after hypoxia/hypoglycemia and reoxygenation in hippocampal neurons of rats(±s,n=6)*P<0.05 vs normal control group;#P<0.05 vs model group and solution group.
3.3 黄芪注射液对缺氧缺糖/复氧复糖大鼠海马caspase-3 mRNA阳性神经元形态学的影响 原位杂交结果可见,正常对照组大鼠海马神经元核膜完整,突起明显,有少许胞质黄染的阳性细胞。缺氧缺糖/复氧复糖组大鼠海马神经元胞核体积增大,突起回缩,可见大量胞质黄染胞核内有黄色颗粒的阳性神经元;阴性对照组未见胞质和突起黄染的阳性神经元。黄芪注射液溶剂对照组海马神经元亦可见到明显的核皱缩、突起回缩和胞质黄染,海马caspase-3 mRNA阳性神经元的形态学变化与缺氧缺糖/复氧复糖组相一致(P>0.05)。黄芪注射液组大鼠海马神经元有轻微的核皱缩,可见部分神经元胞质黄染。随着复氧复糖时间的延长,缺氧缺糖/复氧复糖组、黄芪注射液组及黄芪注射液溶剂对照组均可见到阳性神经元胞核中黄色颗粒逐渐增多,有明显质核转移现象。见Fig 3。

Fig 3 Methods of in situ hubridization,the effect of astragalus injection on the caspase-3 mRNA positive neuronal cells after hypoxia/hypoglycemia and reoxygenation 24 h in hippocampal neurons of rats(in situ hybridization of caspase-3 probe)(×400).A:Normal group;B:Model group;C:Solution group;D:Astragalus group
3.4 黄芪注射液对缺氧缺糖/复氧复糖大鼠海马caspase-3 mRNA阳性神经元数目和百分率的影响原位杂交结果可见,与正常对照组相比,除0 h和0.5 h 之外,缺氧缺糖/复氧复糖组在 2、6、24、48、72和120 h各时间点caspase-3 mRNA阳性神经元数目、占神经元总数的百分率及平均光密度值均明显增多(P<0.05),于24 h达到高峰。黄芪注射液溶剂对照组以上指标的变化趋势与缺氧缺糖/复氧复糖组相一致(P<0.05)。黄芪注射液组除0 h和0.5 h之外,各时间点阳性神经元数目、占神经元总数的百分率及平均光密度值均比缺氧缺糖/复氧复糖组减少(P<0.05)。见Fig 4。
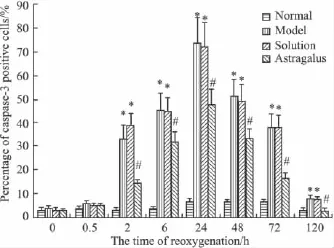
Fig 4 The effect of astragalus injection on the percentage of caspase-3 mRNA positive neuronal cells after hypoxia/hypoglycemia and reoxygenation in hippocampal neurons of rats(±s,n=6)*P<0.05 vs normal control group;#P<0.05 vs model group and solution group
3.5 黄芪注射液对缺氧缺糖/复氧复糖大鼠海马神经元caspase-3蛋白表达的影响 Western blot结果显示,除0 h和0.5 h之外,缺氧缺糖/复氧复糖组大鼠在复氧复糖后2、6、24、48、72 h 和120 h 各个时间点caspase-3蛋白平均灰度值均较正常对照组明显增加(P<0.05);黄芪注射液溶剂对照组各时间点caspase-3蛋白平均灰度值的变化趋势与缺氧缺糖/复氧复糖组相一致(P>0.05);与缺氧缺糖/复氧复糖组相比,除0 h和0.5 h之外,黄芪注射液组各个时间点海马神经元caspase-3蛋白平均灰度值均明显减小(P <0.05)。见 Fig 5、6。

Fig 5 The effect of astragalus injection on expression of caspase-3 protein after hypoxia/hypoglycemia and reoxygenation in hippocamal neurons of rats(caspase-3 immunoreactivity peaked at 24 h)A:Model group;B:Solution group;C:Astragalus group;M:Marker;1:Normal;2:0 h;3:0.5 h;4:2 h;5:6 h;6:24 h;7:48 h;8:72 h;9:120 h
4 讨论
Caspase-3是凋亡过程中最重要的蛋白酶,是多种死亡受体介导凋亡途径的共同下游效应部分,是细胞凋亡蛋白酶级联反应的必经之路,被认为是凋亡的最终执行者[7]。Caspases的激活表现为“瀑布式”的级联反应,而caspase-3是caspases级联反应中下行的最关键的凋亡执行蛋白酶,在各种程序启动的凋亡程序中起最后枢纽的作用[8]。Clerk等[9]在实验中也证实了caspase-3的活化参与了脑缺血后脑组织的丢失。它的激活可通过裂解DNA依赖性蛋白激酶等改变其结构,促使细胞凋亡[10]。有研究发现[11-13],在缺血性神经损伤过程中,抑制caspase-3活性可产生明显的神经保护作用。
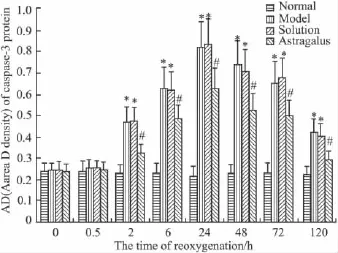
Fig 6 The effect of astragalus injection on the area density(AD)of expression of caspase-3 protein after hypoxia/hypoglycemia and reoxygenation in hippocamal neurons of rats±s,n=6)*P <0.05 vs normal group,#P <0.05 vs model and solution group
黄芪为中医药治疗的常用药物,临床疗效良好,有研究报道其可在整体水平[14-15]和细胞水平[16-17]抑制细胞凋亡的发生,而本研究是在海马神经元原代培养的基础上,证实黄芪注射液可以通过降低凋亡相关基因caspase-3的表达而发挥脑保护作用的。在复氧复糖2 h开始起作用,到复氧复糖24 h作用最强,但黄芪注射液对缺氧缺糖/复氧复糖后海马神经细胞凋亡的作用机制有待于进一步探讨。
本实验观察到缺氧缺糖/复氧复糖后0 h和0.5 h caspase-3 mRNA和蛋白的表达与正常组相比差异无显著性,推测可能是缺氧缺糖/复氧复糖后15、30 min后表达呈现增强趋势,至损伤后24 h达峰值[18]。在复氧复糖2 h开始起作用,到复氧复糖24 h作用最强,但黄芪注射液对缺氧缺糖/复氧复糖后海马神经细胞凋亡的作用机制有待于进一步探讨。
[1]罗玉敏,秦 震.黄芪甲甙对缺血脑组织GSH-px、MDA含量的影响[J].中国临床神经科学,1998,6(3):146-8.
[1]Luo Y M,Qin Z.Effects of astragaloside I on cerebral GSH-px and MDA contents following middle cerebral artery occlusion in mice[J].Chin J Clin Neurosci,1998,6(3)146-8.
[2]张雅丽,高维娟,闫凤霞,等.黄芪注射液抑制缺氧缺糖后复氧复糖大鼠海马神经细胞凋亡的研究[J].中国老年学杂志,2009,29(7):793-6.
[2]Zhang Y L,Gao W J,Yan F X,et al.Study on the inhibitory action of astragalus injection on apoptosis of hippocamal neurons induced by hypoxia hypoglycemia and reoxygenation[J].Chin J Gerontol,2009,29(7):793-6.
[3]叶冬青,高维娟,钱 涛,等.黄芪注射液抑制缺氧缺糖/复氧复糖大鼠海马神经元 JNK3的表达[J].中国药理学通报,2010,26(1):77-82.
[3]Ye D Q,Gao W J,Qian T,et al.Astragalus injection inhibits the expression of JNK3 after hypoxia/hypoglycemia and reoxygenation in hippocampal neurons of rats[J].Chin Pharmacol Bull,2010,26(1):77-82.
[4]闫凤霞,高维娟,钱 涛,等.黄芪注射液对缺氧缺糖/复氧复糖大鼠海马神经元caspase-3表达的影响[J].中国药理学通报,2010,26(7):898-903.
[4]Yan F X,Gao W J,Qian T,et al.The effect of a straga lusinjection on the expressi on of caspase-3 after hypoxia/hypoglycemia and reoxygenation in hippocampal neurons of rats[J].Chin Pharmacol Bull,2010,26(7):898-903.
[5]Brewer G J,Torricelli J R,Evege E K,et al.Optimized survival of hippocampal neurons in B27-supplemented neurobasal,a new serum-free medium combination[J].Neurosci Res,1993,35(5):567-76.
[6]Bossenmeyer P C,Koziel V,Daval J L.Hypoxia/reoxygenation inducing apoptosis through biphasic induction of protein synthesis in cultured rat brain neurons[J].Neuroscience,2000,95(4):1157-65.
[7]Ferrer I,Planas A M.Singaling of cell death and cell survival following focal cerebral ischemia:life and death struggle in the penumbra[J].J Neuronathol Exp Neurol,2003,62(4):329-39.
[8]Faubel S,Edelstein C L.Caspases as drug targets in ischemic organ injury[J].Curr Drug Targets Immune Endocr Metabol Disord,2005,5(3):269-87.
[9]Clerk R S,Kochanek P M,Watkins S C,et al.Caspase-3 mediated neuronal death after traumatic brain injury in rats[J].J Neurochem,2000,74(2);740-53.
[10]Wellington C L,Hayden M R.Caspases and neurodegeneration:on the cuttingedge of new therapeutic approaches[J].Clin Genet,2000,57(1):1-7.
[11]唐映红,李 花,陈北阳,等.邓常清补阳还五汤有效部位对局灶性脑缺血再灌注后Caspase表达的作用[J].中国中西医结合杂志,2006,26(6):533-7.
[11]Tang Y H,Li H,Chen B Y.Effect of active fraction of buyang huanwu decoction on caspase expression in rats after focal cerebral ischemic reperfusion[J].Chin J Integr Tradit West Med,2006,26(6):533-7.
[12]Kuang X,Yao Y,Du J R,et al.Neuroprotective role of Z-ligustilide against forebrain ischemic injury in ICR mice[J].Brain Res,2006:1102(1):145-53.
[13]Li H,Deng C Q,Chen B Y,et al.Total saponins of Panax Notoginseng modulate the expression of caspases and attenuate apoptosis in rats following focal cerebral ischemia-reperfusion[J].J Ethno-pharmacol,2009,121(3):412-8.
[14]Luo Y,Qin Z,Hong Z,et al.Astragaloside IV protects against ischemic brain injury in a murine model of transient focal ischemia[J].Neurosci Lett,2004,363(3):218-23.
[15]贾瑞喆,蒋 犁,乔立兴,等.黄芪对新生鼠乏氧缺血脑损伤海马区神经保护作用的研究[J].中国中药杂志,2003,28(12):1174-7.
[15]Jia R Z,Jiang L,Qiao L X,et al.Neuroprotective effects of Astragulus membranaceus on hypoxia-ischemia brain damage in neonatal rat hippocampus[J].China J Chin Mat Med,2003,28(12):1174-7.
[16]宋 光,何 蕾,江朝光.黄芪注射液对培养乳鼠心肌细胞再灌注损伤的保护作用[J].中国体外循环杂志,2007,5(4):832-4.
[16]Song G,He L,Jiang C G.The protective effect of astragalus injection on reperfusion to cultured myocardial cells[J].Chin J Extracorp Circul,2007,5(4):832-4.
[17]杨 明,杨 敏,黄为民,等.黄芪有效成分抗PC12细胞缺氧损伤作用的研究[J].中国优生与遗传杂志,2008,16(10):38-43.
[17]Yang M,Yang M,Huang W M,et al.Effect of the valuable constituents of astragalus on anoxic injured PC12 cells[J].Chin J Birth Health & Hered,2008,16(10):38-43.
[18]吴 旭,王保捷,张国华,等.大鼠脑损伤后caspase-3表达的时间规律性研究[J].中国医科大学学报,2004,33(4):324-7.
[18]Wu X,Wang B J,Zhang G H,et al.Dynamically changes of caspase-3 and the gene expression of caspase-3 mRNA after traumatic brain injury in rats[J].J China Med Univ,2004,33(4):324-7.
