琥珀酸发酵过程中的产物抑制特征及树脂吸附原位分离的研究*
2011-11-28杨冰许颖季君晖张维王萍丽王小威赵剑
杨冰,许颖,季君晖,张维,王萍丽,王小威,赵剑
(中国科学院理化技术研究所,北京,100190)
琥珀酸发酵过程中的产物抑制特征及树脂吸附原位分离的研究*
杨冰,许颖,季君晖,张维,王萍丽,王小威,赵剑
(中国科学院理化技术研究所,北京,100190)
研究了使用Actinobacillus succinogenes菌种以葡萄糖为底物,发酵生产琥珀酸过程中的产物抑制特征,及使用原位分离技术(ISPR)来消除产物抑制现象,以提高底物转化率。研究发现,该菌种的生长与发酵呈现出明显的非偶联特征,在菌体生长进入稳定期(30 h培养)后,开始大量合成产物琥珀酸。当发酵液中琥珀酸浓度高于25 g/L时,开始出现明显的产物抑制作用,底物转化效率逐渐降低。通过模拟发酵液筛选出了对琥珀酸有较强吸附的D301T、D301R、D303树脂,并通过真实发酵筛选出了对发酵体系无毒性的D301R树脂。最后通过5L发酵罐,对树脂吸附原位分离发酵进行验证,在接种后30h将树脂D301R以40 g/L的量添加入5L发酵罐中,至发酵终点琥珀酸产量达到49.46 g/L(底物葡萄糖60 g/L),底物葡萄糖转化率达到82.43%,相比普通发酵过程,底物转化率提高了21%。
原位分离,树脂吸附,发酵,底物转化率
琥珀酸及其衍生制品可应用到各个领域,包括表面活性剂、电镀行业、食品行业、制药以及新材料等,发酵法制备琥珀酸已经受到越来越广泛的关注[1]。可发酵产琥珀酸的微生物有很多,包括Actinobacillus succinogenes[2]、Anaerobiospirillum succiniciproducens[3]、Mannheimia succiniciproducens[4]以 及 重 组 Eschrichia coli[5]等菌种。其中 A.succinogenes可以利用多种碳源并以琥珀酸为主要发酵产物,而且菌种具有较高的底物及产物耐受性,极具工业生产应用潜力。
A.succinogenes在分批发酵中可以最高耐受葡萄糖达到160 g/L,但当培养基中初始葡萄糖添加量超过65 g/L时,细胞量、琥珀酸产量、葡萄糖转化率都有明显的降低[6]。在生物反应过程中,生物细胞和酶都受到高浓度产物的反馈调节作用,使得生物细胞及酶的潜力不能充分发挥,造成产率和原料的转化率难以提高[7]。虽然A.succinogenes可以耐受琥珀酸达42 g/L,但当琥珀酸浓度在20 g/L时细胞生长也会受到明显的抑制,类似于其他发酵终产物的抑制作用[8]。
目前许多研究者都把研究焦点放在菌株改良和发酵培养基调控上,以提高发酵产量[9],只有少量研究集中在产物抑制以及发酵产物分离上[10]。为改善生物反应过程中的产物抑制现象以实现高效连续的生物合成与转化,一种将生物反应与产物分离耦合的技术(In Situ Production Removal,ISPR)已经逐渐成为国内外的研究热点[11]。采用这种原位分离技术可选择性地从培养液中连续分离有抑制性、毒性或不稳定性产物,不仅可使反应过程向生成产物的方向进行,同时还能大大降低产物的自然降解作用。目前研究的原位分离发酵技术有很多,包括膜发酵法、电渗析法、溶剂萃取法以及吸附法,从工业化生产角度来看,树脂吸附法以其成本低、选择性高、交换容量大、操作简单易于自动控制等优点而更加具有竞争力。
本研究选择使用A.succinogenes菌种进行发酵,研究琥珀酸发酵过程中菌体生长与产物合成的特征曲线以及产物抑制特征,利用树脂吸附法进行原位分离发酵,使体系中琥珀酸浓度始终保持在较低的水平,以减少产物的反馈抑制作用,从而大大提高了发酵底物的转化率。
1 实验材料和实验方法
1.1 实验材料
1.1.1 菌种保藏及活化
菌种A.ssuccinogenes,购自中国工业微生物菌种保藏管理中心,本实验室采用10%(v/v)甘油于-20℃保藏。菌种使用时,先将保藏在冷冻甘油管中的菌液在40℃水浴中活化1min,接入肉汤培养基,39℃培养20 h,待菌液浑浊后再接入新鲜斜面培养基培养20 h,转置4℃冰箱保存备用。
1.1.2 培养基
斜面培养基:胰蛋白胨大豆琼脂30.0 g/L。
种子培养基(g/L):酵母粉 5.0,K2HPO415.5,NaHCO310,NaH2PO48.5,Na2S·9H2O 0.02%,种子液使用斜面接种,在接种后培养20h后菌液达到浑浊状态备用;
发酵培养基(g/L):酵母粉10.0,K2HPO43.0,NaCl 1.0,CaCl20.2,MgCl20.2,VB1220 mg,叶酸 20 mg,核黄素 20 mg,烟酸 20 mg,对氨基苯甲酸 50 mg,生物素 10 mg,Vb16100 mg,硫胺素 20 mg,泛酸 50 mg。
以上培养基均在121℃,灭活15 min,所用试剂均为分析纯,国产。
1.1.3 树脂
吸附树脂:ADS-5、ADS-7、ADS-8、D3520、D4020;弱碱性阴离子树脂:D301R、D301T、D303、D296、D315、HZD-9,均为南开大学化工厂提供。将树脂用蒸馏水洗涤2次,再用95%乙醇浸泡20h,将树脂冲洗至无乙醇气味为止。再用2%HCl溶液与2%NaOH溶液交替洗脱处理,最后用2%NaOH保留,洗脱至中性备用。
1.2 实验方法
1.2.1 琥珀酸发酵过程曲线绘制
采用5 L发酵罐进行发酵实验,接种量为10%、发酵温度39℃、搅拌速度180 r/min、100%CO2,通气量50 mL/min,pH值6.5、5 mol/L NaOH调节酸度值,接种后每隔4~6h取样1次,测定琥珀酸浓度及菌液浓度,发酵终点为发酵液中葡萄糖浓度不再变化或没有产物生成为止。
1.2.2 产物抑制特征的研究
在产物对底物转化的抑制特征实验中,采用250 mL三角瓶摇床发酵,每组包含3个平行实验,不同实验组的初始发酵培养基中加入不同量的琥珀酸钠盐,空白对照组不加入琥珀酸钠盐。每个三角瓶中加入碱式MgCO360.0g/L调节发酵体系内pH及供给底物转化所需 CO2,摇瓶发酵条件为:接种量10%,39℃,120 r/min,4 d。
1.2.3 原位分离树脂的筛选
采用模拟发酵液:甲酸2.0 g/L,乙酸8.0 g/L,乳酸8.0 g/L,琥珀酸80.0 g/L,在3组共33只三角瓶中各加入100 mL模拟发酵液后,再分别加入11种不同型号树脂各5 g,39℃,120 r/min摇床培养48 h后测定各三角瓶中模拟发酵液酸含量,计算各种树脂吸附量。
1.2.4 吸附树脂对发酵体系的毒性研究
在研究树脂对发酵体系的毒性研究实验中,采用250 mL三角瓶摇床发酵,每组包含3个平行实验,将对琥珀酸有较强吸附的树脂,分别加入到一系列250 mL的三角瓶中,再加入等量200 mL发酵培养基。每个三角瓶中加入碱式MgCO360.0g/L调节发酵体系内pH及供给底物转化所需CO2,摇瓶发酵条件为:接种量为 10%、39℃、120 r/min,4 d。
1.2.5 原位分离发酵的验证实验
将对发酵体系无毒性的树脂在接种30 h后加入到发酵罐中,自动控制发酵工艺参数,验证使用树脂原位分离技术对提高发酵产量及底物转化率的效果。发酵条件:接种量为 10%,39℃,180 r/min,100%CO2,通气量 50 mL/min,pH 值 6.5、5 mol/L NaOH 调节发酵液内pH值。
1.2.6 分析方法
发酵液中产物分析:HPLC(Agilent 1200);流动相为99%的稀H2SO4溶液(pH值3)与1%乙腈的混合液,流速1 mL/min,外标法定量,所用试剂均为色谱纯。
摇瓶中树脂吸附琥珀酸浓度(Cy)测定:将发酵液中树脂过滤提取后装入层析柱(Φ30 mm×250 mm),2%NaOH洗脱,洗脱速率为1 mL/min,直至洗脱液为强碱性为止。使用HPLC测定洗脱液中琥珀酸浓度c1,洗脱液体积为V1,计算洗脱液中琥珀酸含量S=c1×V1,发酵罐中发酵液体积为V2,所以树脂吸附琥珀酸浓度cy=c1×V1/V2。
发酵罐中树脂吸附琥珀酸浓度(cf)测定:将发酵液中树脂过滤提取后装入层析柱(Φ80 mm×1 000 mm),2%NaOH洗脱,洗脱速率为2 mL/min,直至洗脱液为强碱性为止。使用HPLC测定洗脱液中琥珀酸浓度c1,洗脱液体积为V1,计算洗脱液中琥珀酸含量S=c1×V1,发酵罐中发酵液体积为V2,所以树脂吸附琥珀酸浓度cf=c1×V1/V2。
琥珀酸总量:(1)吸附树脂毒性验证实验,琥珀酸总量S=c+cy,其中:c为发酵液中琥珀酸测定量。
(2)原位分离发酵验证实验,琥珀酸总量S=c+cf,其中:c为发酵液中琥珀酸测定量。
发酵液中菌液浓度测定:SP-721型可见光分光光度计,660 nm波长处测定。
发酵液中残糖量测定:DNS法(3,5-二硝基水杨酸比色法),SP-721型可见分光光度计,540 nm波长测定,外标法定量,所用试剂均为分析纯。
2 实验结果与讨论
2.1 琥珀酸发酵过程曲线
琥珀酸是A.ssuccinogenes菌种的主要代谢产物,其分批发酵过程曲线如图1所示。
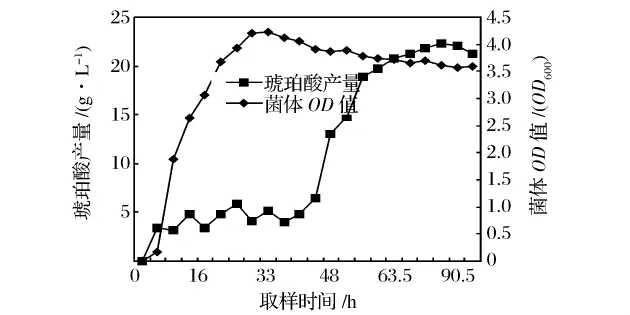
图1 琥珀酸发酵过程曲线
由图1可以看出,A.succinogenes在分批发酵过程中,菌体生长在经过短暂的延滞期(约4 h)后,迅速进入对数生长期(约4~30 h),此阶段菌体量快速增长,直至最大值,随后菌体繁殖速度明显减慢,菌体量大致保持稳定。发酵开始由菌体生长期转入产物合成期,琥珀酸开始逐渐积累,直至最高峰。之后菌体开始出现自溶,产物合成能力衰退。
菌体生长和琥珀酸合成表现出明显的非偶联特征,琥珀酸发酵过程可分成两个区间,在接种后0~30h为菌体生长期,30~80h为产物合成期。在生长期产物的浓度很低,尚未达到对菌体生长产生抑制的浓度;进入产物合成期时,菌体生长几乎停止,菌体进入稳定期。所以,如果在菌体生长进入稳定期后加入吸附树脂,可以及时移走产物琥珀酸,大大降低其在发酵液中的浓度,减缓产物自身带来的反馈抑制。
2.2 产物抑制特征
为了评估发酵产物在A.succinogenes发酵过程的抑制作用,在初始发酵培养基中添加不同浓度琥珀酸盐,在底物葡萄糖为30 g/L和60 g/L的浓度下分别进行发酵实验。
从图2中可以看出,培养基中底物葡萄糖初始浓度为30 g/L时,琥珀酸盐添加量高于25 g/L时就会产生较为明显的抑制作用,发酵液中琥珀酸的产量较低,而乙酸及乳酸的产量也会受到影响,有降低的趋势。琥珀酸盐的添加可以引起较为明显的产物抑制作用。在图3中培养基底物葡萄糖初始浓度为60 g/L时,琥珀酸盐添加量高于25 g/L时也会对发酵过程会产生抑制作用,但由于培养基中底物浓度较大,抑制作用较为缓和,同时受底物浓度大的影响,乙酸及乳酸的产量并未受到明显影响。
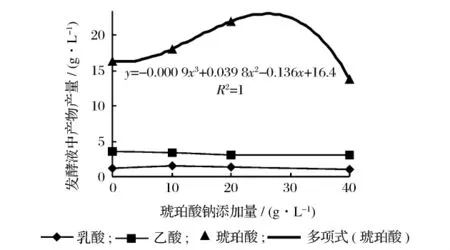
图2 葡萄糖浓度为30 g/L条件下酸产量
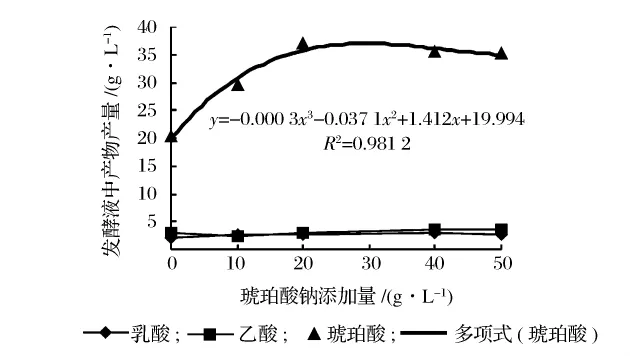
图3 葡萄糖浓度为60 g/L条件下酸产量
无论底物葡萄糖浓度高低,琥珀酸盐添加量与发酵终产物产量都符合一定的函数关系,产物的抑制作用都在25 g/L时开始出现。琥珀酸是在细胞内的三羧酸循环中受一系列酶催化而生成的,发酵液中琥珀酸浓度达到一定值时,就会对整个发酵体系产生反馈抑制,使得底物转化率降低,产物生成量降低。虽然这种产物抑制现象会随底物浓度的增加而减弱,但研究表明[8],在分批发酵中当培养基中初始葡萄糖浓度超过65 g/L时,会使得细胞量、琥珀酸产量、葡萄糖转化率都有明显的降低。所以为了提高底物的转化率,降低生产成本,增加琥珀酸的发酵产量,采用原位分离技术将发酵与分离相耦合,及时移走发酵产物,减少产物抑制是一种值得尝试的方法。
2.3 原位分离树脂筛选
采用模拟发酵液,对11种大孔吸附树脂及弱碱性阴离子树脂进行筛选,结果如图4所示。
由图4可以看出,11种树脂中,D301R、D301T、D303对琥珀酸的吸附作用最为明显,HZD-9和D315对琥珀酸吸附作用其次,D296对琥珀酸也有一定的吸附作用,而其他树脂对琥珀酸的吸附能力较弱。其中D301R、D301T对乳酸也有较强的吸附作用,ADS-5、ADS-7、ADS-8、D3520、D4020 树脂对模拟发酵液中的低分子乳酸、乙酸、琥珀酸的吸附量都很少。由于大孔吸附树脂是靠良好的大孔网状结构和较大的比表面积对溶液中的物质进行物理吸附,而弱碱性阴离子树脂含有弱碱性基团OH-,树脂的正电基团能与溶液中的阴离子吸附结合,从而产生阴离子交换,吸附模拟发酵液中的酸根离子,所以弱碱性阴离子树脂D301R、D301T、D303对琥珀酸均有很强的吸附作用,对他们进行模拟原位吸附分离发酵实验。
2.4 原位分离树脂的毒性研究
原位分离发酵过程中,树脂的性质对发酵体系的影响很大,树脂是否有细胞毒性及对发酵体系的毒性影响,也需要充分的考量。实验结果如图5所示。
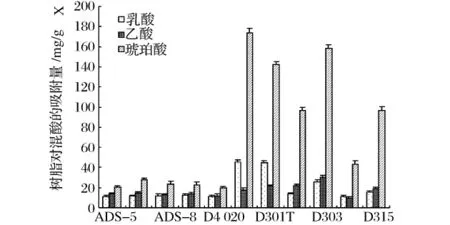
图4 不同树脂对模拟发酵液中各种酸的吸附量

图5 添加不同型号树脂的发酵体系发酵状况
A.succinogenes是厌氧发酵,在葡萄糖转化成琥珀酸的过程中,CO2的供给量决定了PEP羧化酶的活性,摇瓶发酵环境内的CO2供给靠添加的碱式提供,所以琥珀酸产量较发酵罐低。从图5可以看出,经过4 d发酵,未加入树脂的空白三角瓶发酵液中琥珀酸含量最高,加入树脂D301R的摇瓶溶液中琥珀酸含量也较高,而加入树脂D301R和D303的摇瓶内琥珀酸含量较低。将加入至各三角瓶内的树脂洗脱后测定其吸附的琥珀酸量,可以看出D301R、D301T、D303三种树脂的吸附量比较相近,与之前测定结果相符。计算后可以看出,加入树脂D301R的摇瓶在整个发酵过程所产生的琥珀酸量最多,残糖量最低,加入树脂D301T和D303的摇瓶内所产生的琥珀酸量都较空白低。这说明树脂D301R无细胞毒性,对细胞生长影响较小,对发酵体系也不存在毒性,随着细胞进入生长稳定期,琥珀酸在发酵液中浓度增加,树脂开始逐渐吸附部分琥珀酸,降低了琥珀酸在发酵液中的浓度,使得底物葡萄糖进一步向合成琥珀酸方向转化,当树脂吸附饱和时,发酵液中琥珀酸浓度趋于恒定,葡萄糖转化停止,发酵终止。而添加了D301T和D303的摇瓶中,残糖量和琥珀酸量都较空白摇瓶低,可能是由于树脂的存在影响了微生物代谢产物合成的方向,使得代谢过程向其他分支进行,底物葡萄糖转化成包含乳酸、甲酸、乙酸、琥珀酸在内的多种产物。
2.5 原位分离发酵验证实验
在实际发酵罐发酵过程中,发酵参数可以自动化控制,发酵体系更加稳定、容易操控,所以为了进一步考查在真实发酵体系中,原位分离技术对底物转化率的影响,使用5L发酵罐进行发酵实验。底物葡萄糖浓度为60 g/L,树脂 D301R采用121℃高温灭菌15min,在接种30 h后,以40 g/L的添加量加入到发酵罐中,实验结果如图6所示。
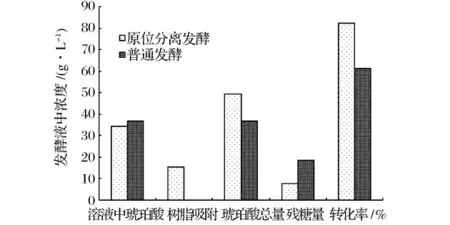
图6 原位分离发酵与普通发酵结果对比
由图6可以看出,普通发酵至终点时溶液中琥珀酸浓度为36.87 g/L,原位分离发酵至终点时溶液中琥珀酸浓度为34.21 g/L。原位分离树脂吸附了15.25 g/L的琥珀酸,琥珀酸产量为49.46 g/L,残糖量仅为7.58 g/L,产物转化率达82.43%。通过原位分离,树脂移走了发酵液中30%的产物。
根据之前的研究结果可知,在普通发酵过程中,当发酵液中琥珀酸浓度达到25 g/L时,底物转化即受到了反馈抑制,转化率降低,直到琥珀酸浓度为36.87 g/L时,底物及产物浓度不再变化,发酵终止。而在添加树脂的原位分离发酵过程中,在琥珀酸合成初期,是一个边发酵边吸附的过程,树脂的添加可以有效地将发酵液中琥珀酸浓度控制在较低的水平,降低了产物的反馈抑制作用,为底物的持续高效转化提供了良好的基础。
采用原位分离技术,可以将琥珀酸产量提高至49.46 g/L,底物转化率由61.45%提高至82.43%,在一定程度上提高了琥珀酸的产量和底物的转化率,该工艺为放大生产工艺中节约成本,提高发酵效率提供了基础和参考。
3 结论
使用A.succinogenes菌种进行分批发酵,当发酵液中琥珀酸浓度达到25 g/L时,即出现产物反馈抑制的现象。在发酵过程中加入筛选后的弱碱性阴离子树脂D301R,进行原位吸附分离发酵可以很好地解决发酵过程的产物抑制,实现了产物的边合成边吸附,使产物浓度在发酵液中保持较低水平。使用该发酵工艺可将琥珀酸发酵底物的转化率从61.45%提高至82.43%,既提高了发酵底物的转化率,又减轻了下游产物回收的压力,是一种比较值得深入研究的技术方法。
[1] Zeikus J G,Jain M K,Elankovan P.Biotechnology of succinic acid production and markets for derived industrial products[J].Appl Microbiol Biotechnol,1999(51):545-552.
[2] Kim P,Laivenieks M,McKinlay J,et al.Construction of a shuttle vector for the over expression of recombinant proteins in Actinobaccillus succinogenes[J].Plasmid,2004(51):108-115.
[3] Lee P C,Lee W G,Lee S Y,et al.Succinic acid production by Anaer-obiospirilum succiniciproducens:effects of the H2/CO2supply and glucose concentration[J].Enzyme Microb Technol,1999(24):549 -554.
[4] Kim D Y,Yim S C,Lee P C,et al.Batch and continuous fermentation of succinic acid from wood hydrolysate by Mannheimia succiniciproducens MBEL55E[J].Enzyme Microb,Technol,2004(35):648 -653.
[5] Sanchez A M,Bennett G N,San K Y.Efficient succinic acid production from glucose through overexpression of pyruvate carboxylase in Escherichia coli.Alcohol dehydrogenate and lactate dehydrogenase mutant[J].Biotechnol Progr,2005(21):358 - 365.
[6] Guettler M V,Jain M K,Soni B K.Process for making succinic acid,microorganisms for use in the process and methods of obtaining the microorganisms[P].Michigan Biotechnology Institute,USA,US.5504004,1996.
[7] Du C,Lin S,Koutinas A,et al.Succinic acid production from wheat using a biorefining strategy[J].Appl Microbiol Biotechnol,2007(76):1 263 -1 270.
[8] Schugerl K.Integrated processing of biotechnology products[J].Biotechnology Advances,2000(18):581 -599.
[9] Liu Y P,Zheng P,Sun Z H,et al.Economical succinic acid production from cane molasses by Actinobacillus succinogenes[J].Bioresour Technol,2008(99):1 736 -1 742.
[10] Song H,Jang S H,Park J M,et al.Modeling of batch fermentation kinetics for succinic acid production by Mannheimia succiniciproducens[J].Biochem Eng J,2008(40):107-115.
[11] Stark D,Vonstpockar U.In situ product removal(ISPR)in whole cell biotechnology during the last twenty years[J].Advances in Biochemical Engineering,2003(80):149-175.
The Study on the Characteristic of Product Inhibition and the in Situ Product Pemoval Using Resin Adsorption in Succinic Acid Fermentation Process
Yang Bing,Xu Ying,Ji Jun-hui,Zhang Wei,Wang Ping-li,Wang Xiao-wei,Zhao Jian
(Technical Institute of Physics and Chemistry,China Academy of Sciences,Beijing 100190)
The characteristics of product inhibition on the growth of Actinobacillus succinogenes in fermentation using glucose as the major carbon source and the technology of the In Situ Product Removal(ISPR)with resin adsorption to alleviate the product inhibition were studied.The study showed that the characteristic of the cells growing process and the succinic acid synthesizing process was non-coupling,which means that the cells started to synthesize succinic acid in the stationary growth stage(after cultivation for 30 hours).The product inhibition became more and more obvious when the succinic acid concentration was over 25g/L in the fermentation broth,and the conversion rate of the substrate became decreased.Through simulative fermentation broth,resin of D301T,D301R and D303 have been selected,which have great adsorptive capacity of the succinic acid.D301R was innocuous in the ISPR,which was finally ascertained by using in the real fermentation system.Application effect of the ISPR with resin was confirmed through 5L automatic fermentor,and 40 g/L D301R resin was added after 30 hours cultivation.After the fermentation process was finished,the concentration of the succinic acid can reach 49.46g/L(the substrate of glucose is 60 g/L)and the glucose conversion rate can reach 82.43%,the substrate conversion rate was increased by 21%comparing with usual fermentation Method.
In Situ Product Removal(ISPR),resin,fermentation,substrate conversion rate
