手性氨基亚磺酰胺的合成及其对N-苯基酮亚胺不对称还原的催化作用*
2011-11-26卢晓霞
王 萌, 王 超, 卢晓霞, 孙 健
(1. 中国科学院 成都生物研究所 天然产物研究中心,四川 成都 610041;2. 中国科学院 研究生院,北京 100049)
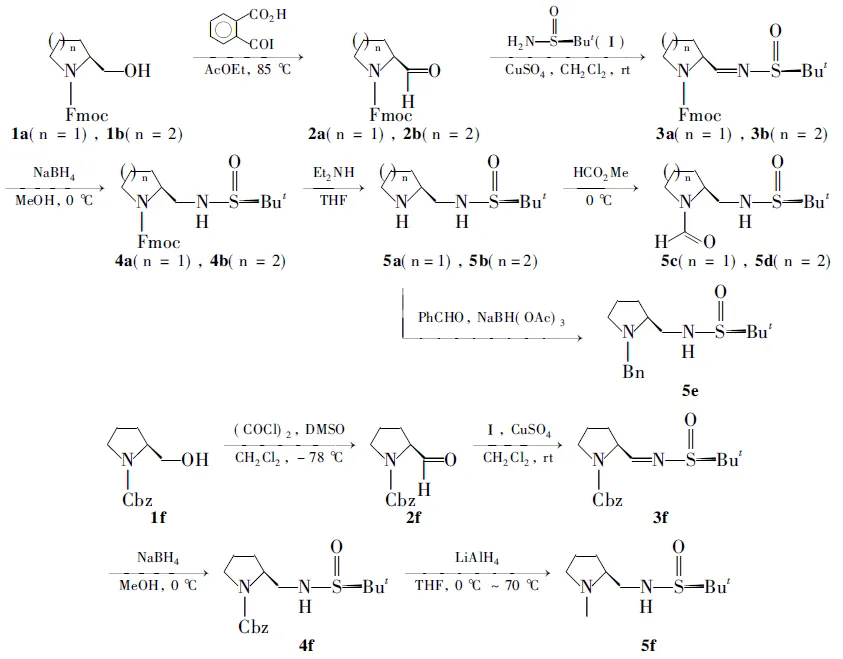
Scheme 1
本文在前期工作[10~16]的基础上,从手性α-氨基醇(1a,1b和1f)和(R)-叔丁基亚磺酰胺(Ⅰ)出发,进一步设计并合成了一系列新型的同时含有C-手性和S-手性的氨基亚磺酰胺有机小分子催化剂(5a~5f, Scheme 1),其结构经1H NMR和MS表征。将5应用于N-苯基酮亚胺的不对称硅氢化反应中作催化剂,获得了较好的结果。
1 实验部分
1.1 仪器与试剂
Brucker-600型和300型核磁共振仪(CDCl3为溶剂,TMS为内标);Waters Q-tof Premier型质谱仪;Agilent Technologies 1200 Series型高效液相色谱仪(手性柱AS-H, AD-H, OD-H 和OJ-H)。
所用试剂均为分析纯;柱层析使用硅胶H,青岛海洋化工厂。
1.2 合成
(1)N-Fmoc-L-脯胺醛(2a)的合成
在反应瓶中加入N-Fmoc-L-脯胺醇(1a) 2 g(6.2 mmol)的乙酸乙酯(50 mL)溶液和邻-碘酰基苯甲酸5.2 g(18.5 mmol),搅拌下于85 ℃反应3 h。冷却至室温,过滤,滤液浓缩得粗品2a(2 g)直接用于下步反应。
(2) (R)-N-Fmoc-L-脯胺叔丁基亚磺酰基亚胺(3a)的合成
在反应瓶中加入2a1.1 g(3.43 mmol), Ⅰ 500 mg(4.11 mmol)和二氯甲烷20 mL,搅拌下加入无水CuSO41.1 g(6.9 mmol), 于室温反应48 h。过滤,滤液减压浓缩后经硅胶柱层析[洗脱剂: A=V(石油醚) ∶V(乙酸乙酯)=3 ∶1]纯化得淡黄色固体3a1.4 g,产率96%。
(3) (R)-N-Fmoc-L-脯胺叔丁基亚磺酰胺(4a)的合成
在反应瓶中加入3a1.4 g(3.3 mmol)和甲醇15 mL,搅拌下于至0 ℃加入 NaBH4250 mg(6.6 mmol),于室温反应5 h。加入丙酮(1 mL)淬灭反应,蒸除溶剂,残余物用饱和氯化铵溶液洗涤,二氯甲烷(3×20 mL)萃取,合并有机相,用饱和食盐水洗涤,无水MgSO4干燥,减压浓缩得粗品4a(1.4 g),直接用于下步反应。
(4) (R)-L-脯胺叔丁基亚磺酰胺(5a)和(R)-α-哌嗪叔丁基亚磺酰胺(5b)的合成
在反应瓶中加入4a1.4 g(3.3 mmol)和THF 20 mL,搅拌下加入二乙基胺4 mL,于室温反应6 h。减压浓缩后经硅胶柱层析[洗脱剂:B=V(二氯甲烷) ∶V(甲醇)=15 ∶1]纯化得黄色固体5a350 mg,产率52%;1H NMRδ: 1.19(s, 9H), 1.37~1.41(m, 1H), 1.69~1.83(m, 3H), 2.30(s, 1H), 2.88~2.92(m, 3H), 3.18~3.23(m, 1H), 3.38~3.41(m, 1H), 3.90(brs, 1H); ESI-HR-MSm/z: Calcd for [C9H20N2OS+H]+205.129 6, found 205.138 2。
以1b代替1a,用类似方法[1.2(1)~1.2(4)]合成黄色固体5b[洗脱剂:B=40 ∶1] 350 mg,产率52%;1H NMRδ: 1.17~1.18(m, 1H), 1.21(s, 9H), 1.35~1.39(m, 2H), 1.58~1.59(m, 2H), 1.62~1.63(m, 1H), 2.24(br s, 1H), 2.62~2.69(m, 2H), 2.94~2.98(m, 1H), 3.06~3.08(m, 1H), 3.19~3.23(m, 1H),3.59(t,J=5.62 Hz, 1H); ESI-HR-MSm/z: Calcd for [C10H22N2OS+H]+219.145 3, found 219.153 7。
(5) (R)-N-甲酰-L-脯胺叔丁基亚磺酰胺(5c)和(R)-N-甲酰-α-哌嗪叔丁基亚磺酰胺(5d)的合成
在反应瓶中加入5a150 mg(0.75 mmol)和甲酸甲酯(5 mL),搅拌下于室温反应12 h。减压浓缩后经硅胶柱层析(洗脱剂:B=40 ∶1)纯化得浅黄色固体5c127 mg,产率75%;1H NMRδ: 1.18(s, 9H), 1.72~1.91(m, 4H), 2.35(br s, 1H), 3.17~4.14(m, 4H), 4.68(t,J=5.62 Hz, 1H), 8.23(s, 1H); ESI-HR-MSm/z: Calcd for [C10H20N2O2S+H]+233.124 5, found 233.132 7。
以5b代替5a,用类似方法合成浅黄色固体5d(洗脱剂:B=40 ∶1) 127 mg,产率75%;1H NMRδ: 1.13(s, 9H), 1.33~1.69(m, 6H), 1.83(br s, 1H), 3.08~3.19(m, 2H), 3.31~3.75(m, 1H), 3.55~3.57(m, 1H), 4.53~4.55(m, 1H), 8.01(s, 1H); ESI-HR-MSm/z: Calcd for [C11H22N2O2S+H]+247.140 2, found 247.147 9。
(6) (R)-N-苄基-L-脯胺叔丁基亚磺酰胺(5e)的合成
在反应瓶中加入5a150 mg(0.75 mmol), 1,2-二氯乙烷6 mL和苯甲醛87 mg(0.83 mmol),搅拌下加入NaBH(OAc)3200 mg(0.9 mmol),于室温反应24 h。加入丙酮 (1 mL)淬灭反应。蒸除溶剂,用饱和NH4Cl水溶液洗涤,乙酸乙酯(3×20 mL)萃取,合并有机相,用饱和食盐水洗涤,无水MgSO4干燥,减压浓缩后经硅胶柱层析[洗脱剂:B=40 ∶1]纯化得浅黄色固体5e220 mg,产率83%;1H NMRδ: 1.23(s, 9H), 1.64~1.71(m, 2H), 1.88~1.92(m, 1H), 2.20~2.26(m, 2H), 2.79(br s, 1H), 2.96~3.04(m, 2H), 3.30~3.42(m, 2H), 4.01(s, 1H), 4.06(s, 1H), 7.22~7.31(m, 5H); ESI-HR-MSm/z: Calcd for [C16H26N2OS+H]+295.176 6, found 295.184 8。
(7) (R)-N-甲基-L-脯胺叔丁基亚磺酰胺(5f)的合成
在反应瓶中加入草酰氯1.4 mL(16.1 mmol)和二氯甲烷80 mL,搅拌下于-78 ℃加入DMSO 2.05 mL(28.98 mmol)的二氯甲烷(24 mL)溶液,反应15 min;缓慢滴加N-Cbz-L-脯胺醇(1f) 1.5 g(6.44 mmol)的二氯甲烷(21 mL)溶液,滴毕,反应30 min;滴加三乙胺4.78 mL(32.2 mmol),滴毕,用水(10 mL)淬灭反应,减压浓缩后用乙酸乙酯(3×45 mL)萃取,合并有机层,依次用水(15 mL),饱和食盐水(5 mL)洗涤,无水Na2SO4干燥,减压浓缩后经硅胶柱层析(洗脱剂: A=10 ∶1)纯化得无色油状液体N-Cbz-L-脯胺醛(2f) 1.33 g,产率90%。
以2f代替2a,用类似方法[1.2(2), 1.2(3)]合成浅黄色油状液体(R)-N-Cbz-L-脯胺叔丁基亚磺酰基亚胺(3f, 洗脱剂:A=10 ∶1)和浅黄色油状液体(R)-N-Cbz-L-脯胺叔丁基亚磺酰胺(4f, 洗脱剂: A=1 ∶1)。
在反应瓶中加入4f372 mg(1.14 mmol)和THF 6 mL,搅拌下于0 ℃加入LiAlH4100 mg(2.63 mmol),于70 ℃反应3 h。用水(0.1 mL)淬灭反应,依次加入15%NaOH溶液(0.1 mL)和水(0.3 mL),过滤,滤液减压浓缩后经硅胶柱层析(洗脱剂:B=20 ∶1)纯化得浅黄色固体5f62 mg,产率25%;1H NMRδ: 1.21(s, 9H), 1.67~1.74(m, 2H), 1.85~1.87(m, 1H), 2.23~2.28(m, 2H), 2.33(s, 3H), 2.45(br s, 1H), 3.02~3.06(m, 2H), 3.27~3.32(m, 1H), 3.90(br s, 1H); ESI-HR-MSm/z: Calcd for [C10H22N2OS+H]+219.145 3, found 219.153 2。
1.3 5催化的N-苯基酮亚胺的不对称硅氢化反应
在卷口试管(10 mL)中加入5 0.02 mmol,N-苯基酮亚胺0.1 mmol和二氯甲烷1 mL,搅拌下于-20 ℃加入HSiCl30.04 mL,反应24 h。依次用饱和氯化铵(1 mL)溶液,饱和碳酸氢钠溶液(1 mL)淬灭反应,用乙酸乙酯(3×15 mL)萃取,合并有机相,用无水MgSO4干燥,浓缩后经柱层析(洗脱剂:A=20 ∶1)纯化得浅黄色油状液体N-苯基手性胺。
2 结果与讨论
2.1 5的合成
从N-保护的手性氨基醇出发,通过氧化成醛后,与(R)-叔丁基亚磺酰胺发生缩合反应得到叔丁基亚磺酰基亚胺化合物,再经过一步还原胺化合成了一系列新型的同时含有C-手性和S-手性的氨基亚磺酰胺有机小分子催化剂。
2.2 5催化的N-苯基酮亚胺的不对称硅氢化反应
以N-苯基酮亚胺的不对称硅氢化反应(Scheme 2)为模板,反应条件同1.3,考察5的催化性能,实验结果见表1。从表1可以看出,5均能催化N-苯基酮亚胺的不对称硅氢化反应。其中,以五元环为骨架的5a和5c的催化效果优于以六元环为骨架的5b和5d。另外,5a和5b环上的氮原子被甲酰化后(5c和5d),其催化活性有较大提高(收率>90%),但是对映选择性却明显降低(<50%)。此外,我们发现当5a的氮原子上带有芳香基团如苄基时(5e),其立体控制作用增强,但催化效果较差;然而若将苄基替换成甲基时(5f),其对映选择性与5a相当,并且催化效果有所提高。总体来讲,5f表现最为优秀,其催化还原产物N-苯基手性胺可以达到68%的收率和69%的对映选择性。
Scheme 2

表1 5催化的N-苯基酮亚胺的不对称硅氢化反应
3 结论
本文首次从手性氨基醇和手性叔丁基亚磺酰胺出发设计并合成一类新型路易斯碱催化剂,并将其应用于酮亚胺的不对称硅氢化反应,获得了中等的收率与对映选择性。
[1] Vilaivan T, Bhanthumnavin W, Sritana-Anant Y. Recent advances in catalytic asymmetric addition to imines and related C=N systems[J].Curr Org Chem,2005,9:1315-1392.
[2] Blaser H U, Malan C, Pugin B. Selective hydrogenation for fine chemicals:Recent trends and new developments[J].Adv Synth Catal,2003,345:103-151.
[3] Tang W, Zhang X. New chiral phosphorus ligands for enantioselective hydrogenation[J].Chem Rev,2003,103:3029-3069.
[4] Adams J P. Imines,enamines and oximes[J].J Chem Soc Perkin Trans,2000,1:125-139.
[5] Kobayashi S, Ishitani H. Catalytic enantioselective addition to imines[J].Chem Rev,1999,99:1069-1094.
[6] Bloch R. Additions of organometallic reagents to C=N bonds: reactivity and selectivity[J].Chem Rev,1998,98:1407-1438.
[7] Malkov A V, Mariani A, MacDougall K N. Role of noncovalent interactions in the enantioselective reduction of aromatic Ketimines with trichlorosilane[J].Org Lett,2004,6:2253-2256.
[8] Malkov A V, Stewart Liddon A J P, Ramírez-López P. Remote chiral induction in the organocatalytic hydrosilylation of aromatic ketones and ketimines[J].Angew Chem Int Ed,2006,45:1432-1435.
[9] Malkov A V, Stoncius S, Kocovsky P. Enantioselective synthesis of 1,2-diarylaziridines via organocatalytic reductive amination ofα-chloro ketones[J].Angew Chem Int Ed,2007,46:3722-3725.
[10] Wang Z, Sun J. A highly enantioselective lewis basic organocatalyst for reduction ofN-aryl imines with unprecedented substrate spectrum[J].Org Lett,2006,8:999-1001.
[11] Wang Z, Sun J. L-piperazine-2-carboxylic acid derivedN-formamide as highly enantioselective Lewis basic catalyst for hydrosilylation ofN-aryl imines with an unprecedented substrate profile[J].Org Lett,2006,8:3045-3048.
[12] Wang Z, Sun J. Enantioselective hydrosilylation of ketimines catalyzed by Lewis basicC2-symmetric chiral tetraamide[J].Tetrahedron: Asymmetry,2007,18:705-709.
[13] Zhou L, Sun J. Evolution of chiral Lewis basicN-formamide as highly effective organocatalyst for asymmetric reduction of both ketones and ketimines with an unprecedented substrate scope[J].Chem Commun,2007:2977-2979.
[14] Pei D, Sun J.S-chiral sulfinamides as highly enantioselective organocatalysts[J].Org Lett,2006,8:5913-5915.
[15] Pei D, Sun J. Rationally-designedS-chiral bissulfinamides as highly enantioselective organocatalysts for reduction of ketimines[J].Adv Synth Catal,2008,350:619-623.
[16] Wang C, Sun J. A highly enantioselective organocatalytic method for reduction of aromaticN-alkyl ketimines[J].Chem Eur J,2008,14:8789-8792.
