Lrrc10蛋白的表达、纯化及多克隆抗体的制备
2011-11-24周云雷吴秀山袁婺洲
闵 璐,周云雷,周 煌,吴秀山,袁婺洲
(湖南师范大学蛋白质化学与发育生物学教育部重点实验室,心脏发育研究中心,中国 长沙 410081)
Lrrc10 (Leucine-rich Repeat Containing protein 10)是第一个被报道的具有心脏特异性表达的LRR(leucine-rich repeat,富亮氨酸重复序列)家族蛋白.近年来,多个实验室对小鼠Lrrc10 基因进行了研究报道,它是一个无内含子的基因,在小鼠心脏组织中有大量的特异性表达.Lrrc10在小鼠胚胎期心脏的表达部位与NKX2-5/CSX(cardiacspecifichomeobox)表达极其相似,亚细胞定位实验显示Lrrc10在细胞质与细胞核都有表达,进一步分离的新生大鼠心肌细胞实验证明了是在Z-线上和横小管上表达[1].RNA干扰斑马鱼Lrrc10 后,斑马鱼胚胎的心脏不能正常环化,心脏收缩因子cmlc-2(cardiacessentialmyosinlightchain-1)的表达下调,胚胎发育6~7天后死亡.这说明Lrrc10 对于斑马鱼胚胎期心脏的形成和功能至关重要[2].
但是Nikolay指出[3],Lrrc10 敲除小鼠的心脏发育并没有出现异常现象,Lrrc10基因对于小鼠心脏的发育并非必需.也许是因为小鼠心脏发育的复杂程度高于斑马鱼,Lrrc10蛋白在小鼠心脏中的缺失,可能有其他同源性较高的功能相似的蛋白起到了代偿作用,具体原因有待进一步研究.
同时,人类与小鼠的Lrrc10 基因在氨基酸水平的相似性高达84%.Lrrc10在人类心脏组织中也特异性表达.虽然小鼠Lrrc10 基因敲除后对心脏发育和功能没有影响,但是并不代表其在心脏发育过程中没有作用.利用DMSO诱导P19CL6细胞分化研究表明:Lrrc10基因在P19CL6细胞分化第3天开始表达,说明Lrrc10基因可能与心肌分化相关.本实验通过制备Lrrc10融合蛋白表达载体,成功免疫新西兰大白兔,获得效价高、特异识别Lrrc10蛋白的多克隆抗体,为深入研究Lrrc10在心肌分化中的功能奠定了基础.
1 材料与方法
1.1 主要试剂
大肠杆菌BL21菌种,pGEX-4T-1菌种以及DH5α菌种为本实验室保种; pMD18-T载体和连接酶购自大连宝生物公司;RNase购自Sangon公司;10×Loading buffer、Taq DNA聚合酶、限制性内切酶EcoRⅠ和SalⅠ购自深圳晶美公司;质粒提取试剂盒(离心柱型)购自OMEGA;UNIQ-10柱式DNA 胶回收纯化试剂盒购自上海生工公司;柱式DNA胶回收试剂盒购自TIANGEN;蛋白胨、甲叉双丙烯酰胺、酵母提取物、IPTG(异丙基-β-D-硫代半乳糖苷)丙烯酰胺、氯化钠、过硫酸铵等购自上海生工公司;Glutathione SepharoseTM 4B购自Amersham Biotech 公司;弗氏完全佐剂、不完全佐剂购自Sigma公司.
1.2 引物设计与合成
根据巢式PCR的原理和Lrrc10基因的序列设计引物.第一对引物:Z-Lrrc10上游引物: 5′GTTGGT GGGCAGGGGCTCGCC 3′Z-Lrrc10下游引物: 5′AGCAATTCAGAGGACCCAT 3′;第二对带有酶切位点的引物:Z-Lrrc10上游引物 :5′GAATTCGAGCTCGGTACCCGGGGATCCTCT 3′EcoRⅠ,Z-Lrrc10 下游引物:5′AGGTCGACACGATTCCGGGAGGACACAGAA 3′SalⅠ由上海生工公司合成.
1.3 基因扩增及克隆
首先以小鼠心脏cDNA文库为模板用第一对引物进行PCR扩增,用第二对引物以第一次PCR产物为模板进行PCR(反应条件为:94 ℃ 变性4 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 2min,30个循环;72 ℃延伸8 min).纯化PCR产物,获得300 bp的目的片段,然后将其连入T载体,转化入DH5α感受态细胞中,酶切检测筛选出阳性单克隆,经测序鉴定后将DNA片段用EcoRⅠ和SalⅠ从pMD18-T-Lrrc10 质粒上切下,连入相同酶切位点线性化的pGEX-4T-1载体,转入DH5α感受态细胞中,经EcoRⅠ和SalⅠ双酶切鉴定后,得到重组表达质粒pGEX-4T-1-Lrrc10.
1.4 Lrrc10融合蛋白的诱导表达
将质粒pGEX-4T-1-Lrrc10转入BL21感受态细胞,挑取单克隆,接种于25 mL含100 mg/L 氨苄青霉素的LB培养基中,37 ℃培养至OD600约为0.6,取1 mL菌液作为空白对照,然后加IPTG诱导,25 ℃继续培养,1、2、3、4、5、6 h各取1 mL菌液,确定最佳诱导时间.
1.5 Lrrc10融合蛋白亲和纯化
离心收集菌液,用PBS重悬菌液后超声裂解,裂解至菌液清亮后离心收集上清.4 ℃条件下加入用PBS活化的谷胱甘肽琼脂糖珠4B,结合后用PBS洗去杂蛋白,加入适当体积的洗脱液混匀,离心收集上清即Lrrc10融合蛋白,保存于-80 ℃.
1.6 Lrrc10多克隆抗体的制备
以新西兰大白兔(约2.0~2.1 kg 雄免)免疫前正常血清为阴性对照(耳缘静脉取血).将纯化后的GST-Lrrc10蛋白与弗氏完全佐剂按体积比1∶1在注射器中推成乳剂,分散10~20个点对同一新西兰大白兔进行背部皮下免疫注射.在第一次注射后第14、21、28天,将GST-Lrrc10蛋白按体积比1∶1与弗氏不完全佐剂在注射器中推成乳剂,进行再次免疫.第35天主动脉取血,静置过夜(4 ℃),3 000 r/min离心处理10 min,取上清分装保存(-80 ℃).
1.7 Lrrc10多克隆抗体的检测
收获免疫兔血清,用小鼠心脏组织蛋白进行Lrrc10抗体的效价测定,设置抗体稀释浓度分别为1∶50和1∶100.根据效价测定后的结果进行抗体特异性检测,提取小鼠多组织蛋白,进行SDS电泳和免疫印迹分析.Lrrc10抗体以1∶100用1×封闭液稀释.
2 结果
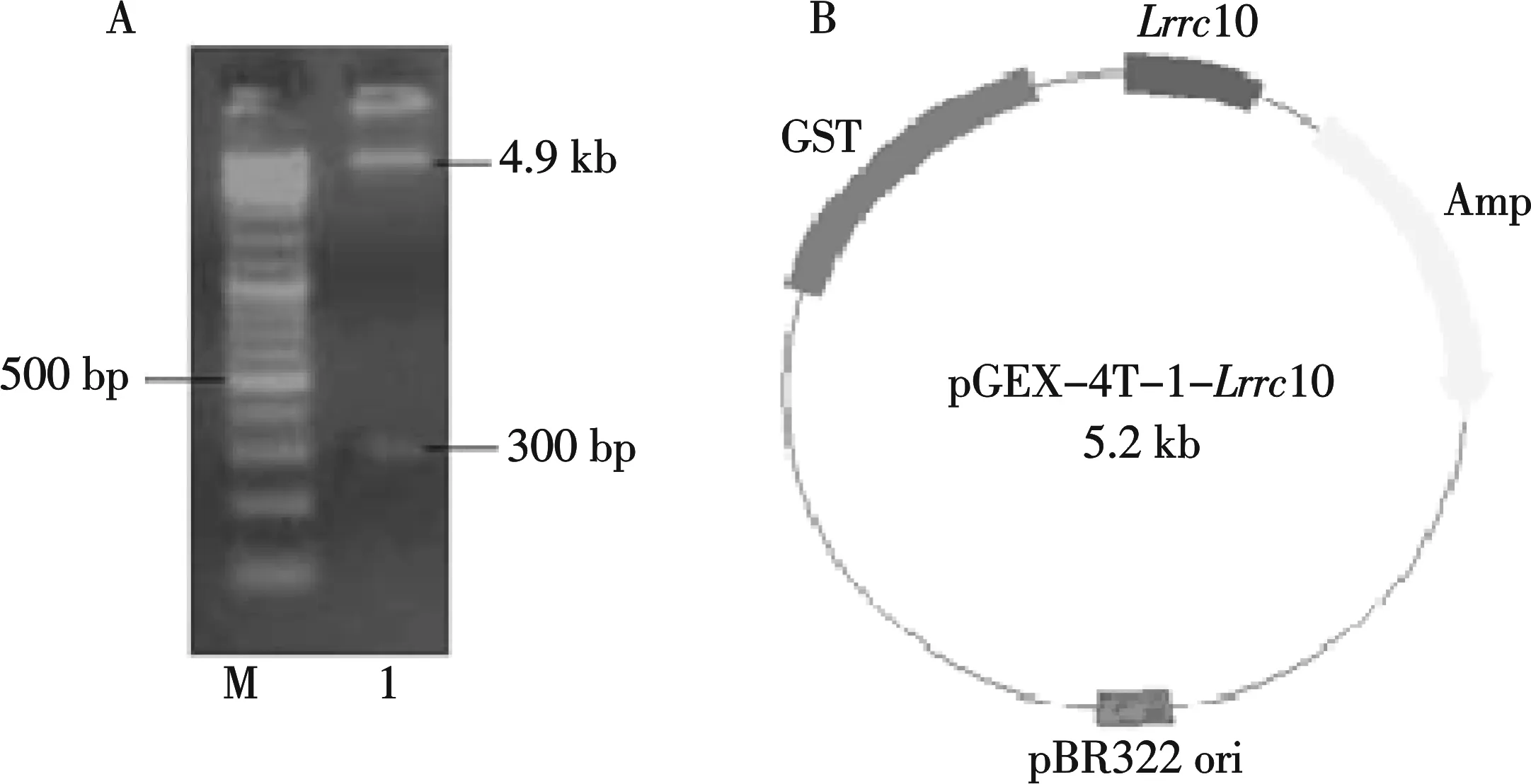
A:EcoRⅠ/SalⅠ双酶切结果;B:pGEX-4T-1-Lrrc10质粒示意图图1 双酶切鉴定及pGEX-4T-1-Lrrc10质粒示意图
2.1 Lrrc10基因表达载体的构建
用第二对引物扩增得到Lrrc10基因部分序列(第628个碱基到927个碱基),将该目的片段克隆到一级载体pMD18-T,通过双酶切质粒pMD18-T-Lrrc10获得目的片段后连入线性化的pGEX-4T-1载体,转入DH5α感受态细胞.双酶切鉴定(如图1A)及测序分析显示已成功构建了质粒pGEX-4T-1-Lrrc10 (图1B).
2.2 Lrrc10融合蛋白的表达及纯化
将重组子转化入BL21感受态细胞,用0.2 mol/L的IPTG在25 ℃条件下进行诱导,1、2、3、4、5、6 h各取1 mL菌液进行检测,可见一条相对分子质量约为37 000大小的特异性条带,与预期的GST-Lrrc10相对分子质量一致(如图2).

1:pGEX-4T-1-Lrrc10 未诱导蛋白表达;2:0.2 mmol/L IPTG 诱导pGEX-4T-1-Lrrc10 蛋白表达1 h;3:0.2 mmol/L IPTG 诱导pGEX-4T-1-Lrrc10 蛋白表达2 h;4:0.2 mmol/L IPTG 诱导pGEX-4T-1-Lrrc10 蛋白表达3 h;5:0.2 mmol/L IPTG 诱导pGEX-4T-1-Lrrc10 蛋白表达4 h;6:0.2 mmol/L IPTG 诱导pGEX-4T-1-Lrrc10 蛋白表达5 h;7:0.2 mmol/L IPTG 诱导pGEX-4T-1-Lrrc10 蛋白表达6 h;M:#0671图2 Lrrc10蛋白的原核表达
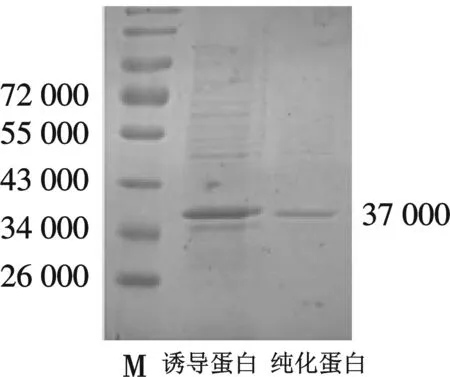
M,#0671;诱导蛋白,0.2 mmol/L IPTG 诱导pGEX-4T-1-lrrc10 5 h时蛋白;纯化蛋白,谷胱甘肽琼脂糖珠亲和纯化后蛋白图3 融合蛋白GST-Lrrc10的纯化图
选定诱导的优化条件为,25 ℃ 下生长至OD600值为0.6~0.8,用0.2 mmol/L 的IPTG 诱导表达5 h时所得到的蛋白质量最多且为可溶蛋白,融合蛋白经谷胱甘肽琼脂糖珠亲和纯化后,通过SDS-PAGE电泳及考马斯亮蓝染色后显示目的条带纯度较高,可进行蛋白免疫(如图3).
2.3 免疫印记鉴定Lrrc10多克隆抗体
用自制的Lrrc10多克隆抗体作为一抗进行Western blot检测,在GST-Lrrc10蛋白所在位置存在特异性条带(如图4),说明此兔抗血清中含有Lrrc10的特异性抗体并且该抗体的特异性和敏感性均达到实验需要.
2.4 Lrrc10在小鼠组织中表达检测
提取小鼠成体心脏、肝脏、大脑、肺、肾、胃以及小肠等组织蛋白,用制备的多克隆抗体检测这些组织中Lrrc10蛋白的表达情况.从Western blot 检测结果发现,Lrrc10在心脏有较强而且特异性的表达,在脑中有微弱表达(如图5).

1:抗原为小鼠心脏蛋白,一抗为免疫前兔血清;2、3:抗原为纯化蛋白,一抗比例分别为1∶50和1∶100;4、5:抗原为小鼠心脏蛋白,一抗比例分别为1∶50和1∶100图4 Lrrc10 多克隆抗体Western-blotting鉴定

图5 Lrrc10 在成年小鼠各个组织表达检测
3 讨论
作为LRR家族一员的Lrrc10蛋白含有4个LRR 保守结构域,LRR 结构域在蛋白质相互作用中起重要作用.众多研究表明含有此结构域的蛋白质可参与多种生物过程,如信号转导、细胞粘性、转录活性的调控、DNA 修复、激素受体作用以及免疫反应等[4-7].LRR 家族的蛋白质还有更多功能等待研究.
在制备此抗体过程中,作者运用的是pGEX-4T-1载体[8-10].运用pGEX表达载体时,存在一个难点,即必须保证其目的基因在上清中表达,此时产物(谷胱甘肽巯基转移酶和目的基因的融合蛋白)才可用Glutathione SepharoseTM 4B珠子进行纯化.为消除这一问题,可改用pET-28a表达载体.pET-28a载体与其他表达载体不同之处在于其C,N两端均含编码Histag标签的蛋白序列,如一端有移码突变,能保证目的蛋白仍带有Histag标签蛋白,并且不论目的蛋白在上清或沉淀表达,都可用Ni-IDA凝胶柱亲和纯化获得有活性的目的蛋白.
本实验中,作者通过构建原核表达载体pGEX-4T-1-Lrrc10获得GST-Lrrc10蛋白.最终免疫新西兰大白兔获得了Lrrc10抗体.通过免疫印迹等方法证明制备的Lrrc10多克隆抗体能特异结合生物体内表达的Lrrc10蛋白. 因此,它为将来运用染色质免疫沉淀、免疫共沉淀、免疫组化等手段深入研究Lrrc10基因的功能奠定了基础.
参考文献:
[1] KIM K H, KIM T G, MICALES B K,etal. Dynamic expression patterns of leucine-rich repeat containing protein 10 in the heart[J]. Dev Dyn, 2007, 236:2225-2234.
[2] KIM K H, ANTKIEWICZ D S, YAN L,etal.Lrrc10 is required for early heart development and function in zebrafish[J]. Dev Biol, 2007, 308:494-506.
[3] NIKOLAY L M, EKATERINA M, VALERIYA A,etal. Serdin1/Lrrc10 is dispensable for mouse development[J]. Genesis, 2008, 46:441-446.
[4] KOBE B, DEISENHOFER J. The leucine-rich repeat: a versatile binding motif[J]. Trends Biochem Sci, 1994, 19:415-421.
[5] KOBE B, DEISENHO F. A structural basis of the interactions between leucine-rich repeats and protein ligands[J]. Nature, 1995, 374, 183-185.
[6] KIM K H, KIM T G, MICALES B K,etal. Dynamic expression patterns of leucine-rich repeat containing protein 10 in the heart[J].Dev Dyn, 2007, 236(8):2225-2234.
[7] MANUYLOV N L, MANUYLOVA E, AVDOSHINA V,etal. Serdin1/Lrrc10 is dispensable for mouse development[J].Genesis, 2008, 46(9):441-446.
[8] YUAN C, REULAND J,LEE L,etal. Optimized expression and refolding of human keratoep ithelin in BL21 (DE3) [J]. Protein Expr Purif, 2004, 35: 39245.
[9] 满 贤,吴秀山,李永青,等.斑马鱼Lefty1特异性多克隆抗体的制备[J].激光生物学报, 2010,19(5):685-689.
[10] 杨建华,杨 青,吴秀山,等.斑马鱼HAS2基因的克隆、抗体制备及分析[J].湖南师范大学自然科学学报, 2010,33(3):73-77.
