鲤鱼脑垂体和HCG诱导雌性河鳗性腺成熟过程中钙磷变化的初步研究
2011-11-24高晓阳刘利平蒋天宝陈文银吴嘉敏
高晓阳,刘利平,蒋天宝,陈文银,吴嘉敏
(上海海洋大学省部共建水产种质资源发掘与利用教育部重点实验室,中国 上海 201306)
河鳗学名为日本鳗鲡,是一种经济价值很高的生殖洄游性鱼类,素有“水中人参”之称.仔鳗在淡水中生长发育3~5年后,在秋冬季成群地游向大海开始生殖洄游.河鳗进入海水后,性腺逐渐发育成熟,在海洋中产卵.在生殖洄游整个过程中,河鳗不摄食[1-2],其物质和能量来源主要由身体的储存供给[3].20世纪80年代以来,世界养鳗业迅速发展,尤其是在我国,河鳗已成为水产养殖中产业化程度最高的品种之一.然而,由于养殖所需的苗种完全依靠天然捕捞,掠夺式的捕捞方式致使鳗苗资源逐年下降.河鳗苗种短缺限制了鳗鲡养殖业的进一步发展,开展河鳗人工繁殖技术研究势在必行.国内一般通过注射外源激素如脑垂体和HCG等促使河鳗亲鱼性腺发育成熟、产卵,但亲鱼的产卵率和卵子受精率都很低.卵子发育需动用身体储存的营养物质而关于成熟过程中生化指标的变化少见报道.本文模拟自然条件实验过程中不投喂饵料,从注射鲤鱼脑垂体和HCG(人绒毛膜促性腺激素)的雌性河鳗钙、磷指标的变化入手,探讨其转移转化规律,为河鳗亲鱼强化培育和人工繁殖的突破提供基础性参考资料.
1 材料与方法
1.1 实验材料
实验用63尾亲鱼均购自上海市惠南镇天英河水产经营部池塘养殖鳗鲡,选择体质健壮,无病害的鳗鲡为实验用鱼.雌鳗体重为845~1 020 g.所有亲鱼运回实验室的养殖室海水玻璃循环系统中进行养殖.经15 d逐步适应海水后,随机分4组养殖于盐度为28的海水中,试验期间水温为16~25 ℃.
1.2 实验设计
本实验共分4组.第1组恒量注射脑垂体和HCG;第2组梯度注射脑垂体和HCG(脑垂体和HCG均溶解在7 g/L生理盐水中),第1组和第2组最后注射激素剂量相同;第3组注射等量的7 g/L生理盐水;第4组不做任何处理只养殖在海水循环系统中.每周注射1次,注射方式为背部肌肉注射,注射剂量如下表所示.

表1 实验分组和激素注射方法
1.3 样品采集及分析
每两周采一次样品,每组3尾鱼,边注射边取样.在注射第1针分组前先随意挑选3尾雌性亲鱼,用MS-222完全麻醉鱼体,解剖鱼体计算性腺成熟系数(GSI)和肝体系数(HSI); 采集性腺、肝脏、肌肉、骨骼,存放于-20 ℃冰箱,测定前把样品放入冷冻干燥机完全干燥样品,测定干燥样品钙、磷含量,测定方法参考林鼎等[4]方法进行测定;用5 mL一次性无菌注射器动脉采血,取完血后,将血液注入肝素钠抗凝血的玻璃采血管中4 ℃冰箱放置2~4 h,待血液凝固析出血清后,将血样4 ℃下4 000 r/min离心15 min,取血清用于血液钙、磷等成分分析.用全自动血液生化分析仪(迈瑞BS-200)分析血清中钙、磷含量.
1.4 数据处理
实验结果采用spss(Version 11.5)统计软件进行处理分析,利用单因素方差分析(Oneway ANOVA)来检验各实验组生化指标间的显著性,用Duncan’s进行多重比较检验.
2 结果与分析
2.1 注射脑垂体和HCG对性腺成熟系数的影响
经过70 d的发育过程,恒量组和梯度组雌性河鳗的性腺成熟系数达到(25.2±4.35)%和(24.8±4.72)%,而对照组和空白组仅为(2.42±0.18)%和(1.93±0.13)%,对照组性腺成熟系数增幅比空白组稍大,但是没有明显的差异(P﹥0.05);空白组性腺有一定程度的发育,但是不明显(图1).
2.2 注射脑垂体和HCG对组织中钙含量变化的影响
通过10次注射脑垂体和HCG,恒量组和梯度组的雌鱼骨骼中钙的含量明显下降.注射激素前骨骼钙干质量分数为(1.017 7±0.049 4)%,而恒量组和梯度组在第70 d骨骼钙质量分数达到(0.746 3±0.090 4)%和(0.747 7±0.116 6)%,与对照组和空白组有显著性差异(P﹤0.05)(图2).
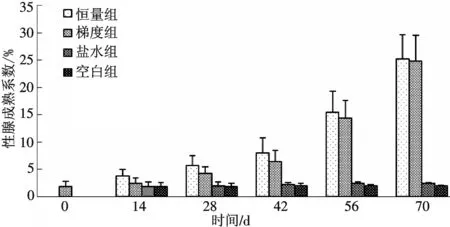
图1 注射脑垂体和HCG对雌性河鳗GSI的影响
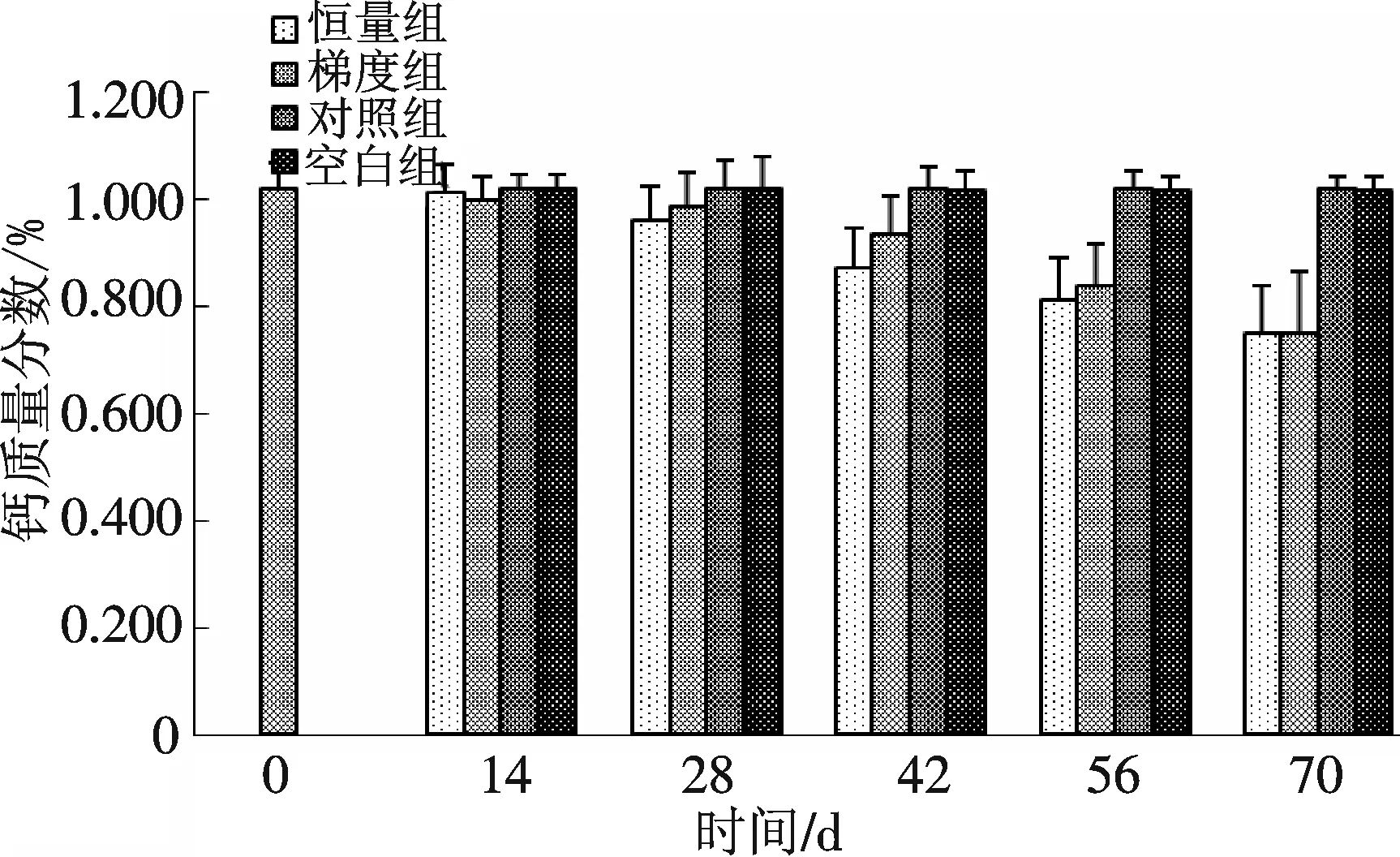
图2 注射脑垂体和HCG对雌性河鳗骨骼钙含量的影响
血清中钙含量表现出一定的规律性变化,首先恒量组和梯度组血清中钙含量迅速下降,在第14 d达到最小值,分别是(0.55±0.17)mmol/L和(0.534±0.11)mmol/L;然后开始上升,到性腺发育到第ⅴ期,其含量达到了最大值,分别达到(1.193±0.2)mmol/L和(1.187±0.22)mmol/L;对照组和空白组表现为不同程度的下降(图3).
恒量组和梯度组雌鱼的性腺中钙的含量明显增加,注射激素前雌鱼性腺钙的干质量分数为(7.3±2.92)%,而在第70 d达到了(51.4±17)%和(49.6±20.3)%.对照组和空白组与注射前没有明显差异 (图4);处理组肝脏中钙的质量分数明显上升,第70 d分别达到(35.2±5.41)%和(34.9±6.8)%;而空白组和对照组和注射前没有明显差别(图5).肌肉中钙含量基本无变化.
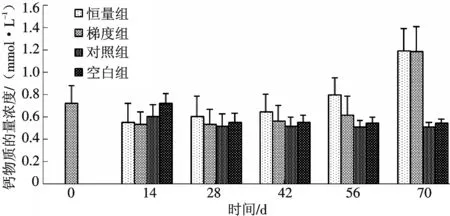
图3 注射脑垂体和HCG对雌性河鳗血清中钙含量的影响
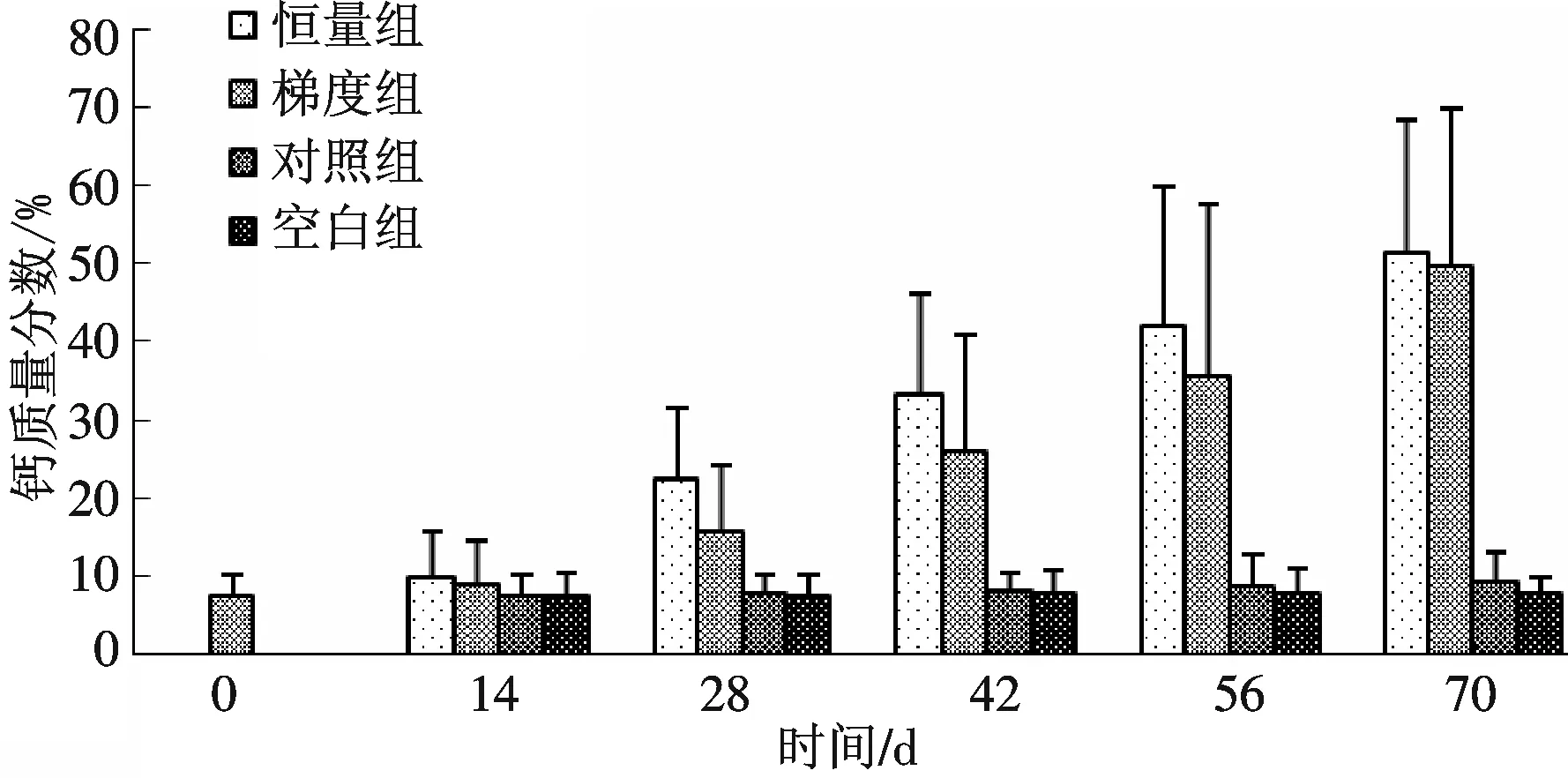
图4 注射脑垂体和HCG对雌性河鳗性腺钙含量的影响
2.3 注射脑垂体和HCG对组织中磷含量的影响
通过10次注射脑垂体和HCG后,恒量组和梯度组骨骼中的磷质量分数在第70 d分别显著下降到(0.97±0.4)×10-5和(0.99±0.47)×10-5,而对照组和空白组含量变化不明显(P﹥0.05)(图6);血清中磷含量也表现为一定规律的变化,首先实验组磷含量迅速下降,到28 d达到最小值,分别是(1.494±0.85)mmol/L和(1.168±0.73)mmol/L,然后开始上升,到70 d的时候达到(2.196±0.91)mmol/L和(2.188±1.02)mmol/L;而对照组血清中磷下降明显,空白组变化不明显(图7).注射激素的两组雌鱼中性腺的磷质量分数明显增加,到第70 d时,处理组分别达到(0.213 3±0.073 3)%和(0.212 2±0.083 7)%,而对照组和空白组变化不显著(图8);而肝脏和肌肉中磷质量分数为(0.21~0.25)×10-5,在整个实验过程中4个组之间无显著性差异(P>0.05).
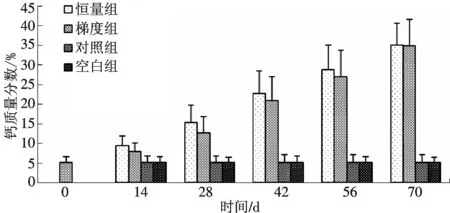
图5 注射脑垂体和HCG对雌性河鳗肝脏钙含量的影响
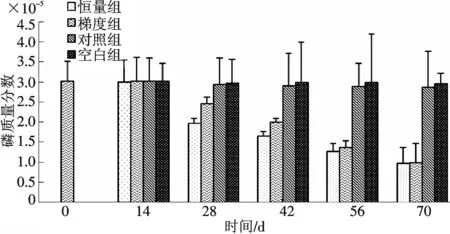
图6 注射脑垂体和HCG对骨骼中磷含量的影响
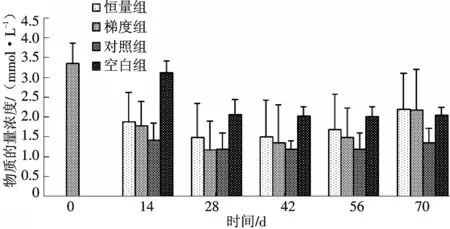
图7 注射脑垂体和HCG对血清中磷含量的影响

图8 注射脑垂体和HCG对性腺中磷含量的影响
3 讨论
雌鱼在卵巢发育过程中,肝脏在17β-E2诱导下合成和释放雌性特有的卵黄蛋白原.这些卵黄蛋白原经过血液运输,在促性腺激素作用下进入发育的卵母细胞在卵母细胞内积累,形成卵黄颗粒,从而促使卵母细胞逐渐成熟,GSI逐渐增加[5].卵黄蛋白原是雌鱼特有的蛋白质,是一种钙结合脂磷蛋白.DOROSHOV等发现高首鲟在性腺发育过程中卵黄蛋白原的发生过程伴随着Ca2+和P浓度的变化[6];LINARES-CASENAVE等也发现了高首鲟在性腺发育过程中Ca2+和卵黄蛋白原的线性关系[7];李朝军等对大阪鲫的研究表明Ca2+能够促进卵母细胞的发育和蛋白的吸收[8],可见钙在鱼类卵细胞发育过程中起到了相当重要的作用;在本实验中HIS也显著升高,说明肝脏中卵黄蛋白原的合成和释放增加,以及卵巢中卵黄积累的增加.
有意思的是,本实验中,河鳗性腺发育过程中,肝脏和卵巢中钙含量逐渐升高,这些钙和磷到底是来源在哪?由于整个实验过程中雌鳗没有进食任何食物,因此除可能通过鳃从海水中摄取外,体内各器官之间可能有钙磷发生转移,以满足卵巢发育.在注射脑垂体和HCG后骨骼中的钙含量降低,而性腺和肝脏中钙含量增加,表明脑垂体和HCG诱导雌性河鳗动员了骨骼中的钙转移到性腺和肝脏中,参与了性腺的发育. 17β-E2可以促使钙从骨骼中调动出来[9],从有些鱼类中发现骨骼中存在17β-E2受体,17β-E2可能通过影响其受体来影响钙和矿物质的含量[10].
钙参与鱼类多种生理活动,如参与肌肉收缩、血液凝固、神经传递、渗透压调节和多种酶反应等过程,也与保持生物膜的完整性有关.鱼体缺钙时生长缓慢,食物转换率低,死亡率高. 鱼体的钙99%以上存在于骨骼内,血钙全部存在于血清中,细胞中只有极微量的钙质[11].鱼类血液生化指标虽然受诸多因素的影响,但仍然能够反应该鱼类健康状况和生理状况[12],性别和性成熟是影响鱼类血液生化指标的重要因素[13].叶勤等已经证实血清游离Ca2+在鱼类生殖期生理活动中起重要作用[14].因此测定血清和组织中钙的含量有助于了解钙与雌鳗性腺发育的相互关系,为河鳗的人工繁殖积累基本的理论依据.本实验测得雌鱼性腺发育到第Ⅱ期后,钙含量出现波动下降,从第Ⅲ期、第Ⅳ和第Ⅴ期钙含量明显上升;这与叶勤等测定嘉陵江瓦氏黄颡鱼雌鱼血清钙含量随卵巢发育逐渐上升[14]这一结果比较相似.叶勤等[14]和张涛等[15]还发现,卵巢发育后期血清中钙含量逐渐下降,这些结果与作者得到的结论有不同之处,有待进一步研究.SUBHEDAR等认为在诱导性成熟过程中,斯氏小囊的活动对于从血库中调动钙的储存并输送到正在发育成熟的性腺中可能起重要作用[16],这与作者研究性腺发育整个过程调动血清中钙类似,本实验证实脑垂体和HCG诱导雌性河鳗发育初期血清中钙含量也有迅速下降的趋势,有可能就是斯氏小囊调动了血库中的钙,再次证明钙在鱼类生殖生理活动中起着重要作用.
磷在糖和脂肪的代谢中起重要作用,还参与能量转化,维持细胞的通透性,遗传密码和生殖活动的调控.鱼体缺磷则使骨骼发育不正常,特别是头部畸形,血细胞含量减少,生长缓慢以及食物转换率低.在鲤鱼中曾经发现,生长率与食物中磷的含量呈正相关关系.因为磷在水中含量很少,食物是鱼类磷的主要来源,而本实验整个过程中河鳗不进食任何食物,但是随着性腺的发育性腺中磷含量逐渐增加,血液中磷含量经历短暂的下降后也逐渐上升,骨骼中磷含量显著减少.说明整个过程调动了骨骼中的磷通过血液转移到了性腺供性腺的发育.鱼类血液生化指标能反应鱼类的物种特征及其生理状态,还能为繁殖等提供重要参考依据[17].张涛等也证实了雌性鲟鱼血浆中无机磷含量随着性腺发育显著升高[15],李云等[18]和王友惠等[19]在对瓦氏黄颡鱼(Pelteobagrusvachelli)的研究中发现,随着雌鱼性腺的发育,血清中磷浓度逐渐升高,到Ⅳ期末达到最大值;这和本实验结果类似.本实验注射激素前期血清中磷含量经历了短暂的下降,原因可能是鱼不同,其变化规律稍有不同.据相关文献报道除了钙、磷以外还有其他生化指标也有一定的变化如蛋白、脂肪、灰分等.肖亚梅等[20]发现黄鳝不同时期性腺发育蛋白差异和张利红等[4]发现鳗鲡不同发育时期脂肪差异.变化机理有待进一步研究.
参考文献:
[1] PALSTRAA, CURIEL D, FEKKESM,etal. Swimming stimulates oocyte development in European eel [J].Aquaculture,2007,270(1-4): 321-332.
[2] LIU L, ZHANG J M, GUO F,etal. Effects of renewal cultivation and renewal reproduction after spawning in Japanese eel Anguilla japonica [J].JFSC,2004,11(1):54-58.
[3] 黄大明,陈世群.鳗鲡的生活史和人工育苗技术探讨[J].动物学杂志,1997,32(3):39-48.
[4] 林 鼎,毛永庆.鱼类营养与配合饲料[M].广州:中山大学出版社,1987:152-161.
[5] 张利红,张为民,林浩然,等.性类固醇激素诱导雌性日本鳗鲡性腺发育过程中钙和脂肪的动员[J].中山大学学报:自然科学版,2001,40(2):86-88.
[6] DOROSHOV S I, MOBERG G P, VAN EENENNAAM J P. Observations on the reproductive cycle of cultured white sturgeon (Acipensertransmontanus) [J]. Environ Biol Fishes,2006,17(2):265-278.
[7] LINARES-CASENAVE J, KROLL K J, VAN EENENNAAM J P,etal. Effect of ovarian stage on plasma vitellogenin and calcium in cultured white sturgeon [J]. Aquaculture, 2003,221(1-4):645-656.
[8] 李朝军,刘荣臻,王 浩,等.大阪鲫卵黄蛋白原和钙离子关系的初步研究[J].水产学报,1993,17(4):297-303.
[9] 林浩然,张梅丽,张素敏,等.鳗鲡繁殖生物学研究Ⅴ:性类固醇激素诱导雌鳗促性腺激素(GtH)分泌和卵巢发育的作用[J].水生生物学报,1994,18(3):272-279.
[10] ARMOUR K J, LEHANE D B, PAKDEL F,etal. Estrogen receptor mRNA in mineralized tissuesof rainbow trout: calcium mobilization by estrogen [J].FEBS Lett,1997,411(1):145-148.
[11] 尾崎九雄.鱼类血液与循环生理[M].上海:科学技术出版社,1982:16-40.
[12] 黄二春,魏于生,万松良,等.淡水鲳六项血液指标的测定及血细胞结构的显微观察[J]. 淡水渔业,1992(3):20-23.
[13] 周 玉,郭文场,杨振国,等.鱼类血液学指标研究的进展[J].上海水产大学学报,2001,10(2):163-165.
[14] 叶 勤,李 云,谢 鸣,等.鱼类血清钙的测定及含量变动研究[J].西南民族学院学报:自然科学版,2001,27(4):454-456.
[15] 张 涛,章龙珍,赵 峰,等.基于血液生化指标判别分析西伯利亚鲟性别及卵巢发育时期[J].中国水产科学,2007,14(2):236-243.
[16] SUBHEDAR N, RAMA KRISHNA N S, DESHMUKH M K. The response of nucleus preopticus neurosecretory cells to ovarian pressure in the teleost, Clarias batrachus (Linn.)[J].Gen Comp Endocrinol,1987,68(3):357-368.
[17] DANILO W F, GUNTHER J E, GILSONK. Comparative hematology in marine fish [J].Physiology,1992,102A(2):311-321.
[18] 李 云,李英文,王友慧,等.瓦氏黄颡鱼血清卵黄蛋白原和钙离子以及肝脏RNA的变化与性腺发育的关系[J].重庆水产,1999(2):17-20.
[19] 王友慧,李 云.瓦氏黄颡鱼血清蛋白磷与性腺发育关系的研究[J]. 水产科学,2004,23(10):5-8.
[20] 肖亚梅,刘 姣,陈丽莉,等.黄鳝生殖发育不同时期性腺差异蛋白的初步研究[J].湖南师范大学自然科学学报,2009,32(1):97-99.
