胰腺干细胞诱导分化后同种移植治疗糖尿病的实验研究
2011-11-22史光军张磊许评栾绍海于江陈昊强
史光军 张磊 许评 栾绍海 于江 陈昊强
·论著·
胰腺干细胞诱导分化后同种移植治疗糖尿病的实验研究
史光军 张磊 许评 栾绍海 于江 陈昊强
目的探讨胰腺干细胞体外定向分化潜能,评价诱导分化后细胞同种移植对糖尿病的治疗效果。方法体外分离、纯化成体Wistar大鼠胰腺干细胞,运用荧光免疫染色法对胰腺干细胞表面进行鉴定,然后在肝细胞生长因子、尼克酰胺等共刺激下诱导细胞定向分化。双硫腙(DTZ)染色对诱导后细胞进行胰岛细胞鉴定,ELISA染色光电酶标记法检测其胰岛素分泌功能。采用链脲佐菌素(STZ)腹腔注射建立Wistar大鼠糖尿病模型,将40只造模成功的大鼠随机分为胰岛细胞移植组(移植组)和安慰剂注射组(对照组),分别于移植前1 d及移植后1、2、3、4周经尾静脉采血检测血清胰岛素和血糖水平。结果本实验成功获取成体大鼠胰腺干细胞,细胞表面CK19、 Pdx-1和Nestin表达均为阳性。诱导分化后的细胞DTZ染色呈棕红色,在高糖刺激下表达、分泌胰岛素。移植后4周内移植组血清胰岛素水平平均为(11.41±1.52)mU/L,血糖水平平均为(8.22±2.7)mmol/L,对照组分别为(9.30±1.56)mU/L和(12.23±3.8) mmol/L,两组相差显著(P<0.05)。结论体外分离成体胰腺干细胞可被定向诱导分化为具有胰岛素分泌功能的胰岛样细胞,同种移植后对糖尿病具有治疗作用。
胰腺; 干细胞; 细胞分化; 同种移植; 糖尿病
糖尿病是危害人类健康的疾病之一,发病率逐年上升。临床以糖、脂代谢异常,内分泌功能紊乱为主要特点。长期的高血糖刺激可导致多种严重并发症的出现,危及生命。目前对1型糖尿病主要采用胰岛素替代治疗,花费昂贵,患者痛苦。胰岛移植为糖尿病患者摆脱外源胰岛素依赖带来了一线曙光,但临床胰岛细胞来源的匮乏限制了其临床应用。干细胞具有自我更新和不断增殖的能力,且具有多向分化潜能[1],并已有将胰腺干细胞诱导为胰岛细胞治疗糖尿病的报道。本文应用胰腺干细胞定向诱导的胰岛细胞治疗糖尿病大鼠,为临床应用奠定基础。
材料和方法
一、胰腺干细胞的分离、扩增及鉴定
Wistar大鼠,4~6周龄,体重160~230 g,雌性,购于山东鲁抗医药动物饲养中心。适应性喂养1周以上。麻醉后无菌进腹,暴露胆总管,钳夹胆总管两端,用10号套管针行胆胰管穿刺,注入1 mg/ml的Ⅴ型胶原酶5 ml后完整切除胰腺,置于4℃ Hank′s液。移入超净工作台,弃Hank′s液,加入约为胰腺组织体积3倍的Ⅴ型胶原酶,38℃水浴消化10 min,每3 min震荡1次,至胰腺组织消化成细沙粒状时加入含10% FCS的冷Hank′s液,过滤网,离心弃上清,Hank′s液洗涤2遍后制成细胞悬液,应用Ficoll 400浓度梯度(23%、17%、11%)2000 r/min离心10 min,吸出干细胞层,常规培养[2]。7 d后改用含10% FCS、100 U/ml青霉素-链霉素、20 ng/ml EGF、bFGF、10 mmol/L HEPES,1.0 mmol/L丙酮酸钠、71.5 μmol/L β-巯基乙醇的RPMI1640培养液继续培养,3 d换液1次。贴壁干细胞用0.25%胰酶、EDTA消化,按1∶2传代,以后按1∶3~1∶4传代培养[3]。取传代细胞行爬片培养,按文献[4]的方法,应用SABC-FITC免疫荧光染色检测细胞角蛋白(CK19)、胰十二指肠同源框因子-1(Pdx-1)、神经巢蛋白(Nestin)、胰岛素及胰高糖素的表达,以PBS替代一抗作为对照,通过荧光显微镜观察并摄片。
二、胰腺干细胞的诱导分化及胰岛素释放测定
取传代细胞在含有2 g/L牛血清白蛋白(BSA)、10 mmol/L尼克酰胺、10 μg/L肝细胞生长因子(HGF)、71.5 ng/ml胰岛素-转铁蛋白-硒(ITS)和100 U/L青霉素-链霉素的无血清DMEM/F12培养基中进行诱导分化,每2~3 d换液一次。培养1周后行双硫腙(DTZ)染色鉴定[5]。将诱导分化后的细胞更换为高糖(10 mmol/L)培养基培养2 h,每隔30 min吸取培养液1次,共8次。应用ELISA染色光电酶标记法测定培养液的胰岛素含量,制作胰岛素释放曲线图。
三、大鼠糖尿病模型的制作及分组
Wistar大鼠造模前禁食6 h。应用枸橼酸缓冲液(pH 4.0~4.5)将链脲佐菌素(STZ)配制成5 mg/ml溶液[6],10 min内按65 mg/kg体重的标准向大鼠的腹腔内一次性注射,注射后72 h内补充葡萄糖。注射STZ 48 h后尾静脉采血2次,测血糖>16.7 mmol/L,即为造模成功,成模率达93%。
按数字表法将40只成模的糖尿病大鼠随机分为胰岛样细胞移植组(移植组)和对照组,各20只。移植组经尾静脉注入500目胰岛样细胞当量(约2600个)[7]。对照组注入等容积生理盐水。移植前1 d及移植后1、2、3、4周检测血清胰岛素和血糖值。
四、统计分析

结 果
一、胰腺干细胞的形态变化及鉴定
吸出的干细胞层培养2 d后细胞增多,添加细胞因子后生长加速,细胞成梭形(图1),7 d后细胞融合80%以上,可稳定传至8代。传代细胞表面CK19、 Pdx-1和Nestin表达均为阳性(图2),而胰岛素及胰高糖素表达均为阴性。
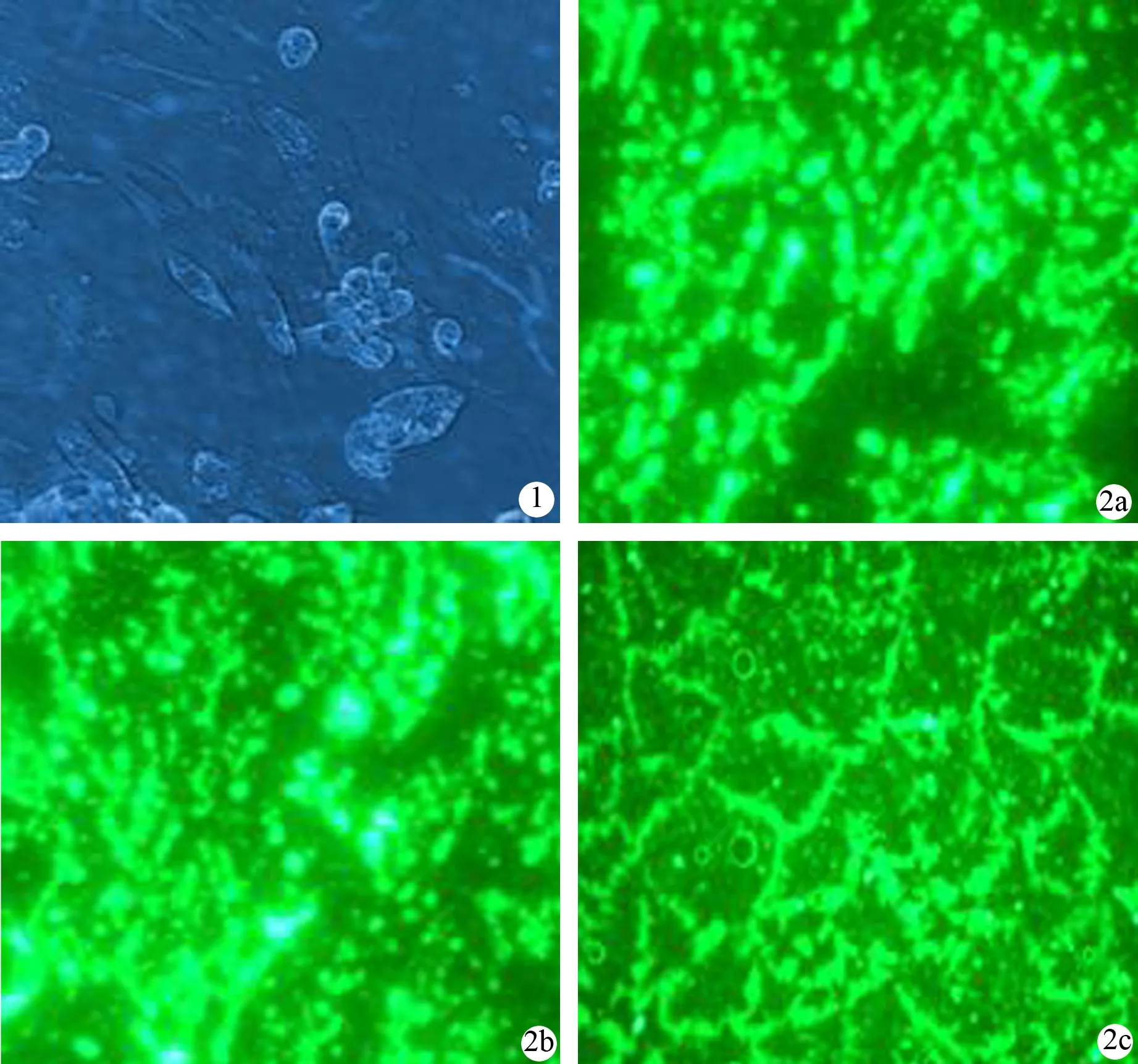
图1早期贴壁的胰腺导管干细胞(×200)图2细胞表面CK19(a)、Pdx-1(b)和Nestin(c)阳性表达(免疫荧光 ×200)
二、胰腺干细胞的分化及胰岛素分泌量
胰腺干细胞经尼克酰胺和HGF诱导后分化为胰岛样细胞团,用DTZ染成棕红色(图3)。在高糖刺激下,培养液中胰岛素含量随着时间的延长而不断增高(图4)。

图3 诱导分化后的细胞(DTZ染色 ×400)
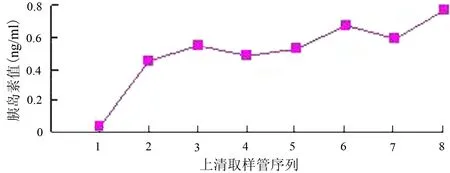
图4 胰岛素释放曲线
三、胰岛样细胞移植对糖尿病大鼠血清胰岛素和血糖的影响
移植组大鼠胰岛素分泌量较移植前明显增加,以移植后第1、2、3周增加最多,血糖相应明显下降(表1)。
讨 论
糖尿病(diabetes mellitus,DM)患者主要采用
胰岛素替代治疗,但不能阻止糖尿病肾病、视网膜病变等并发症发生,且需终生治疗。胰岛移植是治疗糖尿病的一种有效手段,但由于胰岛细胞供体来源不足,限制了胰岛移植的临床应用。胰腺干细胞体外分离培养、诱导分化的成功为临床开展胰岛移植提供新的思路。
胰腺干细胞的鉴定主要依据细胞表面的标志物。常用于鉴定的表面标志物有CK19[8]、Nestin[9]、Pdx-1[10]、胰岛素增强子1等。此外还有学者应用Notch信号、kit基因、端粒酶活性等鉴定胰腺干细胞,但尚无定论。
尼克酰胺(Nicotinamide)是一种核酶多聚合成酶抑制剂,因其能诱导人类胚胎胰岛内分泌细胞的分化和成熟,增加胰岛素和C肽的表达而广泛用于干细胞向胰岛内分泌细胞分化的研究中。本实验采用尼克酰胺和含ITS的培养基对其进行诱导分化,结果显示诱导后干细胞的胰岛素含量明显升高,表明胰腺干细胞诱导后向胰岛样细胞分化。
根据正常胰岛细胞可被DTZ特异性染成棕红色这一特性可鉴定诱导后的胰岛样细胞。本实验诱导后的细胞被染成棕红色证实为胰岛样细胞。
对STZ诱导的糖尿病大鼠模型进行胰岛细胞移植的途径有腹腔注射、门脉血管、肾被膜下、穴位注射等[11]。移植部位选择的关键是要使移植入体内的胰岛细胞有更好的营养供应,利于成活,保持更长的胰岛素分泌功能,并尽可能地避免免疫排斥的影响。我们选择腹腔注射法,其优点为:(1)操作简便,选择大鼠左下腹一次性注射,效率高;(2)对组织的损失小,不易损伤内脏器官,降低感染风险,降低死亡率;(3)可在腹腔内完成种植,获得腹腔内液体的营养,延长功能持续时间。
目前通过不断改进诱导培养条件使分化细胞功能更趋于完善,胰岛素分泌量不断提高,甚至于接近正常原生细胞的分泌量,在STZ诱导的糖尿病动物模型中可以逆转其高血糖[12],达到免于胰岛素治疗的目的。但同样存在许多问题:(1)STZ诱导的糖尿病只是选择性破坏了胰腺β细胞,并不能完全模拟1型糖尿病的病理过程;(2)主要针对自身胰腺β细胞的免疫识别是否会同样攻击即便是同种基因分化而来的胰岛细胞,是否还需要使用免疫抑制剂治疗;(3)干细胞具有无限的分化潜能,同时也保留了肿瘤细胞的特性,是否有潜在的形成肿瘤的危险;(4)胰腺干细胞诱导分化后的体内移植实验尚缺乏长期的疗效评估。这些都是我们今后应该努力研究的方向。

表1 胰岛样细胞移植前后血清胰岛素及血糖的变化
注:与对照组比较,aP<0.05;bP<0.01
[1] Bonner-Weir S.Stem cells diabetes:What has been achieved.Horm Res,2003,60:10-12.
[2] 陈海燕,张强,吴英,等.成年大鼠胰腺导管干细胞的体外分离、培养及鉴定.南京医科大学学报(自然科学版),2008,17:273-277.
[3] Morini S,Braun M,Onori P,et al.Morphological changes of isolated rat pancreatic islets: a structural, ultrastructural and morphometric study.J Anat, 2006, 209:381-392.
[4] Bouwens L.Islet morphogenesis and stem cell markers.Cell Biochem Biophys,2004,40:81-88.
[5] Rovira M,Scott SG,Liss AS,et al.Isolation and characterization of centroacinar/terminal ductal progenitor cells in adult mouse pancreas.Proc Natl Acad Sci USA,2010,107:75-80.
[6] de la Garza-Rodea AS,Knaän-Shanzer S,den Hartigh JD,et al.Anomer-equilibrated streptozotocin solution for the induction of experimental diabetes in mice (Mus musculus).J Am Assoc Lab Anim Sci,2010,49:40-44.
[7] Hori Y.Insulin-producing cells derived from stem/progenitor cells: therapeutic implications for diabetes mellitus.Hori Y.Med Mol Morphol,2009,42:195-200.
[8] Boaan-Sobkowska J,Zabel M,Wozniak W,et al.Polyhormonal aspect of the endocrine cells of the human fetal pancreas.Histochem Cell Biol,1999,112:147-153.
[9] Hunziker E,Stein M.Nestin-expressing cells in the pancreatic istets of Langerhans.Biochem Biophys Res Conmun,2000,271:116-119.
[10] Gaghardino JJ,Del Zotto H,Massay L,et al.Pancreatic duodenal homebox-1 and islet neogenseis-associated protein:possible combined marker of activa-teable perxreatic cell precursors.J Endocrinol,2003,177:249-259.
[11] 刘克昌,魏立华,曹宗献,等.间断小量多次微囊化胰腺腹腔移植的实验研究.世界华人消化杂志,2000,8:228-230.
[12] Huang Y,Kucia M,Hussain LR,et,al.Bone marrow transplantation temporarily improves pancreatic function in streptozotocin-induced diabetes: potential involvement of very small embryonic-like cells.Transplantation,2010,89:677-685.
2010-11-19)
(本文编辑:屠振兴)
Pancreaticstemcellsdifferentiationandallograftforthetreatmentofdiabetes
SHIGuang-jun,ZHANGLei,XUPing,LUANShao-Hai,YUJiang,CHENHao-qiang.
DepartmentofPancreatic-BiliarySurgery,QingdaoMunicipalHospital,Qingdao266071,China
XUPing,Email:xu.ping@263.net
ObjectiveTo investigate the potential of pancreatic stem cells (PSCs) directed differentiation in vitro, and to evaluate the effects of differentiated PSCs allograft on the treatment of diabetes.MethodsThe PSCs of adult Wistar rats were separated and purified in vitro. The surface of PSCs was determined by immunofluorescence staining, and then it was stimulated by hepatocyte growth factor (HGF) and nicotinamide to induce directed differentiation. Dithizone dyeing was used to determine the islet-like cells after induction, and ELISA staining method was used to detect the insulin levels. Streptozotocin peritoneal injection was used to induce the diabetic rat mode. 40 rats were randomly allocated into pancreatic islet cells allograft group (experiment group) and placebo group.The serum insulin and glucose levels 1 d before transplantation and 1, 2, 3, 4 week after transplantation were measured.ResultsPSCs of adult Wistar rats were successfully obtained, and the expression of CK19, Pdx-1 and Nestin on cell surface was positive. Dithizone dyeing for directed differentiation cells showed brownish red color. The cells could express and secrete insulin after hyperglycaemia stimulation. The serum insulin and glucose levels 4 week after transplantation were(11.41±1.52)mU/L and(8.22±2.7)mmol/L, which were (9.30±1.56)mU/L and(12.23±3.8)mmol/L in the placebo group, and difference was statistically significant (P<0.05).ConclusionsPSCs can be induced and directed differentiated in vitro into islet-like clusters with insulin secretion function. And its allograft has the potential for the treatment of diabetes.
Pancreatic; Stem cells; Cell differentiation; Homograft; Transplantation
10.3760/cma.j.issn.1674-1935.2011.01.017
青岛市科技局基金项目计划(07-2-1-2-nsh)
266071 山东青岛,青岛市立医院肝胆胰外科(史光军、许评、栾绍海、于江、陈昊强);济宁医学院附属医院急诊外科(张磊)
许评,Email:Xu.ping@263.net
