胰腺癌MiaPaCa-2细胞总RNA体外转染树突细胞的方法探讨
2011-11-22陈江郭晓钟
陈江 郭晓钟
·论著·
胰腺癌MiaPaCa-2细胞总RNA体外转染树突细胞的方法探讨
陈江 郭晓钟
目的探讨将胰腺癌MiaPaCa-2细胞总RNA转染树突细胞(DCs)最优化的方法。方法以rhGM-CSF、rhIL-4和TNF-α联合诱导外周血单核细胞以获得DCs,观察DCs的形态变化,流式细胞术检测DCs表面标志CD40、HLA-DR、CD83和CD86表达,混合淋巴细胞反应(MLR)测定DCs刺激异体T细胞增殖的能力。采用脂质体转染、电穿孔及被动转染三种方法将MiaPaCa-2总RNA转染DCs,应用实时定量PCR法检测MUC1 mRNA表达,MTT法测定DCs存活率。结果所获细胞具有典型的成熟DCs形态特征,CD40、HLA-DR、CD83和CD86阳性表达率分别为34.3%、50.2%、89.2%和73.6%,对同种异体T淋巴细胞具有极强的刺激增殖作用。电穿孔法DCs转染48 h后, DCs的MUC1 mRNA表达量为45.39±9.33,明显高于脂质体法的31.68±7.25和被动转染法的18.53±3.26;DCs存活率为(80.36±2.43)%,较被动转染法的(91.48±5.42)%略低,但高于脂质体法的(67.44±2.51)%,且基本稳定在80%左右。结论采用电穿孔法将胰腺癌MiaPaCa-2细胞总RNA体外转染DCs的效率较高,且较安全。
胰腺肿瘤; 树突细胞; RNA转染
树突细胞(dendrtic cells, DCs)肿瘤疫苗在抗肿瘤免疫治疗中的作用正受到学界的广泛关注,已开展的几项早期临床研究证实,其对多种类型肿瘤有显著的治疗效果[1]。构建DCs肿瘤疫苗的关键点之一在于肿瘤抗原负载方式的选择,而近年来出现的RNA转染DCs构建肿瘤疫苗的方法在临床应用方面独具优点[2]。然而迄今为止尚无胰腺癌细胞这方面的报道。本研究通过观察胰腺癌细胞株MiaPaCa-2的MUC1表达和DCs存活率的变化,探索RNA转染DCs的最优方法,为胰腺癌肿瘤疫苗构建和临床应用提供实验依据。
材料和方法
一、胰腺癌细胞总RNA提取及DCs培养、鉴定
人胰腺癌细胞株MiaPaCa-2为沈阳军区总医院消化科实验室保存。将其接种于含10%小牛血清的RPMI 1640培养液中常规培养,选用对数生长期的细胞,采用Trizol提取细胞总RNA备用。
取20例健康志愿者和8例胰腺癌患者外周血,均获得志愿者和患者的知情以及医院伦理委员会的同意。通过Ficoll-paqueTplus密度梯度离心法分离获取单核细胞(MCs),常规培养。待细胞贴壁1 h后,取出未贴壁的细胞另做培养备用外,更换新鲜培养液继续培养20 h,加入rhGM-CSF(800 IU/ml)和rhIL-4(500 IU/ml)再培养5 d后加入TNF-α(10 ng/ml),培养至第10天,收集成熟DCs。使用倒置显微镜和电镜连续观察体外培养5~10 d的DCs的形态学变化。收集DCs,分装5管,分别加入鼠抗人CD40、HLA-DR、CD83、CD86荧光单抗和作为对照的荧光标记的同种型IgG(Santa-Cruz,USA),用流式细胞仪分析,每个样品分析细胞数>1×106。
二、DCs刺激同种异体T细胞增殖能力的检测
采用混合淋巴细胞反应(MLR)方法。以成熟DCs作为刺激细胞,以异体未贴壁的MCs作为反应细胞,按照刺激与效应细胞1∶10、1∶20、1∶40、1∶80和1∶160比例分别加入到96孔板中,终体积200 μl,以同种同体T细胞+DCs作为对照组。在37℃、5%CO2培养箱孵育5 d,收获细胞前18 h每孔加入3H-TdR(中科院原子能所)1 μCi,采用液闪烁仪检测每分钟脉冲数(CPM)。
三、MiaPaCa-2细胞总RNA转染DCs
收集的DCs经洗涤后,采用Opti-MEM重悬,调节DCs浓度为2×106/ml。取3 μg MiaPaCa-2细胞总RNA加入1 ml DCs中,而后分别参考Kalady等[3]的脂质体转染法和Fujii等[4]的电穿孔法及被动转染方法,将混合细胞于37℃、5% CO2培养箱孵育0、12、24、48、72、96 h。
四、RNA转染后DCs的MUC1 mRNA表达检测
采用实时定量RT-PCR(QRT-PCR)检测。应用Primer premier 5.0软件设计MUC1及次黄嘌呤磷酸核糖基转移酶(HPRT)引物,并经Gene bank验证。MUC1上游5′-TGAGTGATGTGC-3′,下游5′-CTG-CCCGTAGTTCTTTCG-3′,扩增产物158 bp;HPRT上游5′-GGTTCTCGGGGCACCTCT-3′,下游5′-TCGGCTTGAAATGACCTAATG-3′,扩增产物221 bp。收集使用3种方法转染0~96 h的DCs 1×106个,采用Trizol提取细胞总RNA。按Sensiscript RT Kit(Qiagen,Germany)说明书行RT反应。在Exicycler 96定量PCR仪(South Korea)上,按照QuantiTect SYBR Green PCR Kit(Qiagen,Germany)说明书行PCR。反应条件:95℃ 15 min,94℃ 20 s、60℃ 20 s、72℃ 20 s, 40个循环,最后68℃ 60 s。用双标准曲线法依据公式F=(待测样品目的基因浓度/待测样品看家基因浓度)/(对照组目的基因浓度/对照组看家基因浓度)[5],对MUC1 mRNA进行相对定量,每个样品重复2次,取均值。
五、DCs存活率检测
将采用三种方法转染MiaPaCa-2细胞总RNA的DCs接种在96孔板上,调整细胞浓度(5×106~10×106)/ml,体积180 μl,培养0、12、24、48、72、96 h,加入MTT 20 μl,37℃孵育4 h。弃上清液,每孔加DMSO 100 μl,震荡10 min,酶标仪测A490值,以未转染DCs作为对照。细胞存活率=(转染组A490值/对照组A490值)×100%,实验重复3次,取均值。
六、统计学处理

结 果
一、DCs的形态变化、表面标志及抗原递呈能力
培养第5天,细胞多悬浮生长并聚集成团(图1a),但结合较松散,轻吹打即可分散漂浮,漂浮细胞边缘呈毛茸状(图1b);电镜下见胞体表面粗糙,向四周伸出大量树枝状或裙褶状不规则突起,部分突起末端呈球状膨大(图1c),培养第10天,胞核染色深,偏向一侧,形状不规则,分叶状,具有典型的DC形态特征(图1d)。健康志愿者与胰腺癌患者MCs培养形成的DCs在形态方面无明显差别。成熟DCs的表面标志物CD40、HLA-DR、CD83和CD86均阳性表达(图2),阳性表达率分别为34.3%、50.2%、89.2%和73.6%。成熟DCs具有极高的抗原递呈能力,对同种异体T淋巴细胞具有极强的刺激增殖作用。健康志愿者与胰腺癌患者DCs的刺激同种异体T细胞增殖的能力无显著性差异(P>0.05,图3)。
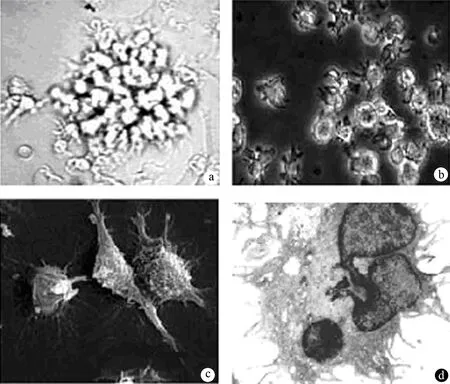
图1体外培养的健康志愿者和胰腺癌患者外周血DCs细胞的光镜(a、b)和电镜观察(c、d)
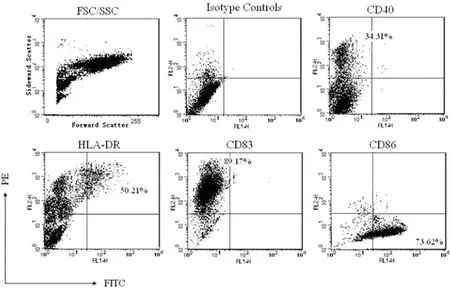
图2体外培养的健康志愿者和胰腺癌患者外周血成熟DCs细胞表面标志物的表达
二、MiaPaCa-2细胞总RNA转染后DCs的MUC1 mRNA表达
转染后24、48 h DCs细胞MUC1 mRNA表达水平渐强,72、96 h表达渐弱,组间比较有统计学意义(P<0.05),其中电转染的DCs的MUC1 mRNA表达水平较脂质体和被动转染的DCs强(P<0.05,表1)。

图3健康志愿者与胰腺癌患者DCs刺激同种异体T细胞增殖的能力
三、DCs存活率
被动转染法对DCs存活率变化影响最小,且在不同时间点的细胞存活率相差不大;脂质体转染法对细胞毒性作用较明显,DCs存活率呈时间依赖性显著下降;电转染法对DCs有一定的毒性作用,细胞存活率较被动转染法低,但不同时间点的细胞存活率变化不大,稳定在80%左右(图4)。

图4 三种转染方法的DCs存活率
讨 论
DC肿瘤疫苗作为一种主动免疫的抗肿瘤方法,能够通过激活自身免疫系统,识别并杀伤肿瘤细胞,并可使机体免疫系统获得长期监视和预防肿瘤复发的能力[6]。因其对肿瘤细胞的杀伤遵循0级动力学效应,有可能彻底清除肿瘤细胞,被认为是胰腺癌免疫治疗中的最具前途的方法之一。
本实验将GM-CSF、IL-4和TNF-α联合作用人外周血MCs获得DCs,无论是健康志愿者还是胰腺癌患者,所获的目标细胞均具有典型的DC形态学特征,细胞表面有HLA-DR、CD40、CD83和CD86等成熟DCs表面标志物的阳性表达,均具有较强的抗原呈递能力。
RNA转染DCs的肿瘤疫苗具有显著的优点[7]:转染的RNA只进入DCs胞质而非胞核,对细胞的损伤小;RNA半衰期短,RNA转染的DC疫苗更为安全;负载的肿瘤抗原可从很少量的癌细胞中经PCR扩增获得;RNA模板本身可经进一步的序列修饰,稳定性较强。目前常用的以RNA转染DCs的方法主要有RNA-阳离子脂质体复合物、被动转染和电穿孔法等。

表1 三种方法转染的DCs的MUC1 mRNA表达
注:与被动转染法比较,aP<0.05;与脂质体转染法比较,bP<0.05;与对照组(0 h)和其他时间点比较,cP<0.05
被动转染法是将RNA和DCs共孵育,凭借DCs所具有的吞噬能力达到转染的目的。本实验采用被动转染法将MiaPaCa-2细胞总RNA转染DCs后,胰腺癌相关抗原MUC1弱阳性表达,转染前后DCs存活率变化不大。提示此法虽对DCs本身的损伤较小,但转染时间较长,RNA易被降解,转染率较低。
以阳离子脂质体作为载体转染DCs是目前应用最多的一种方法。Lu等[8]采用该法转染乳腺癌细胞系,获得了报告基因mRNA的高表达。但阳离子脂质体本身具有毒性,且转染所需时间长。本实验采用该法转染的DCs虽有较强的MUC1表达,但DCs存活率下降显著。明显的细胞毒性可能会限制其临床应用。
电穿孔法是一种效率较高的转染方法,穿孔过程仅需1 s,整个过程仅5 min,故特别适用于半衰期短、易降解的RNA转染[9-10]。本实验采用电穿孔法转染的DCs有较强的MUC1表达,DC表面抗原的表达量明显高于其他两种方法,且转染前后DCs生存率无显著变化,稳定在80%左右。提示电穿孔法不但转染效率较高、且较为安全,可能是构建RNA转染DCs胰腺癌肿瘤疫苗的最优方法。
[1] Ballestrero A,Boy D,Moran E,et al.Immunotherapy with dendritic cells for cancer.Adv Drug Deliv Rev,2008,60:173-183.
[2] Tyagi RK,Mangal S,Garg N,et al.RNA-based immunotherapy of cancer: role and therapeutic implications of dendritic cells.Expert Rev Anticancer Ther,2009,9:97-114.
[3] Kalady MF,Onaitis MW,Emani S,et al.Sequential delivery of maturation stimuli increases human dendritic cell IL-12 production and enhances tumor antigen-specific immunogenicity.J Surg Res,2004,116:24-31.
[4] Fujii S,Goto A,Shimizu K.Antigen mRNA-transfected,allogeneic fibroblasts loaded with NKT-cell ligand confer antitumor immunity.Blood,2009,113:4262-4272.
[5] Klein D.Quantification using real-time PCR technology:applications and limitations.Trends Mol Med,2002,8:257-260.
[6] Toh HC,Wang WW,Chia WK,et al.Clinical benefit of allogeneic melanoma cell lysate-pulsed autologous dendritic cell vaccine in MAGE-positive colorectal cancer patients.Clin Cancer Res,2009,15:7726-7736.
[7] Okano K,Fukui M,Suehiro Y,et al.Evaluation of an mRNA lipofection procedure for human dendritic cells and induction of cytotoxic T lymphocytes against enhanced green fluorescence protein.Tumour Biol,2003,24:317-324.
[8] Lu D,Benjamin R,Kim M,et al.Optimization of methods to achieve mRNA-mediated transfection of tumor cells in vitro and in vivo employing cationic liposome vectors.Cancer Gene Ther,1999,1:245-252.
[9] Van Tendeloo VF,Ponsaerts P,Lardon F,et al.Highly efficient gene delivery by mRNA electroporation in human hematopoietic cells:superiority to lipofection and passive pulsing of mRNA and to electroporation of plasmid cDNA for tumor antigen loading of dendritic cells.Blood,2001,98:49-56.
[10] Van Meirvenne S,Straetman L,Heirman C,et al.Efficient genetic modification of murine dendritic cells by electroporation with mRNA.Cancer Gene Ther,2002,9:787-797.
2010-07-26)
(本文编辑:屠振兴)
OptimizingmethodofpancreaticcancerMiaPaCa-2cellstotalRNA-transfecteddendrticcells
CHENJiang,GUOXiao-zhong.
DepartmentofGastroenterology,GeneralHospitalofShenyangMilitaryCommand,Shenyang110016,China
GUOXiao-zhong,Email:Guoxiaozhong1962@163.com
ObjectiveTo investigate the best method of transfecting total RNA extracted from pancreatic cancer MiaPaCa-2 cells into dendrtic cells (DCs).MethodsDCs were cultured from peripheral blood mononuclear cells induced by rhGM-CSF, rhIL-4 and TNF-α. Morphology of DCs was observed. Flow cytometry was used to detect the mature DCs specific surface markers: CD40, HLA-DR, CD83, CD86. Mixed lymphocyte (MLR) was used to determine the ability of DCs to stimulate allogeneic T cell proliferation. Liposomal transfection, electroporation method and passive transfection was used to transfect MiaPaCa-2 cell total RNA into DCs, Real time RT-PCR and MTT assay was used to determine the expression of MUC1 mRNA and the survival rate of the RNA transfected DCs.ResultsThe cells acquired showed typical DCs morphology, the positive rate of CD40, HLA DR, CD83and CD86were 34.3%,50.2%,89.2%and73.6%, and they showed a strong ability to stimulate allogeneic T cell proliferation. 48 h after transfection with MiaPaCa-2 cells total RNA by using electroporation, the MUC1 mRNA amount (45.39±9.33) in DCs was higher than that of liposomes method (31.68±7.25) and passive transfection method (18.53±3.26)。DCs survival rate was (80.36±2.43)% by using electroporation, which was relatively lower than (91.48±5.42)%by using passive transfection method, but higher than (67.44±2.51)% by using liposomes method, and it was stabilized around 80%.ConclusionsTransfecting total RNA extracted from pancreatic cancer MiaPaCa-2 cells into DCs with electroporation is efficient and safe.
Pancreatic neoplasms; Dendritic cells; RNA Transfection
10.3760/cma.j.issn.1674-1935.2011.01.008
110016 沈阳,沈阳军区总医院消化科
郭晓钟,Email:Guoxiaozhong1962@163.com
