HDAC1基因沉默对人胰腺癌细胞PaTu8988细胞周期的影响
2011-11-22高道键满晓华徐岷张玉琦高军龚燕芳吴红玉金晶许国铭李兆申
高道键 满晓华 徐岷 张玉琦 高军 龚燕芳 吴红玉 金晶 许国铭 李兆申
·论著·
HDAC1基因沉默对人胰腺癌细胞PaTu8988细胞周期的影响
高道键 满晓华 徐岷 张玉琦 高军 龚燕芳 吴红玉 金晶 许国铭 李兆申
目的探讨组蛋白脱乙酰基酶1(HDAC1)基因沉默对人胰腺癌PaTu8988细胞周期影响及可能机制。方法常规培养胰腺癌PaTu8988细胞,分为对照组、阴性siRNA转染 (c-siRNA)组及15、30 nmol/L HDAC1 siRNA转染组。采用脂质体2000转染细胞48 h后,应用蛋白质印迹法检测细胞HDAC1基因沉默效率及p21基因表达;流式细胞法检测细胞周期的变化。结果与对照组比较,30 nmol/L HDAC1 siRNA组PaTu8988细胞的HDAC1蛋白表达明显下降,p21蛋白表达明显增加;G2/M期细胞比例显著减少[(21.48±3.67)%比(28.28±2.94)%,P<0.05],S期细胞比例显著增加[(50.20±6.85)%比(32.49±2.78)%,P<0.05]。结论HDAC1 siRNA能特异、有效地抑制人胰腺癌PaTu8988细胞HDAC1的表达,引起细胞S期阻滞,其机制可能与上调p21蛋白表达有关。
胰腺肿瘤; 组蛋白脱乙酰基酶类; RNA干扰; 细胞周期
共同第一作者:满晓华
组蛋白乙酰化状态由组蛋白乙酰基酶和组蛋白脱乙酰基酶(histone deacetylase,HDACs)调节,组蛋白乙酰化状态的失衡与肿瘤的发生密切相关[1]。肿瘤细胞HDAC 1高表达可明显增强肿瘤细胞的增殖能力,并通过影响细胞外基质而使肿瘤细胞移行和侵袭力明显增强[2]。我们前期研究[3]结果显示,HDAC1 siRNA转染人胰腺癌PaTu8988细胞后能特异、有效地抑制细胞HDAC1表达,抑制细胞增殖、诱导细胞凋亡。有研究发现,HDAC抑制剂可影响细胞周期,故本研究观察HDAC1对胰腺癌细胞周期的调控作用及其机制。
材料和方法
一、细胞培养及分组
PaTu8988胰腺癌细胞系由德国Marburg市Philipps大学细胞生物学和分子病理学研究所Elsasser博士惠赠,常规培养传代。取对数生长期细胞,按1×105/孔接种于培养板培养过夜,分为对照组、对照siRNA(c-siRNA)组,HDAC1 siRNA 15、30 nmol/L组。每组3个复孔。对照组未予任何处理; c-siRNA组和HDAC1 siRNA 15、30 nmol/L组分别采用脂质体2000(美国Invitrogen公司)将30 nmol/L的c-siRNA或15、30 nmol/L的HDAC1 siRNA转染PaTu8988细胞。HDAC1 siRNA和c-siRNA由美国Ambion公司设计和合成,HDAC1 siRNA正义链:5′-GCCGGUCAUGUCCAAAGUATT-3′,反义链:5′-UACUUUGGACAUGACCGGCTT-3′。 转染步骤参见美国Invitrogen公司的转染操作手册,转染6 h后更换成DMEM培养液,常规培养48 h后消化,收集细胞。
二、HDAC1、p21蛋白检测
提取各组细胞总蛋白,采用BCA 法行蛋白定量,取20 μg蛋白常规行蛋白质印迹法检测HDAC1、p21蛋白表达。兔抗人HDAC1多抗(sc-7872,Santa Cruz公司)工作浓度1∶1000;鼠p21单抗(AP021,碧云天公司)工作浓度1∶500;HRP标记羊抗兔二抗工作浓度1∶2000。最后ECL发光,X片曝光,暗室显影、定影后扫描。以GAPDH作为内参照。
三、细胞周期检测
收集各组细胞,用预冷PBS洗后制成细胞悬液,加入预冷的70%乙醇4℃固定过夜。加入100 μg/ml的RNase 10 μl、50 μg/ml的碘化丙啶300 μl(晶美生物公司),4℃避光孵育30 min,上流式细胞仪检测。具体步骤按晶美生物公司的操作手册。
四、统计学处理
结 果
一、PaTu8988细胞HDAC1、p21蛋白表达的变化
15、30 nmol/L HDAC1 siRNA组细胞HDAC1蛋白表达明显低于对照组和c-siRNA组,30 nmol/L HDAC1 siRNA组表达量最低(图1a);而p21蛋白表达明显高于对照组和c-siRNA组,30 nmol/L HDAC1 siRNA组的表达量最高(图1b)。
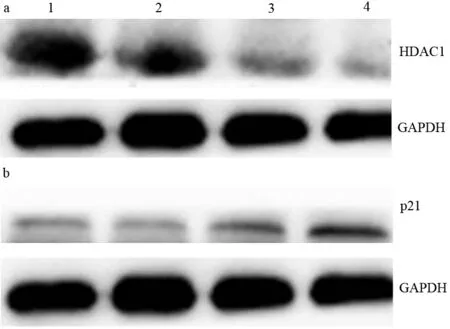
1:对照组;2:c-siRNA组;3:15 nmol/L HDAC1 siRNA组;4:30 nmol/L HDAC1 siRNA组
图1各组PaTu8988细胞HDAC1(a)和p21(b)蛋白的表达
二、PaTu8988细胞周期的变化
两个HDAC1 siRNA组G2/M期细胞比例均显著低于对照组和c-siRNA组,S期细胞比例均显著高于对照组和c-siRNA组(P值均<0.05);30 nmol/L HDAC1 siRNA组G0/G1期细胞比例显著低于对照组(P<0.05,表1,图2)。
表1 各组PaTu8988细胞的细胞周期比例
注:与对照组比较,aP<0.05;与c-siRNA 组比较,bP<0.05
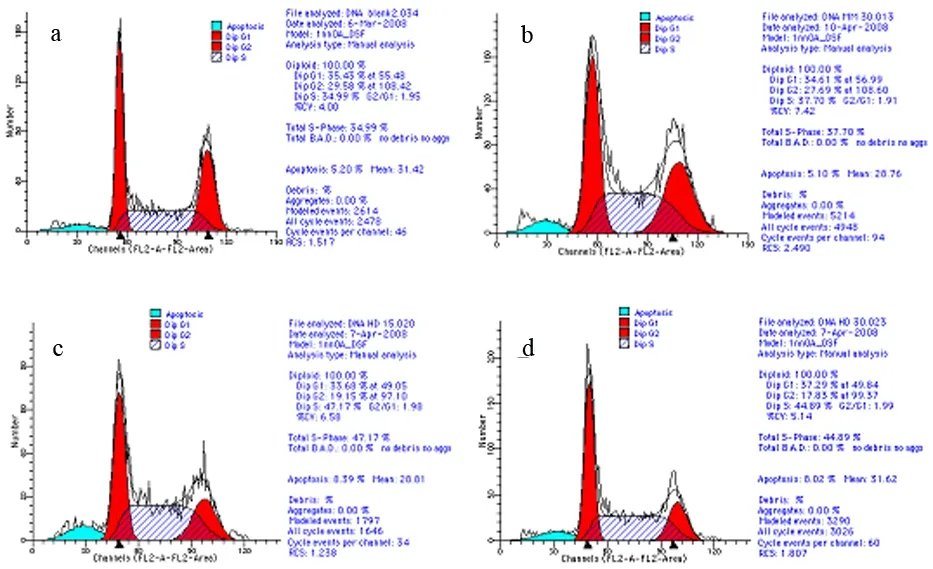
a:对照组,b:c-siRNA组,c:15 nmol/L HDAC1 siRNA组,d:30 nmol/L HDAC1 siRNA组
图2HDAC1 siRNA干扰对PaTu8988细胞周期的影响
讨 论
许多研究发现,HDAC1参与了胃癌、结肠癌、肝癌、前列腺癌等肿瘤的发生发展。应用HDAC抑制剂具有确切的抗增殖和抗肿瘤效果[4-5]。我们先前的研究也显示抑制HDAC1表达后可抑制胰腺癌细胞增殖、诱导胰腺癌细胞凋亡[3]。
肿瘤细胞增殖抑制和细胞凋亡都与细胞周期受阻密切相关,二者之间存在着复杂和精细的调控网络。正常细胞往往因为生长周期失控,进而导致细胞恶性转化和肿瘤形成。不同细胞中HDACs的表达谱是不一样的,所以去除相同的HDACs在不同的细胞株中可能产生的作用不同[6]。细胞周期是指细胞从一次分裂结束到下一次分裂终了的过程,其中最关键的是S期,此期细胞进行DNA倍增和染色体复制。本实验结果显示,HDAC1 siRNA瞬间转染胰腺癌细胞可使G2/M期细胞比例显著降低,而S期细胞比例显著增高, G0/G1期细胞比例亦有下降,提示沉默HDAC1基因可引起S期细胞周期阻滞,导致肿瘤细胞DNA倍增和染色体复制抑制,进而阻碍细胞分裂,实现对胰腺癌细胞增殖的抑制作用。
p21是最早被发现的细胞周期素依赖激酶抑制因子(cyclin-dependent kinase inhibitor,CDKI),CDKI通过与CDK复合物紧密结合,或与CDK直接结合,抑制细胞周期素与CDK结合而实现负调控作用。p21还可通过抑制CDK2/cyclin B激酶复合物的活性引起G2/M期阻滞[6]。HDAC抑制剂可以明显上调p21的转录[7-8]。Lagger等[9]报道,HDAC 1一个重要的增殖相关功能就是抑制p21和p27的异常表达。本结果显示,siRNA干扰HDAC1后细胞p21蛋白表达增加,提示沉默HDAC1基因是通过上调p21表达而影响细胞周期。
[1] Jones PA, Martienssen R. A blueprint for a human epigenome project: the AACR human epigenome workshop. Cancer Res,2005,65:11241-11246.
[2] Whetstine JR, Ceron J, Ladd B, et al. Regulation of tissue-specific and extracellular matrix-related genes by a class I histone deacetylase.Mol Cell,2005,18:483-490.
[3] 高道键,徐岷,张玉琦,等.组蛋白去乙酰化酶1对人胰腺癌细胞增殖凋亡的影响. 中华消化杂志,2009,29:525-528.
[4] Johnstone RW. Histone-deacetylase inhibitors: novel drugs for the treatment of cancer. Nat Rev Drug Discov,2002,1:287-299.
[5] Richon VM, Zhou X, Rifkind RA,et al. Histone deacetylase inhibitors: development of suberoylanilide hydroxamic acid (SAHA) for the treatment of cancers. Blood Cells Mol Dis, 2001,27:260-264.
[6] Roninson IB. Oncogenic functions of tumour suppressor p21(Waf1/Cip1/Sdi1): association with cell senescence and tumour-promoting activities of stromal fibroblasts. Cancer Lett,2002,179:1-14.
[7] Varshochi R, Halim F, Sunters A, et al. ICI182,780 induces p21Waf1 gene transcription through releasing histone deacetylase 1 and estrogen receptor alpha from Sp1 sites to induce cell cycle arrest in MCF-7 breast cancer cell line. J Biol Chem,2005,280:3185-3196.
[8] Davie JR. Inhibition of histone deacetylase activity by butyrate. J Nutr,2003,133:2485S-2493S.
[9] Lagger G, O′Carroll D, Rembold M, et al. Essential function of histone deacetylase 1 in proliferation control and CDK inhibitor repression. Embo J,2002,21:2672-2681.
2010-11-29)
(本文编辑:屠振兴)
Effectsofhistonedeacetylase1genesilencingoncellcycleregulationofpancreaticcancercelllinePaTu8988
GAODao-jian,MANXiao-hua,XUMin,ZHANGYu-qi,GAOJun,GONGYan-fang,WUHong-yu,JINJing,XUGou-ming,LIZhao-shen.
DepartmentofEndoscopy,EasternHepatobiliarySurgeryHospital,SecondMilitaryMedicalUniversity,Shanghai200438,China
LIZhao-shen,Email:lizhaoshench@gmail.com
ObjectiveTo investigate the effects of histone deacetylase 1 (HDAC1) gene silencing on cell cycle of pancreatic cancer cell line PaTu8988 and possible mechanism.MethodsThe PaTu8988 cells were routinely cultured and divided into control group, negative control siRNA group (c-siRNA), HDAC1 siRNA 15 nmol/L group and HDAC1 siRNA 30nmol/L group. After Liposomes 2000 transfection for 48 h, the Western blotting was used to detect the efficiency of HDAC1 gene silencing on protein levels and the expression of p21 protein. Cell cycle was evaluated by using flow cytometry.ResultsCompared with that of control group, the expression of HDAC1 protein in PaTu8988 cell of HDAC1 siRNA 30nmol/L group was significantly decreased, and the expression of p21 protein was significantly increased; the percentage of G2/M phase cells were significantly decreased [(21.48±3.67)%vs. (28.28±2.94) %,P<0.05]; while the percentage of S phase cells were significantly increased [(50.20±6.85)%vs. (32.49±2.78)%,P<0.05].ConclusionsHDAC1 siRNA can efficiently and specifically inhibit the expression of HDAC1 in PaTu8988 cells, and can induce S phase cells arrest, which may be related with up-regulation of p21 protein expression.
Pancreatic neoplasms; Histone deacetylases; RNA interference; Cell cycle
10.3760/cma.j.issn.1674-1935.2011.05.004
重大国际合作项目(30910103911)
200438 上海,第二军医大学附属东方肝胆外科医院内镜科(高道键);第二军医大学长海医院消化内科(满晓华、徐岷、张玉琦、高军、龚燕芳、吴红玉、金晶、许国铭、李兆申)
李兆申,Email: lizhaoshench@gmail.com
