CEA启动子驱动下表达Hsp70基因的重组腺病毒的构建及鉴定
2011-11-22孙运良徐灿苏长青高军金晶吴红玉李兆申
孙运良 徐灿 苏长青 高军 金晶 吴红玉 李兆申
·论著·
CEA启动子驱动下表达Hsp70基因的重组腺病毒的构建及鉴定
孙运良 徐灿 苏长青 高军 金晶 吴红玉 李兆申
目的构建癌胚抗原(CEA)启动子驱动下靶向表达热休克蛋白70(Hsp70)基因的重组腺病毒。方法通过RT-PCR和PCR的方法分别扩增人Hsp70基因和CEA启动子,构建穿梭质粒pDC316-pCEA-Hsp70。将所得的穿梭质粒与腺病毒骨架质粒共转染293细胞获得重组腺病毒Ad5-pCEA-Hsp70。通过梯度离心纯化病毒,采用半数细胞培养物感染量测定病毒滴度。分别以重组的腺病毒感染CEA阳性的人胰腺癌BxPC3细胞和CEA阴性的SW1990细胞,通过RT-PCR和ELISA法检测Hsp70 mRNA和蛋白的表达。结果酶切和测序证实Hsp70基因和CEA启动子成功插入PDC316质粒。与骨架质粒共转染293细胞获得的病毒经PCR扩增证实重组腺病毒构建成功。最终获得的病毒颗粒数达2.2×1011vp/ml,滴度为1.5×1010PFU/ml。重组腺病毒感染CEA阳性表达的BxPC3细胞后,可显著增加Hsp70 mRNA和蛋白的表达,而感染CEA阴性的SW1990细胞,Hsp70 mRNA和蛋白的表达无变化。结论成功构建了能够在CEA阳性细胞中靶向表达Hsp70基因的重组腺病毒Ad5-pCEA-Hsp70,为进一步研究奠定了基础。
重组,遗传; 热休克蛋白质70; CEA启动子; 腺病毒
近年来热休克蛋白70(heat shock protein70,Hsp70)在免疫应答中的作用引起人们的广泛关注,其在机体的抗感染免疫、自身免疫,尤其是在肿瘤免疫中起重要作用[1]。研究证实,Hsp70可结合肿瘤细胞表达的多肽类抗原,通过内源性途径传递给主要组织相容性抗原复合物Ⅰ类分子,引发特异性的细胞毒性T细胞反应,诱导机体产生强大的抗肿瘤免疫效应[2-4]。因此,将携带Hsp70基因的载体导入肿瘤细胞,并在细胞内稳定表达,从而增强和诱导机体的抗肿瘤免疫反应已成为目前肿瘤免疫治疗研究的热点之一[5]。癌胚抗原(CEA)是最早被发现和鉴定的肿瘤相关抗原之一,在很多腺体肿瘤中均能大量表达。本研究构建CEA基因启动子驱动下表达Hsp70的重组腺病毒载体,以期在CEA阳性的肿瘤细胞中靶向性表达Hsp70,为进一步的基础研究和临床应用奠定基础。
材料和方法
一、人Hsp70基因和CEA启动子的克隆
人胰腺癌细胞株PANC1、SW1990、BxPC3、Capa-Ⅱ、CF为本实验室保存。常规培养、收集PANC1细胞,提取总RNA。采用RT-PCR法扩增Hsp70基因,上游5′-CCCAAGCTTATGGCCAAAGCC-GCGGCG-3′,下游5′-GCGTCGACCTAATCTACCTCC-TCAATGGTGGG-3′,产物1826bp。同时提取健康志愿者外周血总RNA,RT-PCR法扩增人CEA启动子(pCEA)序列(-299~+69),上游5′-GAATTCCCCGGGACCCTGCTGGGTTTC-3′,下游5′-GCTTGA-GTTCCAGGAACGTTTTGGGATCC-3′,产物386 bp。PCR产物经1.0%琼脂糖凝胶电泳后,用凝胶DNA回收试剂盒(QIAGEN公司)回收、纯化扩增产物。通过T-A克隆,将纯化的PCR产物分别插入pMD-18T质粒(TaKaRa 公司),转化DH5a感受态细菌,涂布含氨苄青霉素的LB平板培养过夜,次日挑取单个菌落,在LB液体培养基摇菌培养过夜后,用质粒提取试剂盒(QIAGEN公司)提取质粒DNA。用酶切法鉴定,并送上海invitrogen公司测序。正确插入的载体分别命名为T-Hsp70和T-pCEA。
二、腺病毒穿梭质粒的构建
分别用Hind Ⅲ和Sal Ⅰ双酶切质粒pDC316(Microbix Biosystems公司)和T-Hsp70,酶切产物经琼脂糖凝胶电泳后回收,经T4 DNA连接酶连接,转化DH5a感受态细菌。提取的质粒经酶切鉴定正确后命名为pDC316-Hsp70。
分别用Xba I和EcoR I双酶切质粒pDC316-Hsp70和T-pCEA,酶切产物经电泳后回收,经T4 DNA连接酶连接,转化DH5a感受态细菌。提取重组质粒,酶切鉴定正确后命名为pDC316-pCEA-Hsp70。
三、重组腺病毒的包装、鉴定和扩增
HEK293细胞购自Roche公司,常规培养。采用Lipofectamine2000将腺病毒骨架质粒pBHG lox△E1、3Cre(Microbix Biosystems公司)和重组质粒pDC316-pCEA-Hsp70共转染至293细胞。转染9~14 d后出现病毒空斑,经3次病毒空斑纯化,提取腺病毒DNA。应用PCR法进行鉴定,阳性病毒命名为Ad5-pCEA-Hsp70。
将293细胞培养于75 cm2培养瓶,待细胞达到80%~90%融合时,加入适量病毒粗提液。培养3~4 d后离心收集细胞,加AD buffer保存液,-80℃至37℃冻融3次,离心收集上清。再反复感染293细胞,扩增病毒至所需要量。
采用CsCl 梯度离心法纯化所得的病毒原液,应用紫外分光光度计测定A260值,计算病毒颗粒数。采用半数细胞培养物感染量(tissue culture infective dose, TCID50)测定病毒滴度。
四、胰腺癌细胞系CEA表达的检测
将人胰腺癌细胞株PANC1、SW1990、BxPC3、Capa-Ⅱ、CF分别以1×106个细胞接种于10 cm培养瓶。细胞贴壁后更换培养液,继续培养48 h,收集培养液,以电化学发光法(试剂盒购自Roche公司)检测培养液的CEA含量。以CEA阳性的结肠癌细胞株HT-29作为阳性对照,以单纯培养液作为阴性对照。
五、Ad5-pCEA-Hsp70的Hsp70表达的鉴定
将CEA阳性的BxPC3和CEA阴性的SW1990细胞分别以1×105/孔接种于12孔板,以病毒感染复数(multiplicity of infection, MOI)=10的Ad5-pCEA-Hsp70感染细胞,继续培养48 h,采用RT-PCR和ELISA法(试剂盒购自StressGen公司)分别检测Hsp70 mRNA和蛋白的表达。
结 果
一、Hsp70基因和CEA启动子克隆的鉴定
Hsp70基因和pCEA的PCR产物经琼脂糖凝胶电泳后分别见约2000 bp、380 bp的单一条带,与预期长度一致(图1);测序结果与GenBank中HSP70的全长编码区序列(登录号为NM_005345.5)、文献报道的CEA启动子序列[5]完全一致。

图1Hsp70 (a)和CEA启动子(b)的PCR产物琼脂糖凝胶电泳分析
二、腺病毒质粒pDC316-pCEA-Hsp70的鉴定
pDC316-Hsp70质粒分别经HindⅢ、SalⅠ单酶切后电泳,均可见约5900 bp的单一条带;经HindⅢ和SalⅠ双酶切后电泳,可见约3900 bp和2000 bp的2个条带(图2a)。
pDC316-pCEA-Hsp70分别经Xba I和EcoR I单酶切后电泳,均可见约6000 bp的单一条带;经双酶切后电泳,可见约5500 bp和500 bp的2个条带(图2b)。

M:Maker;1:未酶切;2:HindⅢ单酶切;3:SalⅠ单酶切;4:HindⅢ和SalⅠ双酶切;1:Xba I单酶切;2:EcoR I单酶切;3:Xba I和EcoR I双酶切
图2pDC316-Hsp70(a)、pDC316-pCEA-Hsp70(b)酶切电泳图
三、重组腺病毒Ad5-pCEA-Hsp70鉴定和扩增
pBHG lox△E1、3Cre和pDC316-pCEA-Hsp70共转染293细胞后形成的病毒经抽提DNA、PCR扩增,产物电泳,显示部分重组腺病毒(图3的2、4泳道)能扩增出和阳性对照(6泳道)大小一致的Hsp70基因片段(5泳道),为重组成功的腺病毒。冻融法扩增重组腺病毒后,病毒颗粒数达2.2×1011vp/ml,滴度为1.5×1010PFU/ml。
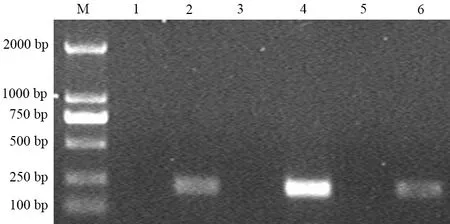
M:Maker;1:293细胞;2:pDC316-Hsp70;3~6:不同的重组腺病毒样本
图3重组腺病毒的PCR鉴定
四、不同胰腺癌细胞系的CEA分泌量检测
PANC1、SW1990、Capa-Ⅱ细胞均不分泌CEA,而CF、BxPC3、HT-29均分泌CEA,1×106个细胞培养24 h后,培养上清的CEA含量分别为(2.1±0.4)、(37.2±3.5)、(2.8±0.6)ng/ml。
五、重组腺病毒Ad5-pCEA-Hsp70靶向表达Hsp70的鉴定
取CEA阳性的BxPC3细胞和CEA阴性的SW1990细胞,经重组腺病毒感染后,BxPC3细胞的Hsp70 mRNA表达增加(图4),培养上清中的Hsp70蛋白含量从(56.2±7.9)ng/ml增加到(401.1±36.9)ng/ml;而SW1990细胞的Hsp70 mRNA表达无变化(图4),培养上清中的Hsp70蛋白含量也无明显变化[(50.3±8.9)ng/ml)比(63.1±10.2)ng/ml]。

1:BxPC3感染前;2:BxPC3感染后;3:SW1990感染前;4:SW1990感染后
图4Ad5-pCEA-Hsp70感染前后细胞Hsp70 mRNA表达
讨 论
肿瘤在发生发展过程中,由于肿瘤细胞的异质性和基因多样性,同时肿瘤抗原肽自身稳定性差、易降解和低免疫原性等特点,常常逃避了机体免疫系统的识别,导致免疫耐受。研究表明,Hsp70不仅可作为抗原提呈的辅助分子参与肿瘤抗原肽的加工和处理,增强肿瘤抗原的稳定性和免疫原性,而且可作为抗原提呈分子直接将肿瘤抗原肽提呈给T细胞,特别是细胞毒性T细胞,从而激发机体的抗肿瘤特异性免疫反应[2-3,6]。Hsp70也可通过活化自然杀伤细胞及γ/δ T细胞,诱导产生非MHC限制的免疫应答,并能活化补体系统,促进多种细胞因子的释放,发挥抗肿瘤的作用[7-8]。此外,Hsp70可与树突状细胞(DCs)表面特异性受体结合,促进DCs的成熟,上调共刺激因子和MHC分子的表达,诱导产生抗原特异性细胞毒T细胞和Th1反应而发挥刺激宿主的免疫反应[9-10]。由于Hsp70在机体的抗肿瘤免疫反应中发挥着重要的作用,以Hsp70为基础的肿瘤基因治疗已成为近年来研究的热点。
腺病毒载体具有宿主范围广泛和对人体的低致病性、病毒颗粒比较稳定、基因组较少发生重排等优点,是目前最常用的基因治疗的载体之一。近年来,为了提高腺病毒介导基因治疗的效率,人们利用肿瘤细胞与正常细胞之间的某些生物学性状的差异,通过肿瘤细胞特异启动子调控目的基因的表达,构建了肿瘤靶向性重组腺病毒,如靶向肝癌的AFP启动子、靶向前列腺癌的PSA启动子等[11]。CEA在很多腺体肿瘤中大量表达,因此可作为肿瘤基因治疗比较广谱的分子靶标。多项研究表明,利用CEA启动子调控外源基因的表达可获得相对特异的肿瘤靶向作用,在提高肿瘤基因治疗疗效的同时,可控制基因表达的靶向性、降低其对正常细胞的毒副作用[12-13]。
本研究通过克隆人Hsp70基因和CEA启动子,将Hsp70基因置于CEA启动子控制之下,成功地构建重组腺病毒Ad5-pCEA-Hsp70。分别感染CEA阳性和阴性的肿瘤细胞系后,使重组腺病毒Ad5-pCEA-Hsp70在CEA阳性的细胞中特异性地表达目的基因Hsp70,为进一步利用Hsp70进行肿瘤的靶向治疗奠定了基础。
[1] Pockley AG.Heat shock proteins as regulators of the immune response.Lancet,2003,362:469-476.
[2] Ueda G,Tamura Y,Hirai I,et al.Tumor-derived heat shock protein 70-pulsed dendritic cells elicit tumor-specific cytotoxic T lymphocytes (CTLs) and tumor immunity.Cancer Sci,2004,95:248-253.
[3] Chan T,Chen Z,Hao S,et al.Enhanced T-cell immunity induced by dendritic cells with phagocytosis of heat shock protein 70 gene-transfected tumor cells in early phase of apoptosis.Cancer Gene Ther,2007,14:409-420.
[4] Bolhassani A,Rafat S.Heat-shock proteins as powerful weapons in vaccine development.Expert Rev Vaccines,2008,7:1185-1199.
[5] Richards CA,Austin EA,Huber BE.Transcriptional regulatory sequences of carcinoembryonic antigen:identification and use with cytosine deaminase for tumor-specific gene therapy.Hum Gene Ther,1995,6:881-893.
[6] Mambula SS,Calderwood SK.Heat shock protein 70 is secreted from tumor cells by a nonclassical pathway involving lysosomal endosomes.J Immunol,2006,177:7849-7857.
[7] Massa C,Melani C,Colombo MP.Chaperon and adjuvant activity of hsp70:different natural killer requirement for cross-priming of chaperoned and bystander antigens.Cancer Res,2005,65:7942-7949.
[8] Prohaszka Z,Singh M,Nagy K,et al.Heat shock protein 70 is a potent activator of the human complement system.Cell Stress Chaperones,2002,7:17-22.
[9] Somersan S,Larsson M,Fonteneau JF,et al.Primary tumor tissue lysates are enriched in heat shock proteins and induce the maturation of human dendritic cells.J Immunol,2001,167:4844-4852.
[10] Bachleitner-Hofmann T,Strohschneider M,Krieger P,et al.Heat shock treatment of tumor lysate-pulsed dendritic cells enhances their capacity to elicit antitumor T cell responses against medullary thyroid carcinoma.J Clin Endocrinol Metab,2006,91:4571-4577.
[11] Chu RL,Post DE,Khuri FR,et al.Use of replicating oncolytic adenoviruses in combination therapy for cancer.Clin Cancer Res,2004,10:5299-5312.
[12] Tanaka T,Huang J,Hirai S,et al.Carcinoembryonic antigen-targeted selective gene therapy for gastric cancer through FZ33 fiber-modified adenovirus vectors.Clin Cancer Res,2006,12:3803-3813.
[13] Mori F,Giannetti P,Peruzzi D,et al.A therapeutic cancer vaccine targeting carcinoembryonic antigen in intestinal carcinomas.Hum Gene Ther,2009,20:125-136.
2011-01-14)
(本文编辑:吕芳萍)
Constructionandidentificationofrecombinantadenoviruscontainingheatshockprotein70genedrivenbycarcinoembryonicantigenpromoter
SUNYun-liang,XUCan,SUChang-qing,GAOJun,JINJing,WUHong-yu,LIZhao-shen.
DepartmentofGastroenterology,ChanghaiHospital,SecondMiltaryMedicalUniversity,Shanghai200433,China
LIZhao-shen,Email:zhsli@81890.net
ObjectiveTo construct the recombinant adenovirus containing heat shock protein70 (Hsp70) gene driven by carcinoembryonic antigen (CEA) promoter.MethodsHsp70 gene and CEA promoter were amplified by RT-PCR and PCR, and then subcloned into the shuttle vector pDC316 to construct the recombinant vector PDC316-pCEA-Hsp70. The recombinant vector was co-transfected with adenoviral backbone plasmid into HEK293 cells to generate the recombinant adenovirus Ad5-pCEA-Hsp70. The recombinant adenovirus was purified by CsCl banding and titrated by 50% tissue culture infective dose (TCID50) assay. After transfection of the recombinant adenovirus into human pancreatic cell lines SW1990 and BxPC3, the expression of mRNA and protein level of Hsp70 were determined by RT-PCR and ELISA, respectively.ResultsDigestion and DNA sequencing certified that the Hsp70 gene and CEA promoter was successfully inserted into pDC316 plasmid. Virus acquired through co-transfection with backbone plasmid was confirmed to be constructed successfully by PCR amplification. The particles finally expressed was 2.2×1011vp/ml, and the titer was 1.5×1010PFU/ml. BxPC3 cancer cells with positive CEA expression showed increased expression of Hsp70 mRNA and protein after infected by recombinant adenovirus; while SW1990 cancer cells with negative CEA expression showed no change of expression of Hsp70 mRNA and protein after infected by recombinant adenovirus.ConclusionsThe recombinant adenovirus Ad5-pCEA-Hsp70 which can express Hsp70 gene in CEA positive cancer cells is constructed successfully.
Recombination,genetic; Heat shock protein 70; CEA promoter; Adenoviruses
10.3760/cma.j.issn.1674-1935.2011.04.007
国家青年科学基金(30801106)
210043 上海,第二军医大学长海医院消化内科(孙运良、徐灿、高军、金晶、吴红玉、李兆申);第二军医大学东方肝胆外科医院分子肿瘤研究室(苏长青)
李兆申,Email:zhsli@81890.net
