亚麻下胚轴对卡那霉素及膦化麦黄酮的敏感浓度筛选
2011-11-18贾婉琪郝冬梅邱财生等
贾婉琪 郝冬梅 邱财生等


摘要:在亚麻(Linum usitatissimum L.)高效再生体系建立的基础上,以亚麻栽培品种派克斯(L.usitatissimum cv. Pax)、中亚2号(L. usitatissimum cv. Zhongya No.2)和华星009(L.usitatissimum cv. Huaxing 009)为材料,研究了不同浓度的卡那霉素(Kanamycin,Kan)和膦化麦黄酮(Phosphinothricin,PPT)对亚麻下胚轴分化和生长的影响。结果表明,在亚麻遗传转化早期选择时,50 mg/L的Kan或1.5 mg/L的PPT能够完全抑制亚麻下胚轴的分化,是适宜的筛选浓度。
关键词:亚麻;组织培养;遗传转化;卡那霉素;膦化麦黄酮
中图分类号:S563.2;S503.53文献标识码:A文章编号:0439-8114(2011)16-3412-04
Selection of Susceptive Concentration of Kanamycin and Phosphinothricin
in Linum usitatissimum L. Hypocotyl
JIA Wan-qi,HAO Dong-mei,QIU Cai-sheng,GUO Yuan,DENG Xin,LONG Song-hua,
CHEN Xin-bo,WANG Yu-fu
(Institute of Bast Fiber Crops,the Chinese Academy of Agricultural Sciences, Changsha 410205, China)
Abstract: The influence of different concentrations of Kanamycin (Kan) and phosphinothricin (PPT ) on the differentiation and growth of Linum usitatissimum L. hypocotyl was studied using L. usitatissimum cultivars L. usitatissimum cv. Pax, L. usitatissimum cv. Zhongya No.2 and L. usitatissimum cv. Huaxing 009 as materials on the basis of efficient regeneration system. Results showed that 50 mg/L Kan or 1.5 mg/L PPT could totally inhibit differentiation of L. usitatissimum hypocoyl in early selection. It was the appropriate concentration.
Key words: Linum usitatissimum L.; tissue culture; genetic transformation; Kanamycin; phosphinothricin
亚麻(Linum usitatissimum L.)是亚麻科亚麻属一年生草本植物,也是农业上古老的韧皮纤维作物和油料作物。早在5000多年前古埃及就已经开始种植亚麻,并用其纤维织布,现代从古墓中出土的木乃伊就是用亚麻布包裹的。亚麻纤维具有拉力强、细度好、柔软、导电弱、吸水散水快、膨胀率大等特点,可纺高支纱,是制作高档服装的高级衣料,亚麻纺织品以其独特的品质深受广大消费者的青睐。但亚麻种子作为保健食品及医药原料的深度开发才刚刚开始,我国亚麻纤维又严重短缺,因此发展亚麻产业具有广阔的前景。
随着分子生物学技术和基因工程的不断发展,转基因技术逐渐成为培育亚麻优良品种的新途径。近年来,亚麻的遗传转化取得了一定的进展[1-9],如何从转化群体中快速、有效地筛选出含有外源目的基因的转化体是成功获得转基因植株的关键。目前,应用于亚麻的转化体筛选方法包括抗生素筛选、除草剂筛选[10,11]、甘露糖(Mannose)筛选[12]和β-葡萄糖苷酸酶(β-glucuronidase,GUS)染色反应筛选等数种,其中以抗生素筛选和除草剂筛选应用最多。不同植物、不同外植体对筛选剂的敏感性不同,探讨亚麻体细胞对筛选剂的最适筛选浓度对亚麻的遗传转化具有重要的意义。试验采用3个亚麻品种的下胚轴作为材料,研究其对卡那霉素(Kanamycin,Kan)和除草剂的有效成分膦化麦黄酮(Phosphinothricin,PPT)的敏感性,以期為亚麻遗传转化提供理论依据和试验指导。
1材料与方法
1.1材料
1.1.1亚麻外植体的获得供试亚麻品种为派克斯(L. usitatissimum cv. Pax)、中亚2号(L. usitatissimum cv. Zhongya No.2)、华星009(L. usitatissimum cv. Huaxing 009)。选择饱满度好、有光泽的亚麻种子,分别用75%的乙醇浸泡3 min,再用0.1%的升汞溶液浸泡4 min,去离子水冲洗4遍,无菌滤纸稍微吸干后接种于MS(无激素添加)培养基上。25 ℃±2 ℃条件下,先暗培养5 d,再转为每天16 h光照继续培养3 d。将萌发后的亚麻下胚轴部分切成0.5~0.8 cm长的小段,作为后续试验的外植体。
1.1.2筛选剂硫酸卡那霉素(Kanamycin sulfate)购自北京鼎国生物有限公司;除草剂有效成分物膦化麦黄酮由捷克科学院植物分子生物学研究所惠赠。
1.1.3培养基①种子萌发培养基为MS(无激素添加);②出愈和分化培养基为MS+6-BA 1 mg/L+NAA 0.02 mg/L。以上培养基均添加30 g/L的蔗糖和7 g/L的琼脂,调节pH=5.8,常规方法灭菌。
1.1.4试验方法先将准备好的下胚轴切段置于无筛选剂的培养基②上进行2 d的恢复培养。再分别把所需质量浓度的卡那霉素和膦化麦黄酮溶液经0.22 μm孔径过滤器除菌后加入到灭好菌的培养基②中。卡那霉素设5个浓度处理,分别是0 mg/L(CK1)、25 mg/L(K1)、50 mg/L(K2)、75 mg/L(K3)、100 mg/L(K4);膦化麦黄酮设6个浓度处理,分别是0 mg/L(CK2)、0.25 mg/L(P1)、0.50 mg/L(P2)、1.00 mg/L(P3)、1.50 mg/L(P4)、2.00 mg/L(P5)。每个培养皿中接种10块外植体,每处理设3次重复。外植体培养温度为25 ℃±2 ℃,每天光照16 h。两周后更换一次新鲜培养基,调查记录外植体生长情况。35 d后统计结果。
1.1.5数据处理培养一定时间后,统计各处理的不定芽分化率和外植体死亡率,不定芽分化率=(分化出不定芽的外植体数÷接种的外植体总数)×100%;外植体死亡率=(死亡的外植体数÷接种的外植体总数)×100%。
2结果与分析
2.1亚麻对卡那霉素的敏感性
卡那霉素是遗传转化中最常用的筛选剂,主要是通过破坏植物的光合作用系统而达到选择的目的。将预培养2 d后的下胚轴外植体置于不同浓度梯度的卡那霉素培养基上,结果显示,派克斯、中亚2号和华星009 3个亚麻品种对卡那霉素的反应基本相同。培养35 d后各处理的分化率和死亡率结果见表1。从表1可见,卡那霉素对亚麻愈伤组织的生长和分化都有明显的抑制作用,在不加卡那霉素的CK1培养基中,3个品种的亚麻下胚轴均能形成胚性愈伤组织,并分化出不定芽,愈伤膨大迅速,呈鲜绿色,不定芽健康且数量众多(图1)。
随着卡那霉素浓度的升高以及培养时间的延长,愈伤组织的生长受到明显的抑制,体积增大速度减慢。25 mg/L的卡那霉素处理就可对亚麻下胚轴不定芽的分化产生抑制作用,分化率明显降低,即使分化出个别零星小芽,也大多为不健康的黄白色或黄褐色芽体,下胚轴体积增长速度明显降低,培养35 d的下胚轴体积与培养14 d的相比有小幅增加;当卡那霉素浓度达到50 mg/L时,亚麻下胚轴体积稍有膨大,但基本不能分化,培养35 d后死亡率达到90%以上;卡那霉素浓度在75 mg/L以上时,愈伤组织完全不能生长,亦不能分化出芽,下胚轴全部白化死亡。从表1的结果中还可以发现,虽然参试品种对卡那霉素的反应基本相同,但50 mg/L处理的派克斯和中亚2号还存在极少数分化与存活的组织,而华星009已经完全死亡,说明不同基因型外植体对卡那霉素的敏感性不同,试验选取的3个品种中,华星009对卡那霉素最为敏感。因此在采用下胚轴作为亚麻遗传转化的外植体时,卡那霉素适合的筛选浓度约为50 mg/L。
2.2亚麻对膦化麦黄酮的敏感性
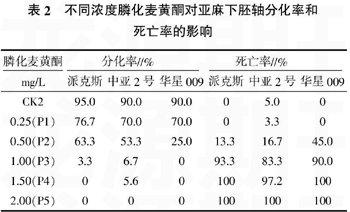
膦化麦黄酮是有机磷类除草剂的有效成分,如其是非选择性、广谱除草剂草丁膦(Basta)的活性成分。谷氨酰胺合成酶(GS)是植物中惟一的解毒酶,膦化麦黄酮强烈抑制了植物体内GS的活性,导致细胞内氨的大量积累,最终导致植物体死亡[13]。试验将恢复培养2d后的下胚轴接种到含不同浓度膦化麦黄酮的培养基上,结果显示,派克斯、中亚2号和华星009对膦化麦黄酮的反应基本相同。培养35 d后各处理的分化率和死亡率结果见表2。从表2可见,膦化麦黄酮对亚麻下胚轴愈伤组织的生长和分化都有抑制作用,当膦化麦黄酮浓度在0.25 mg/L时抑制作用不明显,外植体愈伤组织块生长旺盛,体积膨大,依然可以分化出鲜綠色的健康丛生芽,但与对照相比分化率有所降低;从0.50 mg/L开始,愈伤组织的生长量减少,体积逐渐变小,外植体颜色暗淡,出现褐色坏死组织(图2),不定芽分化率与对照相比有显著降低,分化出的不定芽极小且呈黄绿色,外植体的死亡率也大幅增加,其中对华星009的影响最为明显;当膦化麦黄酮浓度达1.00 mg/L时,虽然还有零星不定芽分化,但愈伤组织大部分都已褐化死亡;膦化麦黄酮浓度达到1.50 mg/L以上时,只在外植体两端切口处形成少量的黄褐色愈伤,且皱缩坏死,下胚轴中间部分干枯白化,外植体整体死亡。在3个参试品种中,对膦化麦黄酮最为敏感的品种仍然是华星009,当膦化麦黄酮浓度达到1.00 mg/L时,华星009就已无法分化出不定芽;对膦化麦黄酮最不敏感的品种是中亚2号,派克斯和华星009在1.50 mg/L的膦化麦黄酮处理下就完全死亡,而中亚2号还有极少数的存活。因此,在采用下胚轴作为亚麻遗传转化的外植体时,膦化麦黄酮适合的筛选浓度约为1.50 mg/L。
2.3亚麻下胚轴对卡那霉素与膦化麦黄酮的不同表现
由图1和图2可以看出,卡那霉素作用于亚麻的主要表现是使下胚轴整体不能生长且呈黄白色或黄褐色,亚麻对卡那霉素十分敏感,添加少量的卡那霉素(25 mg/L),外植体体积就显著小于对照;膦化麦黄酮作用于亚麻后,使下胚轴中间部分白化干枯,在切口两端膨大形成褐化愈伤且坏死,表现出了一定的极性。总体来看,膦化麦黄酮作用后的下胚轴体积较卡那霉素作用后的大,外植体的颜色、性状和生理状态也不尽相同,这可能与两种筛选剂的作用机理不同有关。但二者在亚麻的遗传转化中都能起到良好的筛选作用。
3讨论
在亚麻的基因转化中,如何使用适当的筛选标记准确、有效地区分转化与非转化细胞,是转化成功的重要环节之一。下胚轴是亚麻组织培养与遗传转化中最常用的外植体,卡那霉素和膦化麦黄酮又是最常使用的筛选剂。因此,了解亚麻下胚轴对这两种筛选剂的敏感性是十分必要的。试验通过研究派克斯、中亚2号和华星009这3个亚麻品种的下胚轴在含不同浓度的卡那霉素和膦化麦黄酮的培养基中的反应,确定了它们的筛选浓度,为亚麻的遗传转化试验提供了依据。
试验证明,卡那霉素和膦化麦黄酮对亚麻愈伤组织的诱导分化均有强烈的抑制作用,不利于亚麻的正常生长。高浓度下,亚麻下胚轴不能形成愈伤组织、不定芽,甚至完全死亡。虽然理论上筛选剂浓度越高选择效率也越高,但过高则会影响组织细胞的生长,反而不利于筛选。在亚麻的遗传转化过程中,卡那霉素浓度在50 mg/L、膦化麦黄酮浓度在1.5 mg/L时就能够抑制90%以上的非转化细胞生长分化,是适宜的早期筛选浓度。此外,不同的基因型对筛选剂的敏感性也不同,试验中华星009与其他两个品种相比,对筛选剂具有更高的敏感度。因此,本试验的研究结果为供试亚麻品种的遗传转化提供了技术操作依据,这可为大部分亚麻品种提供筛选剂浓度范围,但具体的使用浓度还要根据不同基因型和不同生长阶段进一步确定。
参考文献:
[1] 姬研茹,赵军,刘伟伟,等. 应用直接分化再生系统进行亚麻转基因技术的研究[J]. 生物技术通报,2008(1):128-132.
[2] 苑志辉. 兔防御素基因NP-1在亚麻抗枯萎病方面的研究[D]. 北京:中国农业大学,2005.
[3] 李博,黄丽华,蒋向,等. 薤白EPSP基因对亚麻的转化及检测[J]. 湖南农业大学学报(自然科学版),2010,36(1):12-16.
[4] 王玉富,康庆华,李希臣,等. 亚麻抗除草剂转基因的分子检测[J]. 中国麻业科学,2008,30(1):13-16.
[5] 王秀珍. 农杆菌介导的月见草Δ-6脂肪酸脱氢酶基因转化亚麻的研究[D]. 呼和浩特:内蒙古大学,2010.
[J]. Biologia Plantarum,1999,42(3):361-369.
[8] 康庆华. 亚麻转基因中抗生素应用效果的研究[J]. 中国麻业, 2005,27(2):94-97.
[9] 张志扬. 亚麻组织培养及高效遗传转化体系的建立[D]. 长沙: 湖南农业大学,2007.
[10] JORDAN M C,MCHUGHEN A. Glyphosate tolerant flax plants from Agrobacterium mediated gene transfer[J]. Plant Cell Reports,1988,7:281-284.
[11] MCHUGHEN A. Agrobacterium mediated transfer of chlorsulfuron resistance to commercial flax cultivars[J]. Plant Cell Reports,1989,8:445-449.
[12] LAMBLIN F,AIM?魪 A,HANO C,et al. The use of the phosphomannose isomerase gene as alternative selectable marker for Agrobacterium-mediated transformation of flax(Linum usitatissimum)[J]. Plant Cell Reports,2007,26:765-772.
[13] 段发平,梁承邺,黎恒庆. Bar基因和转Bar基因作物的研究进展[J]. 广西植物,2001,21(2):166-172.
