3055例犬瘟热病例分析及高免全血的疗效观察
2011-11-15郑曙光邵卫国陈荣卿王利渤张军伟公安消防部队东营搜救犬培训基地山东东营257000
郑曙光 邵卫国 陈荣卿 王利渤 张军伟 (公安消防部队东营搜救犬培训基地 山东 东营 257000)
3055例犬瘟热病例分析及高免全血的疗效观察
郑曙光 邵卫国 陈荣卿 王利渤 张军伟 (公安消防部队东营搜救犬培训基地 山东 东营 257000)
通过对山东、河南、陕西、河北、辽宁、黑龙江省等江北21家动物医院最近5年来确诊为犬瘟热病的3055例患犬的临床资料进行分析,认为患病犬与“多发于寒冷季节”的文献记载不同,近半数的病例集中于春末夏初;根据临床表现宜将犬瘟热病分为呼吸道型、消化道型、神经型、皮肤型和混合型5个主型,并宜分型施治。通过对盲设的6个治疗方案进行比较实验观察,结果表明,静脉输注高免全血的疗效肯定,犬瘟热病毒单克隆抗体次之,犬用干扰素、高免血清和免疫球蛋白的临床使用价值有待商榷。
犬瘟热 临床分析 高免全血 疗效比较
犬瘟热病毒(Canine distemper virus, CDV)引起的严重危害犬和毛皮动物的感染性疾病经常见于文献报道[1]。该病在犬群中的发病率可达30.7%[2],病死率通常波动在30%~80%之间,如有并发症和继发症时的死亡率可高达90%以上[3]。自1980年证实CDV在我国存在以来,包括病原学在内的多角度研究时有报道,其中实验室诊断技术创建了包涵体检查法[4,5],ELISA法检测CDV的IgM抗体[6],ELISA法检测CDV抗原[7],RT—PCR法测定CDV[8],以及酶标抗体技术与三维喷点系统技术相结合的产物--犬瘟热胶体金试纸。胶体金试纸现已在宠物临床上得到了应用,其快速检测CDV抗原的准确率可达85%以上。诊断技术的进步推动了预防和治疗方法的不断改进。尽管CD的免疫程序至今众说不一[9,10],但弱毒疫苗的高密度接种,无疑大大降低了CD的发生率。对于CD的治疗,从常规的对症支持疗法[11]、又渐次出现了高免血清疗法[12]、干扰素疗法[13]、免疫球蛋白疗法[14]、单克隆抗体疗法[15,16]、输血疗法[17.18.19]等等,但至今尚未见各种疗法的比较研究报告。笔者在对3055例确诊病例进行流行病学分析和临床分型的基础上,试设置6个治疗方案,于2005年12月到2010年12月间进行了临床疗效比较实验。
1 治疗方案
1.1 方案设计
1.1.1 对症支持(常规疗法)方案 根据临床分型和临床指证,按下述基本原则给药:(1)抗病毒药物:利巴韦林或阿昔洛韦、炎琥宁或穿琥宁等。(2)抗菌药物:防止继发感染,如阿奇霉素或红霉素、左氧氟沙星或恩诺沙星、头孢噻肟钠或头孢他啶钠等。(3)解热、抗炎药物:双黄连或清开灵注射液、氢化可的松或地塞米松注射液等。(4)生命支持药物:生理盐水、复方生理盐水、葡萄糖注射液、碳酸氢钠或乳酸钠注射液、低分子或小分子右旋糖酐、多巴胺或多巴酚丁胺、呋塞米或布美他尼、脂肪乳注射液、复方氨基酸注射液、维他利匹特、水乐维他冻干粉针、三磷酸腺苷、辅酶A、肌苷、细胞色素C、胰岛素等。(5)免疫增强药物:匹多莫德、聚肌胞、卡介苗、胸腺素、转移因子、左旋咪唑、刺五加、黄芪注射液等。(6)酌情(呼吸道型)给予镇咳、祛痰、平喘药:沙丁胺醇或特布他林、氨溴索或溴己新、氨茶碱或二羟丙茶碱、色甘酸钠或奈多罗米钠、酮替芬或曲尼司特等。应首选超声波雾化吸入方式给药。(7)酌情(消化道型)给予止吐药物:山莨菪碱或阿托品、甲氧氯普胺或西沙必利;溴米那普鲁卡因或地西泮、氯丙嗪或氟哌啶醇、维生素B6、杨氏止呕合剂等。(8)酌情(消化道型)给予止血药物:肾上腺色腙或酚磺乙胺、氨甲苯酸或维生素K3、葡萄糖酸钙或维生素C、杨氏止血合剂等。(9)酌情(消化道型)给予止泻药物:西米替丁或奥美拉唑、蒙脱石散或活性炭、金双歧或妈咪爱等。(10)酌情(神经型)给予镇静解痉药物:东莨菪碱或地西泮、氯化钙或硫酸镁、氯丙嗪或苯巴比妥、苯妥英钠或扑痫酮、吡拉西坦或安宫牛黄丸等。
1.1.2 加高免血清方案 在对症支持疗法的基础上加用高免血清。本试验选用吉林某单位制造的精制犬五联(包括犬瘟热、副流感、传染性肝炎、细小病毒和冠状病毒)血清,按2ml/kg体重剂量,肌肉(分点)注射,1次/d,连用3d。
1.1.3 加免疫球蛋白方案 在对症支持疗法的基础上加用免疫球蛋白。本试验选用北京某公司制造的犬血免疫球蛋白,按1ml/kg体重剂量,加入生理盐水中静脉滴注,1次/d,连用3d。
1.1.4 加单克隆抗体方案 在对症支持疗法的基础上加用单克隆抗体。本试验选用北京某公司生产的犬瘟热病毒单克隆抗体,按1ml/kg体重剂量,腹股沟内侧肌肉注射,1次/d,连用3d。
1.1.5 加单克隆抗体合并干扰素方案 在对症支持疗法的基础上同时加用单克隆抗体和干扰素。本试验选用的犬瘟热病毒单克隆抗体和犬用干扰素均为北京某公司的产品,而注射用重组犬干扰素α突变体冻干制剂,按50万IU/kg体重给予,肌肉注射,1次/d,连用3d。
1.1.6 加犬瘟热高免全血方案 在对症支持疗法的基础上加用高免全血。本试验使用的高免全血由山东爱佳宝贝动物医院总院提供。按8ml/kg体重剂量,加入等量或2倍量5%葡萄糖氯化钠注射液中,依体重大小酌情按20~60滴/min速度静脉滴注,隔日1次,连用3次。高免全血的制备:(1)对供血犬的基本要求。①年龄1岁左右,体重30kg以上,肥瘦适中,使用前必须去势或绝育。②最好选择灰猎犬,因该犬种普遍缺乏DEA1.1(A1)和DEA1.2(A2)两种血型。如无灰猎犬,也可选用土种犬或杂种犬,但最好选择DEA4(C)呈阳性而其他红细胞表面抗原为阴性的供血犬。③选择时应注意淘汰附红细胞体、埃利希体、利什曼原虫、巴贝斯虫、疏螺旋体、钩端螺旋体、布鲁氏杆菌、犬恶丝虫和蠕形螨等疑似感染的犬只。④供血犬的储备数量应根据临床需要酌情确定。(2)犬瘟热高免犬的准备。复合上述要求的供血犬应远离动物医院规范饲养,并严格按以下程序处理:①先肌肉注射小儿麻疹疫苗5人份(即2ml),间隔14d后再按10人份(即4ml)重复1次。②连续皮下接种犬多联弱毒疫苗(美国辉瑞公司制造的四联弱毒疫苗为首选)3次,1头份/次,间隔21d。③再按2、4、6、8、10头份的递增剂量肌肉接种犬多联弱毒疫苗,间隔14d/次。④分别按每次5、10、20、40、80ml的递增剂量肌肉分点注射CD强毒,间隔14d/次。⑤在最后一次强毒攻击14d后,采集少量血液分离血清,并用双向琼脂扩散试验法测定血清效价。当测得的血清效价≥1:16时,即认定该犬高免合格。⑥高免犬通常每21d采集血液1次,当连续采血3次后,应按80ml剂量肌肉注射1次CD强毒,以确保供血犬经常保持在高免状态。(3)高免全血的采集与保存。采血部位一般选择颈静脉。采血时必须按比例加入血液抗凝剂。抗凝剂宜选用枸橼酸葡萄糖合液(配方为:枸橼酸钠13.30g、枸橼酸4.70g、分析纯级葡萄糖30.00g、重蒸馏水加至1L,经0.053MPa高压蒸汽灭菌后备用),采血时按1:4比例加入血液中,即该抗凝剂25ml可使100ml血液不凝固。使用该抗凝剂采集的高免全血,在4℃条件下可保存21d不丧失血液活性。供血犬的采血量一般控制在15ml/kg体重,最多不超过20ml/kg体重,且以每间隔21d采血一次为宜。(4)供血犬与受血犬的血型相合试验。尽管对供血犬的血型预先进行了选择,但输血前的交叉配血试验也不宜省略。血型相合试验的方法很多,国外现已有犬血型检测板用于交叉配血,但本试验采用的还是较为传统的“三滴试验法”[20]。经本案1032例输血病例实际应用观察,尚未发现急性溶血等严重输血反应。
1.2 约束条件
1.2.1 病例选择的随机性 为了避免主观因素的影响,严格遵守了按临床就诊顺序选定不同疗法的随机性原则。
1.2.2 病例确诊的规范性 为了避免类似病例的干扰,做到了“临诊一致和死后确诊”的规范性。临诊时以流行病学、临床症状和胶体金试纸检测为建立诊断的依据;取死亡转归的病例,通过剖检、包涵体检查和接种鸡胚予以确认。
1.2.3 结果处理的科学性 本试验涉及的临床资料、流行病学资料和疗效比较实验数据,均按生物统计学规则进行了处理,其差异显著性检验采用t检验和方差分析法。
2 结果
2.1 6个治疗方案疗效的比较
结果见表1。从表中可以看出,CD的自然康复率为2.66%。6个治疗组与对照组比较均有差异显著性,而6个治疗组之间比较也存在差异。其中,方案6与其他5个治疗组比较差异极显著(P<0.01);方案5、4与方案3、2、1比较也有差异(P<0.05):但方案2与3以及方案4与5之间相比较均无差异显著性(P>0.05)。
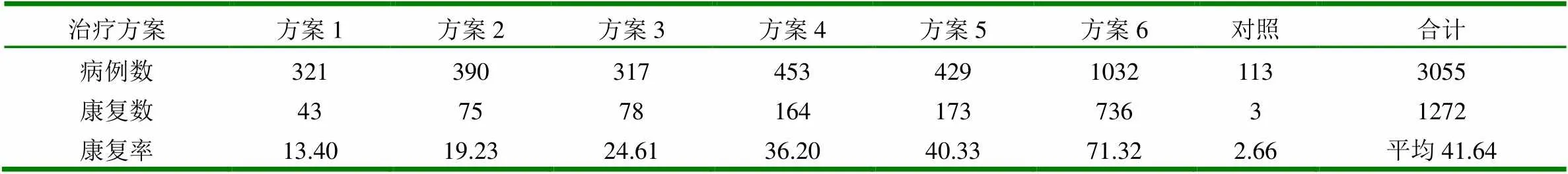
表1 6个治疗方案疗效的比较
2.2 高免全血对不同临床表现型病例的疗效
由表2可见,静脉输注高免全血对5种临床表现型病例的疗效很不一致,当与100%康复的皮肤型比较时,分别达到了1%、0.5%和0.1%的显著水平。其中,消化道型康复率达到91.26%,呼吸道型病例达到73.96%,均高于平均康复率的71.32%;如再联系该病临床型构成比,即相当于高免全血疗法能有效覆盖74.44%的病例。尽管该疗法对神经型和混合型病例的疗效不尽理想,但却明显降低了相对死亡率:即神经型病例的死亡率从88.52%降至59.78%,相对下降28.74%;混合型病例的死亡率从97.88%降至78.29%,相对下降19.59%,其死亡率下降水平也有一定显著性(P<0.05)。
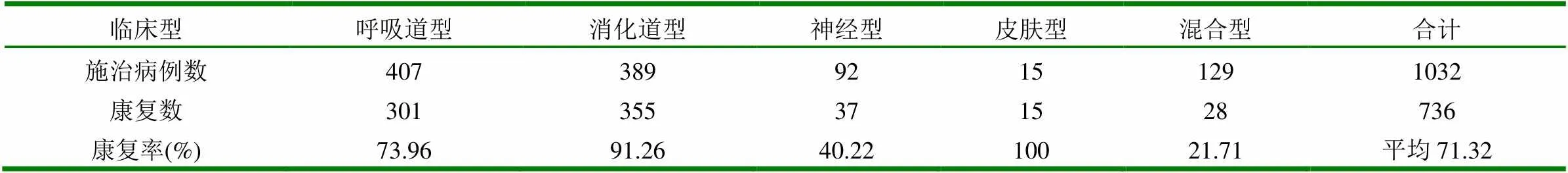
表2 静脉输注高免全血对不同临床表现型病例的疗效观察结果
3 讨论
3.1 3055例临床病例的分析
3055例CD确诊病例主要来源于山东爱佳宝贝动物医院总院和公安消防部队东营搜救犬培训基地,共涉及河南新乡、河北衡水、陕西咸阳、黑龙江佳木斯、辽宁鞍山和省内烟台、潍坊、淄博、泰安、聊城等21家宠物医院。病例的“确诊”,均以胶体金试纸检测呈强阳性且同时具备CD流行病学和临床表现特点为主要依据,并排除接种弱毒疫苗15d以内胶体金试纸检测显示阳性结果的病例。现将流行病学资料和临床特点归纳描述如下。
3.1.1 与年龄的相关性
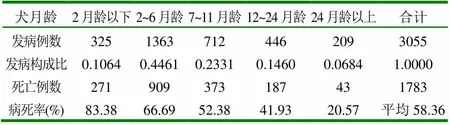
表3 发病、病死几率与年龄的关系
由表3可见,2~6月龄内的犬发病率最高,占44.61%;而2岁龄以上的犬则很少发病,仅为6.84%。但病死率2月龄以下的幼犬最高,高达83.38%;而伴随着年龄的增长,其病死率渐次降低,2岁龄以上的成年犬仅为20.57%。
3.1.2 与季节的相关性

表4 发病几率与季节的关系
由表4可见,犬瘟热主要发生于春季,患病比例占全年的48.81%;秋冬季次之,而夏季较少发病。
3.1.3 与品种的相关性

表5 发病几率与品种的关系
由表5可见,纯种犬和军警用犬的发病率明显高于杂种犬和土种犬。但统计数字不能排除某些犬种因经济价值和观赏价值低而减少就诊比率的影响。
3.1.4 与免疫状态的相关性

表6 发病率与免疫状态的关系
由表6可见,未免疫犬的发病构成比高达76.60%,而按程序防疫的犬只仅为3.37%。表中所称不规范接种疫苗,一般指有疫苗接种史但未按规范程序免疫的犬只。
3.1.5 与临床表现型的相关性 按杨清尧先生2004年提出的临床分型方法[1],将3055个CD病例分为呼吸道型、消化道型、神经型、皮肤型和混合型5个临床表现型,并对各型的发生比率和病死亡率作了统计学处理。结果见表7。

表7 发病、病死几率与临床表现型的关系
从表7可以看出,呼吸道型和消化道型的发生率较高,与其它各型比较有差异显著性(P<0.05),而皮肤型最低,发生比率仅占2.59%。混合型和神经型的死亡率较高,与其它型比较分别达到了5%、1%的差异显著水平。但皮肤型和消化道型的死亡率则相对较低。
3.2 疗效分析
(1)在动物医院内往往将CD称为“1号病”,本文揭示的自然康复率为2.66%。通过3055个CD临床病例的调查统计,2~6月龄犬、纯种犬和军警用犬多发,以及疫苗保护效果明显等结果,与文献记载基本吻合。但病例相对集中于春末夏初的数据却有悖于“多发于寒冷季节”的文献描述[2]。笔者分析,这种相异性可能与诸如犬展等引起犬只迁徙的社会活动多数集中于春季有关。(2)对CD快速建立诊断早已变成现实。对于宠物医师来说,实验室诊断结果只是为“看病”提供参考。犬瘟热病的发生、发展乃至转归是一个复杂多变的过程,仅从类似“感冒”的前期表现发展到具有分型意义的典型症状出现就充满了很多变数。比如某些试纸显示强阳性的病例,可能仅仅用对症支持疗法就能转危为安;而有些试纸呈弱阳性反应的犬只,可能无效。从某种程度上说,及早发现并确定CD的临床表现型可能比试纸显示的结果更具临床价值。因为临床分型不仅有利于分型施治,也有利于预后的判断。比如呼吸道型和消化道型补液的质与量就明显不同,而混合型和神经型的预后则多不良等等。本案揭示呼吸道型、消化道型、神经型、皮肤型和混合型的构成比分别为39.80%、32.05%、11.68%、2.59%和13.88%,此结果与杨清尧先生2004年的估测值基本吻合。至于CD临床分型的原则和指证,请参阅相关文献[1]。(3)近年来,CD的防治措施文献记载较多,但概括起来可归纳为对症支持疗法、特异性疗法、非特异性疗法、中兽医学疗法,以及主动免疫和被动免疫构筑的防线等等[21~23]。对于这些防治方法,曾反复做过临床验证,几乎都难以复制文献描述的结果。正是有鉴于此,笔者在研究完善CD免疫程序的同时,又借鉴各种治疗方法的主要优点,提出了将抗体疗法与输血疗法合二为一的治疗新思路,并于2005年设计并进行了六种疗法的比较试验。结果表明,静脉输注高免全血对确诊犬瘟热病例的治愈率达到71.32%,明显好于其它疗法,故笔者认为该疗法值得在临床上推广应用。(4)输血疗法是宠物临床上的常规治疗方法之一。近年来,将输血疗法用于CD治疗并取得一定疗效的报道较多[17~19],其临床价值应当予以肯定。输血疗法的技术关键在于“血型相合”。迄今为止,已经发现的犬血型即红细胞表面抗原(DEA)有13种,其中研究明晰的主要有8种,即DEA1.1(A1)、DEA1.2(A2)、DEA3(B)、DEA4(C)、DEA5(D)、DEA6(F)、DEA7(Tr)和DEA8 (He)。其中对输血具有意义的主要是单数血型DEA1.1 (A1)、DEA1.2(A2)和复数血型DEA3(B)、DEA5(D)、DEA7(Tr)五种血型。有人曾报道,德国牧羊犬A1血型阳性率高达87.5%,苏格兰牧羊犬为83.33%;京巴犬A2血型阳性率高达77.14%,雪纳瑞犬为71.42%。由此可见,A1和A2血型在犬群中的分布是非常广泛的,就是A1和A2这两种血型呈阴性是对供血犬提出的基本要求,当然也是高免全血疗法能否安全、有效的关键环节。因此,如欲实施静脉输注高免全血疗法,就必须具有符合血型要求的供血犬和相应的犬血型检测系统。这些限制条件可能会影响到高免全血疗法的普及应用。(5)输血与输注高免全血是有本质区别的,就像吸吮初乳与常乳作用不同相类似。高免全血中不仅含有血液中的有形成分,体现输血的基本功效;更重要的是血浆中含有强化免疫后产生的相应抗体,能呈现凝集、沉淀、中和、调理抗原(即病毒)的复杂作用。从免疫学角度讲,高免全血血浆中所含有的抗体与高免血清、免疫球蛋白、甚至单克隆抗体没有本质区别,其活性成分主要是IgG。临床使用结果差异显著,除了“1+1≥2”的解释外,笔者很难给出其它合理的解释。至于干扰素,因目前使用的制剂多为干扰素诱生剂,其非特异性防御效果不佳是无可厚非的。(6)本试验过程中,曾用高免全血对犬细小病毒、犬传染性肝炎、犬副流感等感染性疾病进行过治疗试验,均呈现出良好的治疗效果,这可能与高免犬的先期免疫均以多联弱毒疫苗为免疫原有关。高免犬用多头份多联弱毒疫苗来维系高免状态(即不用CD血毒),然后取全血用于包括CD在内的多种感染性疾病的治疗,也取得了较好的近期疗效。但由于这方面的病例积累不多,故很难作出肯定或者否定的结论。
[1] 杨清尧, 张军伟等. 犬常见感染性疾病及其防治[J]. 现代畜牧, 2004(6): 32-35.
[2] 中国农业科学院哈尔滨兽医研究所.动物传染病学[M]. 北京: 中国农业出版社, 1999: 489-492.
[3] 杨红军等. 犬瘟热的门诊调查研究[J]. 四川畜牧兽医, 2004,31(9): 34-3.5
[4] 陈培富, 郭爱珍, 陆承平. 犬瘟热病毒南京分离株的生物学特性鉴定[J]. 中国兽医学报, 2000, 20(3): 231-234.
[5] 房红莹, 陆承平, 马勋. 犬瘟热的微生物学诊断研究[J]. 中国兽医学报, 1997, 17(2): 148-151.
[6] Waner T,Mazar S,Keren-Kornblatt E,et a1.Evaluation of a dot ELISA kit for measuring immunoglobulin Mantibodiestocanine parvovirus and distempervirus. Vet Rec, 2003, 152(19): 588-591.
[7] 金鑫, 鲁承, 吕相哲等. Dot-ELISA检测犬瘟热病毒抗原的研究[J].中国兽医科技, 2000, 30(6): 21-23.
[8] 李金中, 何洪淋, 夏咸柱等. 犬瘟热病毒反转录一聚合酶链式反应诊断方法的建立和初步应用[J]. 病毒学报, 1999, 15(2): 180-184.
[9] 何洪彬, 夏咸柱. 犬瘟热的诊断及其预防免疫的研究进展[J]. 动物医学进展, 2001, 22(1): 12-14.
[10] 刘雄伟, 沈志敏, 邵伟娟. 犬三种病毒疫苗对实验犬的保护效价的测定[J]. 实验动物与比较医学, 2005, 25(2): 113-114.
[11] 高得仪. 犬猫疾病学[M]. 第2版. 北京: 中国农业大学出版社, 2001: 16-20.
[12] 刘江帆, 李智新等. 抗犬病高免血清配合对症疗法治疗犬瘟热病的疗效观察[J]. 湖南畜牧兽医, 2006(1):20-21.
[13] 刘佩伏. 应用干扰素治疗犬瘟热效果好[J]. 北方牧业, 2007(12): 27.
[14] 迟立超等. 静脉注射用犬血免疫球蛋白在犬瘟热病防治中的临床应用[D]. 中国畜牧兽医学会第四次学术研讨会论文集(2), 2009.
[15] 陈万荣等. 抗犬瘟热病毒单克隆抗体的制备及初步应用[J]. 中国兽医学报, 2002, 22(5): 455-456.
[16] 周洁等. 抗犬瘟热病毒重组核衣壳蛋白单克隆抗体的制备及鉴定[J]. 中国预防兽医学报, 2007, 29(7): 528-532.
[17] 李鹏等. 输血疗法在犬瘟热治疗中的应用[J]. 中国畜牧兽医, 2006, 33(9): 9-12.
[18] 李义春等. 输血疗法在犬临床中的应用[J]. 黑龙江畜牧兽医, 2002(7): 37.
[19] 郭永久等. 犬的输血疗法[J]. 中国工作犬业, 2006(5): 21-22.
[20] 安丽英. 兽医实验诊断[M]. 北京: 中国农业大学出版社, 2000: 67-72.
[21] 黄淑禧. 犬瘟热的防治[J]. 福建畜牧兽医, 2002, 24(1): 23.
[22] 李永生等. 中西医结合治疗犬瘟热[J]. 畜牧兽医杂志, 2007(10): 109-110.
[23] 胡延春等. 清瘟败毒散治疗犬瘟热[J]. 黑龙江畜牧兽医, 2007(7): 98-99.
(2011–05–24)
S858.292
A
1007-1733(2011)06-0008-04
