高效液相色谱-串联质谱法测定减肥保健食品中非法添加药物苯佐卡因
2011-11-14代汉慧张英春陈冬东王海波柳彩云王秀君唐英章
马 微,代汉慧,张英春,陈冬东,王海波,柳彩云,王秀君,唐英章
(1.黑龙江出入境检验检疫局,黑龙江哈尔滨150086;2.中国检验检疫科学研究院,北京100123;3.哈尔滨工业大学食品科学与工程学院,黑龙江哈尔滨150090)
高效液相色谱-串联质谱法测定减肥保健食品中非法添加药物苯佐卡因
马 微1,代汉慧2,张英春3,陈冬东2,王海波1,柳彩云2,王秀君2,唐英章2
(1.黑龙江出入境检验检疫局,黑龙江哈尔滨150086;2.中国检验检疫科学研究院,北京100123;3.哈尔滨工业大学食品科学与工程学院,黑龙江哈尔滨150090)
建立了测定减肥保健食品中非法添加药物苯佐卡因的高效液相色谱-串联质谱分析方法。减肥咖啡、减肥茶、减肥胶囊、减肥片剂、减肥饼干等不同类型的减肥保健食品经超声萃取后,以Waters Atlantis T3柱(150mm×2.1mm,3μm)分离后,采用多反应监测(MRM)正离子模式检测,定性离子对为m/z166与m/z138和m/z166与m/z94,采用m/z166与m/z138进行定量。实验结果表明,苯佐卡因在0.01~50μg/L的范围内呈良好的线性关系,相关系数为0.9985,在低、中、高的3个添加水平范围内的平均回收率为69.3%~95.6%。同时研究了苯佐卡因的电喷雾电离质谱特征,推测其裂解途径。本方法灵敏度高,操作简便,可用于不同减肥保健食品中非法添加苯佐卡因的检测。
高效液相色谱-串联质谱,超声萃取,苯佐卡因,质谱裂解途径
苯佐卡因是一种非中枢性的食欲抑制药,分子式为C9H11NO2,其分子结构如图1所示。它可以使口腔及肠胃黏膜麻木,通过影响味觉来抑制食欲,从而达到减肥的功效。然而,一些不法厂商为了追求疗效,在减肥保健食品中添加了这种药物,长期服用苯佐卡因会带来很大不良反应,美国FDA报道了苯佐卡因容易引起高铁血红蛋白血症,且有报道该药可使过敏体质患者发生局部或全身性的过敏反应[1]。因此,迫切要求建立一种标准检验方法对减肥保健食品中的非法添加药物苯佐卡因进行监督和控制。对于减肥保健食品中苯佐卡因的检测方法,目前尚无国家标准,国内外公开报道的紫外分光光度法[2-3]、化学发光法[4]、气相色谱法[5]和高效液相色谱法[6-10]等,主要针对药物制剂、体液和组织中的检测,没有报道在食品中的检测,且没有通过质谱方法进行确证研究。本实验针对不同基质的减肥保健食品,采用超声波萃取技术进行提取,利用串联四极杆质谱的高选择性、高灵敏度的优势,建立了减肥保健食品中苯佐卡因的的高效液相色谱-串联质谱分析方法。
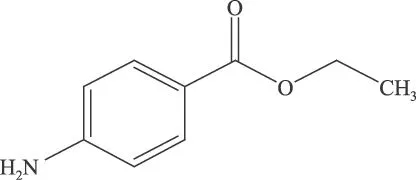
图1 苯佐卡因的化学结构式
1 材料与方法
1.1 材料与仪器
苯佐卡因 德国Dr Ehrenstorfer Gmbh;甲醇HPLC级,美国Fisher公司;氮气、氩气 >99.999%;实验用水 经Milli-Q净化系统(0.22μm过滤膜)过滤的去离子水;其它试剂 均为分析纯,北京化工厂。
ACQUITY超高效液相色谱议、XEVO三重四级杆质谱仪、Waters micromass四极杆飞行时间高分辨质谱仪、MassLynx数据处理系统 美国Waters公司;KQ-600B型超声波清洗器 昆山市超声仪器有限公司;MS2型漩涡振荡器 德国IKA公司;Milli-Q超纯水器 美国 Millipore公司;Acrodisc GHP双性滤膜 美国Pall公司。
1.2 实验方法
1.2.1 色谱条件 Waters Atlantis T3柱(150mm× 2.1mm,3μm);流动相:甲醇∶水,梯度洗脱:0~8min,20%~95%甲醇;8~9min,95%~20%甲醇;9~12min,20%甲醇;流速0.2mL/min,柱温30℃;样品室温度20℃;进样量为5μL。
1.2.2 三重四极杆质谱条件 电喷雾离子源;正离子扫描;毛细管电压3.5kV;射频透镜电压0.5V;离子源温度150℃;去溶剂气温度500℃;去溶剂气流量800L/h;锥孔气流量50L/h;光电倍增器电压650V;碰撞气体为氩气,碰撞气压2.8×10-4Pa,多反应监测(MRM)模式检测,质谱分析参数见表1。

表1 苯佐卡因的质谱分析参数
1.2.3 四极杆-飞行时间高分辨质谱条件 电喷雾离子源(ESI);采用正离子模式检测;毛细管电压3.0kV;离子源温度100℃;去溶剂气温度350℃;去溶剂气流量600L/h;锥孔气流量50L/h;碰撞气体为氩气;微通道板电压1800V,每0.1s采集一次谱图,质量扫描范围m/z100~500。
1.2.4 标准溶液的配制 精密称取苯佐卡因10.0mg,用甲醇溶解并稀释,配制成浓度为1.0g/L的标准储备溶液,-18℃冰箱保存备用。临用时,用甲醇稀释上述标准储备溶液,配制成不同浓度的标准工作液。
1.2.5 样品制备 精密称取不同减肥保健食品试样0.5g置于25mL比色管中,准确加入25.0mL甲醇,涡旋混匀,超声提取15min后,过0.22μm有机微孔滤膜后上机测定。
2 结果与讨论
2.1 色谱条件的优化
本实验首先比较研究了甲醇∶水、乙腈∶水以及加入0.1%、0.2%甲酸,5、10mmol/L乙酸铵等二元溶剂体系作为流动相时,苯佐卡因的仪器响应信号和色谱峰形选择性,结果表明甲醇-水为流动相时苯佐卡因的质谱响应信号较高。又进一步比较研究了等度洗脱和梯度洗脱对苯佐卡因色谱峰形的影响,结果表明梯度洗脱获得了最优的色谱分离效果,且得到基线平稳、对称、尖锐的峰形,如图2所示。

图2 苯佐卡因的MRM图
2.2 质谱条件的优化及裂解规律的研究
选用ESI+作为离子化模式,采用流动注射泵连续进样方式进行质谱条件的优化。对苯佐卡因的标准溶液进行四极杆-飞行时间质谱仪二级谱图(见图3)分析,苯佐卡因(m/z166)的二级质谱碎片主要有m/z138、120、94、177。根据欧盟2002/657/EC指令规定对于质谱确证方法必须达到4个确证点的要求,低分辨液相色谱-质谱联用仪检测应在确定母离子的基础上选择两个以上的子离子[11]。选择离子丰度高、基线噪音低的离子对 m/z166和 m/z138,m/z166和m/z94做为监测离子对(定性离子),选择离子丰度最高的m/z166和m/z138做为定量离子。

图3 苯佐卡因的二级质谱图
根据苯佐卡因的二级质谱图和电离喷雾电离的特点,推测出质谱裂解规律,如图4所示。由于分子离子m/z166受羰基氧原子的作用,易在酰基处发生断裂,生成丰度最高的碎片离子m/z138;由于电离喷雾这种软电离技术容易丢失中性小分子,如:H2O、CO2等[12],离子m/z138脱掉一分子CO2生成碎片离子m/z94;也可以脱掉一分子H2O生成碎片离子m/z120;随着碰撞能量的加大,离子m/z94脱掉侧链NH3生成碎片离子m/z77。

图4 苯佐卡因的质谱裂解途径
2.3 基质效应
电离喷雾离子化效率容易受样品基质的影响。本实验用离子抑制率,即基质空白中添加监控离子响应强度比标准溶液中相应监控离子响应强度减少的百分比,来表述样品基质对监控离子响应强度的抑制作用,结果见表2。以减肥咖啡、减肥茶、减肥胶囊、减肥片剂、减肥饼干等为基质空白,分别添加1.0mg/kg苯佐卡因标准品,与1.0mg/kg苯佐卡因标准品比较,进行监控离子抑制率实验。结果发现在减肥咖啡、减肥茶中由于存在大量的多酚和碱类物质等成分而对苯佐卡因电喷雾离子化效率有一定的干扰,因此,对于减肥咖啡、减肥茶的样品需要在其基质上配制标准曲线。
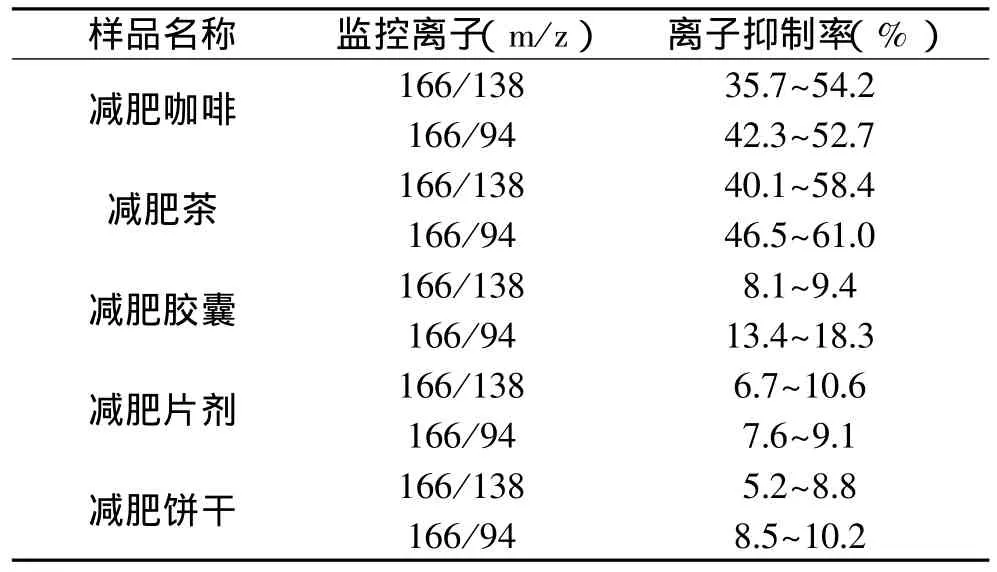
表2 不同样品基质对苯佐卡因的抑制作用
2.4 标准工作曲线和线性范围
在选定的色谱条件和质谱条件下对一系列标准工作溶液分别进样5μL,平行测定3次。以苯佐卡因的峰面积(Y)为纵坐标,苯佐卡因的质量浓度(X)为横坐标进行回归分析,由实验得出苯佐卡因在质量浓度0.01~50μg/L的范围内呈线性关系,回归方程为Y=26836.7X-3018.82,相关系数为0.9985,逐级稀释苯佐卡因标准溶液,以10倍信噪比为基准,仪器的定量限(LOQ)为0.03μg/L,以信噪比为3估算检出限(LOD)为0.01μg/L。

表3 不同基质减肥保健品中苯佐卡因添加回收率结果(n=6)
2.5 添加回收率实验
回收率实验针对减肥咖啡、减肥茶、减肥胶囊、减肥片剂、减肥饼干等不同类型的减肥保健食品设定了3个添加浓度,每个浓度进行6次重复,结果见表3。
2.6 样品测定
应用本方法对30种不同基质类型减肥保健食品进行了分析测定,均未检出含有苯佐卡因。
3 结论
本文建立了不同基质类型的减肥保健食品中非法添加苯佐卡因的准确定性和定量检测方法。该方法前处理简便、不需浓缩、结果准确,符合现代分析技术的发展趋势。
[1]孙玉,沈良骏.苯佐卡因高分子载体药物及其纳米微球的合成[J].合成化学,2007,15(3):382-384.
[2]Paschoal L R,Ferreira W A.Simultaneous determination of benzocaine and cetylpiridinium chloride in tablets by firstderivative spectrophotometric method[J].Farmaco,2000,55(11):687-693.
[3]Manuel Carmona,Manuel Silva,Dolores Pérez-Bendito.A selective and sensitive kinetic method for the determination of procaine and benzocaine in pharmaceuticals[J].Pharmaceutical and Biomedical Analysis,1992,10(2):145-152.
[4]Hana Paseková,Miroslav Poláek.Determination of procaine,benzocaine and tetracaine by sequential injection analysis with permanganate-induced chemilumi-nescence detection[J]. Talanta,2000,52(1):67-75.
[5]Thomas A B,Nuray Asral,Joseph A.Simultaneous,stabilityindicating capillary gas chromatographic assay for benzocaine and the two principal benzyl esters of Balsam Peru formulated in a topical ointment[J].Chromatography A,1992,623(2):395-398.
[6]Sadana G S,Ghogare A B.Simultaneous determination of chloramphenicol and benzocaine in topical formulations by highperformance liquid chromatography[J].Chromatography A,1991,542(2):515-520.
[7]Pérez-Lozano P,García-Montoya E,Orriols A,et al.A new validated method for the simultaneous determination of benzocaine,propylparaben and benzyl alcohol in a bioadhesive gel by HPLC[J].Pharmaceutical and Biomedical Analysis,2005,39(5):920-927.
[8]Annamaria Szoke,William L Hayton,Irvin R,et al. Quantification of benzocaine and its metabolites in channel catfish tissues and fluids by HPLC[J].Pharmaceutical and Biomedical Analysis,1997,16(1):69-75.
[9]Jeffery R Meinertz,Guy R Stehly,Terrance D Hubert,et al. Liquid chromatographic determination of benzocaine and N-acetylbenzocaine in the edible fillet tissue from rainbow trout[J]. Chromatography A,1999,855(1):255-260.
[10]Bárbara Gigante,Ana M V Barros,Adriano Teixeira,et al. Separation and simultaneous high - performance liquid chromatographic determination of benzocaine and benzyl benzoate in a pharmaceutical preparation[J].Chromatography A,1991,549(1):217-220.
[11]Commission of the European Communities.Implamenting council directive 96/23/EC concerning the performance of analytical methods and the interpretation of results,2002/657/EC[EB/OL].http://www.wetgiw.gov.pl/old/U E/p raw o/02_657/ e02657.pdf.
[12]王光辉,熊少祥.有机质谱解析[M].北京:化学工业出版社,2005.
HPLC-MS/MS determination of illegal drug benzocaine added in weight-loss functional foods
MA Wei1,DAI Han-hui2,ZHANG Ying-chun3,CHEN Dong-dong2,WANG Hai-bo1,LIU Hai-yun2,WANG Xiu-jun2,TANG Ying-zhang2
(1.Heilongjiang Entry-Exist Inspection and Quarantine Bureau,Haerbin 150086,China;2.National Academy of Inspection and Quarantine,Beijing 100123,China;3.Food Science and Engineering College of Harbin Institute of Technology,Harbin 150090,China)
A comprehensive analytical method based on high performance liquid chromatography tandem mass spectrometry was developed for the determination of benzocaine.Various weight-loss functional foods,including weight-loss coffee,tea,capsule,tablet and biscuit were extracted under ultrasonication and were separated on Waters Atlantis T3(150mm ×2.1mm,3μm)column.Benzocaine was detected by MS/MS technique using positive electrospray ionization and multiple reaction monitoring(MRM)mode,and employing two precursor-product ion pairs:m/z166 and m/z 138,m/z166 and m/z 94,as qualitative ion pairs,m/z166 and m/z 138 as quantification ion pairs.The results showed that the calibration curve showed good linearity for benzocaine in the ranges of 0.01~50μg/L,and the correlative coefficient was 0.9985.The mean recoveries at the three spiked levels(low,middle,high)were 69.3%~95.6%.The mass spectrum characterization of benzocaine and speculated on fragmentation pathways were also studied.The method is sensitive,simple and adapt to the determination of benzocaine in the different weight-loss functional foods.
HPLC-MS/MS;ultrasonication extraction;benzocaine;mass spectrum fragmentation pathways
TS207.3
A
1002-0306(2011)02-0353-04
2009-11-16
马微(1978-),女,博士,工程师,研究方向:食品安全。
国家科技支撑计划农业领域课题(2006BAD27B02)。
