蛋白质消化率测定方法的研究进展
2011-11-14孙敏杰木泰华
孙敏杰,木泰华
(中国农业科学院农产品加工研究所食品化学与营养研究室,北京100193)
蛋白质消化率测定方法的研究进展
孙敏杰,木泰华*
(中国农业科学院农产品加工研究所食品化学与营养研究室,北京100193)
对蛋白质消化率进行研究,不仅能使人们了解蛋白质的消化特性,而且对于研究蛋白质的营养价值具有重要的意义。为此,对国内外食品中蛋白质消化率测定的常用方法进行了综述与评价,并对各种蛋白质消化率测定方法的优缺点及适用的范围进行了讨论。
蛋白质,消化率,体内,体外
评价食物营养价值的一个重要指标就是蛋白质的质量。所谓“质”是考察食物蛋白质必需氨基酸的含量、模式以及机体对其消化、利用的程度,而“量”则是考察食物中蛋白质含量的多少[1]。在以往对蛋白质的质量进行研究时,主要以蛋白质含量和必需氨基酸模式为主,常常忽略对其消化和吸收利用程度的研究。然而,某些蛋白质,即便其氨基酸组成符合FAO/WHO推荐的标准,但由于受到蛋白质来源(动物、植物)、非蛋白成分(膳食纤维、胰蛋白酶抑制剂)及生理等因素的影响,这些蛋白质在体内消化、吸收和利用的程度可能会很低,从而导致营养价值偏低。蛋白质消化率是指人体从蛋白质中吸收的氮占摄入氮的比值,反映了食物蛋白质被消化酶分解、吸收的程度[1]。目前测定食品蛋白质消化率主要包括体外蛋白质消化率和体内蛋白质消化率两种方法。因此,在对蛋白质的质量进行评价时,应该对其消化率进行测定和分析,这对全面评价食物营养具有重要的意义。
1 蛋白质消化率测定方法
1.1 体外蛋白质消化率测定法
体外消化率测定法是模拟蛋白质在人体内消化过程的一种方法,该法不仅可以直接预测食物蛋白质的营养价值,还可以提供各种蛋白质在胃、肠内消化和吸收的情况。这种方法不需要活体动物,而且与体内消化率测定法有着很高的相关性,可以人为准确地控制实验条件,不同实验室间测定的结果可比性好,测定效率和稳定性高,成本低。体外蛋白质消化率测定法主要包括两个步骤,一是先利用蛋白酶水解蛋白质,然后再通过测定蛋白质的水解度来计算蛋白质的消化率或采用其它方法对蛋白质的消化程度进行评价。图1为蛋白质体外消化率测定法的一般步骤。
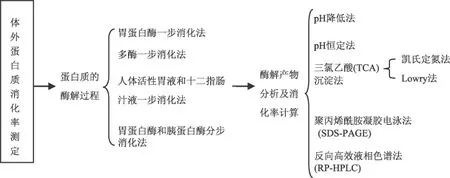
图1 蛋白质体外消化率测定法的一般步骤
1.1.1 蛋白质的酶解过程 体外消化率测定法测定蛋白质消化率的第一步就是使用蛋白酶水解蛋白质来模拟食物在人体内的消化过程,主要包括胃蛋白酶一步消化法、多酶一步消化法、人体活性胃液和十二指肠汁液一步消化法及胃蛋白酶和胰蛋白酶分步消化法等。胃蛋白酶一步消化法[2-5]采用胃蛋白酶直接进行水解,用酶单一,操作简单,但由于单一酶不能将某一蛋白质水解成所有可利用的氨基酸,所以此方法测得的消化率偏低;多酶一步消化法多采用的是胰蛋白酶、糜蛋白酶和肽酶的混合物直接进行水解[6-11],操作简便,此混合酶具有协同作用,可将蛋白质充分水解,测得的消化率较高[12];人体活性胃液和十二指肠汁液一步消化法[13-14]是使用三腔管收集人体活性胃液和十二指肠汁液,可直接对所测蛋白质进行消化,此方法可以很好地模拟人体对蛋白质的消化,但是采用该法收集消化液的难度较大,胃液和十二指肠液中蛋白酶的种类和活力还会因受试者的年龄、胃肠消化功能等因素存在差异,导致实验重现性差;胃蛋白酶和胰蛋白酶分步消化法在体外消化模型研究中应用较广,其原理是首先用胃蛋白酶在酸性条件模拟食物在胃内的消化过程,用碱将胃蛋白酶活力钝化后,再模拟营养成分在小肠的消化过程,用胰蛋白酶在中性条件下继续消化,最后将已消化的营养成分与未消化的营养成分分开后并分别进行测定[15-17]。该法能够很好地模拟食物在消化道内的消化过程,从而可以很好地反映食物蛋白在不同消化阶段被消化的情况。此外,与人体胃液及肠液相比,胃蛋白酶及胰蛋白酶比较容易获得,而且各种酶的组分也较易分析,测定的结果重现性好。
1.1.2 蛋白质酶解产物分析及消化率计算的方法
1.1.2.1 pH降低法 pH降低法是通过测定一定消化时间后的pH降低值来测定蛋白质消化率的方法。一般使用胰蛋白酶、糜蛋白酶和肽酶的混合物对蛋白样品进行消化。其原理是在蛋白酶消化样品的过程中,样品蛋白肽键断裂,释放出氢离子,导致悬浊液的pH降低,在起始后第10min,该法与体内大鼠粪氮平衡实验所测消化率的结果具有较高相关性(r>0.80)[6,18]。
pH降低法体外消化率的计算公式如下[7]:
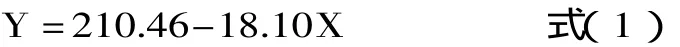
式中:Y-体外消化率(%);X-添加多酶溶液(胰蛋白酶、糜蛋白酶和肽酶的混合物)的样品消化第10min所测pH。
1.1.2.2 pH恒定法 pH恒定法是通过测定一定消化时间后pH降低所产生氢离子的浓度从而计算出蛋白质消化率的方法。即在使用胰蛋白酶、糜蛋白酶、肽酶混合液对蛋白质进行消化过程中,采用恒pH自动滴定仪,向消化液中不断地滴入0.1mol/L NaOH溶液与蛋白质水解过程中产生的氢离子作用,并使样品消化液pH保持或恒定在8.0,再根据水解第10min时所添加的碱量来计算蛋白质消化率[19]。此外,与pH降低法相比,pH恒定法与体内消化法动物实验的结果具有高度的相关性(r=0.96)。pH恒定法体外消化率的计算公式如下[12,17-18]:
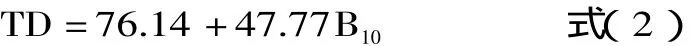
式中:TD-蛋白质消化率(%);B10-水解第10min所添加NaOH溶液的量(mL)。
1.1.2.3 TCA沉淀法 即先使用胃蛋白酶和胰蛋白酶分步对蛋白样品进行消化,然后向消化液中加入TCA溶液,离心将未消化的蛋白质沉淀后测定其蛋白质含量,最后计算蛋白质消化率的方法。TCA沉淀法可精确定量未/已消化蛋白,但是结果要比pH恒定法低[12]。TCA沉淀法体外消化率的计算公式如下[12,21-25]:
现代人力资本理论的先驱西奥多·舒尔茨指出:“人的知识、能力、健康等人力资本的提高对经济增长的贡献比物力、劳动力数量的增加要重要得多,在改变穷人的福利中,决定性的生产要素不是空间、能源和耕地,而是人的质量的改进。”
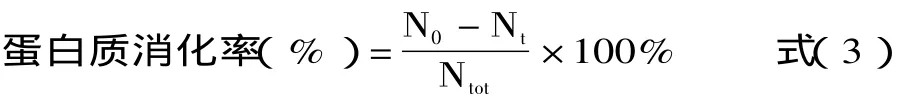
式中:N0-消化前蛋白质样品中TCA沉淀物中的氮含量(mg);Nt-消化后的TCA沉淀物中的氮含量(mg);Ntot-蛋白质样品中的总氮含量(mg)。
1.1.2.4 SDS-PAGE法 SDS-PAGE法一般是对体内外蛋白消化产物进行定性分析的一种方法。该法可对不同消化时间及不同蛋白水解产物的分子量进行推定,并可通过电泳条带的变化直观地分析和判断蛋白消化难易的程度[14-15,26-27]。SDS-PAGE法可较为准确地分析水解产物的分子量的变化,但操作较为复杂、时间较长。此外,在分析转基因外源蛋白质消化稳定性实验中,还可通过对蛋白质在不同消化时间的水解产物进行电泳和印迹,从而确定某一蛋白质在模拟人体胃/肠消化过程中被完全消化的时间,推断该外源蛋白在模拟人体胃/肠消化过程中的稳定性[28]。
1.1.2.5 RP-HPLC法 RP-HPLC法是对体内外蛋白消化产物进行定性、定量分析并能回收各种水解肽的一种方法。该法不仅可对不同消化时间及不同蛋白水解产物的组成及含量进行分析,而且还能针对目标肽进行纯化和收集[29]。但此法分析设备较贵,样品需要进行前处理。将水解后生成肽的总峰面积与水解后肽-蛋白质的总峰面积相比,得出蛋白质的消化率[30]:

1.2 体内蛋白质消化率测定法
体内蛋白质消化率测定法是通过动物体研究和分析蛋白质的消化率、评价蛋白质质量的方法[1]。其中,采用大鼠粪氮平衡实验是最适合预测人体消化率的一种较权威的方法[19]。其原理是待测蛋白质(摄入氮)在被吸收前,首先在胃酸作用下,胃中的胃蛋白酶原转换成胃蛋白酶对食物蛋白质进行消化,接着是被肠中的胰蛋白酶和糜蛋白酶作用,最后,少量的来自微生物细胞和脱落的肠内粘膜细胞的粪代谢氮及不能被消化的食物蛋白质经过结肠时,一起从粪便中排出(粪氮)[31]。如果不计粪代谢氮,摄入氮与粪氮的差值占摄入氮的比例称为表观消化率。由于表观消化率的测定方法简单易行,所以应用较广。但是表观消化率所测得的结果与实际值相比较低。因此,需要对无蛋白饲料条件下所产生的粪代谢氮进行测定来校正表观消化率。然而,由于无蛋白饲料会引起动物机体的应激反应,影响测定结果的准确性,所以现多采用向饲料中添加5%具有高消化性酪蛋白后再测定粪代谢氮的方法[32]。这种含粪代谢氮的消化率计算方法被称为蛋白质的真消化率[33-34]。其计算公式如下:
蛋白质真消化率(%)=氮吸收量/摄入氮=[摄入氮-(粪氮-粪代谢氮)]/摄入氮×100% 式(5)
大鼠粪氮平衡实验的关键是对粪便的精确收集,通常使用传统大鼠饲养笼不能严格分离动物的粪便及尿液[32]。因此,目前已有新型的大鼠代谢笼问世,可以很好地将大鼠粪便与尿液进行分离。
2 讨论
蛋白质体内消化率测定法与体外消化率测定法各有利弊。1991年在意大利罗马举办的FAO/WHO蛋白质质量评价专家咨询会指出,蛋白质体内消化率、体外消化率与人体临床研究测定的方法得到的数据具有很好的相关性[35]。体内法测定的消化率能够比较真实地反映动物对食物的消化情况,但体内消化率测定法操作复杂、时间长、费用高,且实验动物对外界环境的要求较高,季节、温度、光照等都会影响消化率的测定值。因此,体内消化率测定法可以作为一种验证的方法,但不适合做大规模食品评定。相比而言,体外消化法是利用精制的消化酶或生物体消化道酶提取液在试管内进行的消化实验,其测定值可较为准确地反映动物对食物的消化率[36]。该方法简便且重复性好,不仅适用于大规模食品评定,更适用于蛋白质营养质量的分级和对蛋白质体内营养价值的预测,并能检测出同种物料的不同样品间质量的微小差异。
然而,还存在影响体外消化率测定结果的各种因素,如被测食物的粒径及组成成分、蛋白酶的数量及种类、消化条件、蛋白质水解物的分析方法等。因此,用一个单纯的体外消化模型来再现所有复杂的生化和生理过程是不可能的[6]。此外,体外和体内消化率测定法结果间还存在一定的差异,所以在选用体外消化率测定法对具体食物蛋白消化率进行测定和分析时,尽可能比较两种方法间的相关性[37]。相关系数越高,表明体外消化率测定法可信度就越高。因此,为了更科学地模拟人体消化,体外消化率测定法还需要进一步完善和发展。
3 结论
体外蛋白质消化率测定法和体内消化率测定法都是预测蛋白质在人体中消化率较常用的方法。在体外蛋白质消化率测定法中,pH降低法与pH恒定法操作简便、快速、重现性好,特别是pH恒定法与体内法所测结果相关性最高;TCA沉淀法可精确定量未/已消化蛋白含量,但测定值偏低;SDS-PAGE法与RP-HPLC法可对消化产物进行定性和定量分析,但需前处理,且测定时间较长;在体内蛋白质消化率测定法中,蛋白质的真消化率最为准确。
[1]邓泽元,乐国伟.食品营养学[M].南京:东南大学出版社,2007:32.
[2]Tanaka K,Matsumoto K,Akasawa A,et al.Pepsin-resistant 16kDa Buckwheat protein is associated with immediate hypersensitivity reactions in patients with Buckwheat allergy[J]. International Archives of Allergy and Immunology,2002,129:49-56.
[3]Tang C H,Sun X,Yin S W,et al.Transglutaminase-induced cross-linking of vicilin-rich kidney protein isolate:Influence on the functional properties and in vitro digestibility[J].Food Research International,2008,41:941-947.
[4]G Valencia del Toro,R C Vega,M E Garin-Aguilar. Biological quality of proteins from three strains of Pleurotus spp[J].Food Chemistry,2006,94:494-497.
[5]Thomas K,Aalbers M,Bannon G A,et al.A multi-laboratory evaluation of a common in vitro pepsin digestion assay protocol used in assessing the safety of novel proteins[J].Regulatory Toxicology and Pharmacology,2004,39:87-98.
[6]Hsu H W,Vavek D L,Satterlee L D,et al.A multienzyme technique for estimating protein digestibility[J].Journal of Food Science,1977,42:1269-1273.
[7]Cuevas-Rodriguez E O,Verdugo Montoya N M,Angulo-Bejarano P I,et al.Nutritional properties of tempeh flour from quality protein maize(Zea mays L.)[J].LWT-Food Science and Technology,2006,39:1072-1079.
[8]Milan Carrillo J,Valdez Alarcon C,Gutierrez Dorado R,et al.Nutritional properties of quality protein maize and chickpea extruded based weaning food[J].Plant Foods for Human Nutrition,2007,62:31-37.
[9]Nergiz C,Gokgoz E.Effects of traditional cooking methods on some antinutrients and in vitro protein digestibility of dry bean varieties(Phaseolus vulgaris L.)grown in Turkey[J].International Journal of Food Science and Technology,2007,42(7):868-873.
[10]Adebowale Y A,Adeyemia A,Oshodi A A.Variability in the physicochemical,nutritional and antinutritional attributes of six Mucuna species[J].Food Chemistry,2005,8937-8948.
[11]Khattab R Y,Arntfield S D,Nyachoti C M.Nutritional quality of legume seeds as affected by some physical treatments,Part 1:Protein quality evaluation[J].LWT-Food Science and Technology,2009,42:1107-1112.
[12]Abdel-Aal E SM.Effects of baking on protein digestibility of organic spelt products determined by two in vitro digestion methods[J].Lebensmittel-Wissenschaft und Technologie,2008,41:1282-1288.
[13]Secundino Loipez,David R Davies,F Javier Giraldez,et al. Assessment of nutritive value of cereal and legume straws based on chemical composition and in vitro digestibility[J].Journal of the Science of Food and Agriculture,2005,85:1550-1557.
[14]Almaas H,Cases A L,Devold T G,et al.In vitro digestion of bovine and caprine milk by human gastric and duodenal enzymes[J].International Dairy Journal,2006,16:961-968.
[15]Nunes A,Correia I,Barros A,et al.Sequential in vitro pepsin digestion of uncooked and cooked sorghum and maize samples[J].Journal of Agricultural and Food Chemistry,2004,52:2052-2058.
[16]Tang C H,Sun X,Yin S W,et al.Transglutaminase-induced cross-linking of vicilin-rich kidney protein isolate:Influence on the functional properties and in vitro digestibility[J].Food Research International,2008,41:941-947.
[17]Tedeschi C,Clement V,Rouvet M,et al.Dissolution tests as a tool for predicting bioaccessibility of nutrients during digestion[J].Food Hydrocolloids,2009,23:1228-1235.
[18]Pedersen B,Eggum B O.Prediction of protein digestibility by in vitro procedures based on two multienzyme systems[J]. Zeitschrift für Tierphysiologie, Tierernährung und Futtermittelkunde,1981,45:190-200.
[19]Boutrif E.Recent developments in protein quality evaluation[J].Food Nutrition and Agriculture,1991,2(3):36-40.
[20]Pedersen B,Eggum B O.Prediction of protein digestibility by an in vitro enzymatic pH-stat procedure[J].Journal of Animal Physiology and Animal Nutrition,1983,49:265-277.
[21]Tang C H,Chen L,Ma Y C.Thermal aggregation,amino acid composition and in vitro digestibility of vicilin-rich protein isolates from three Phaseolus legumes:A comparative study[J]. Food Chemistry,2009,113:957-963.
[22]Poonam,Gahlawat.Protein and starch digestibilities and mineral availability of products developed from potato,soy and corn flour[J].Plant Foods for Human Nutrition,1998,52:151-160.
[23] AmritBhandal.Effectoffermentation on in vitro digestibilities and the level of antinutrients in moth bean(Vigna aconitifolia(Jacq.)Marechal)[J].International Journal of Food Science and Technology,2008,43(11):2090-2094.
[24] Chandi Gurpreet K,Sogi Dalbir S.Biochemical characterisation of rice protein fractions[J].International Journal of Food Science and Technology,2007,42:1357-1362.
[25]Jackson J C.Protein nutritional quality of cowpea and navy bean residue fractions[J].African Journal of Food,Agriculture,Nutrition and Development,2009,9(2):764-778.
[26]Zeece M,Huppertz T,Kelly A.Effect of high-pressure treatment on in vitro digestibility of β-lactoglobulin[J]. Innovative Food Science and Emerging Technologies,2008,9(1):62-69.
[27]周志红,唐传核,杨晓泉.大豆蛋白的体外模拟消化过程及热处理的影响[J].食品科学,2006,27(1):37.
[28]中华人民共和国农业部.农业部869号公告-2-2007.转基因生物及其产品食用安全检测:模拟胃肠液外源蛋白质消化稳定性实验方法[S].农业部:中华人民共和国国家标准,2007.
[29]Roufik Samira,Gauthier Sylvie F,Sylvie L Turgeon.In vitro digestibility of bioactive peptides derived from bovine βlactoglobulin[J].International Dairy Journal,2006,16:294-302.
[30] Chicón,Josefina Belloque,Elena Alonso,et al. Immunoreactivity and digestibility of high-pressure-treated whey proteins[J].International Dairy Journal,2008,18:367-376.
[31]AOAC.AOAC OfficialMethod991.29.TrueProtein Digestibility of Foods and Food Ingredients-Rat Bioassay First Action[S].1991.
[32]葛可佑.中国营养科学全书[M].北京:人民卫生出版社,2004:596.
[33]Wong K H,Cheung Peter C K,Put O Ang Jr.Nutritional evaluation of protein concentrates isolated from two red seaweeds:Hypnea charoides and Hypnea japonicain growing rats[J]. Hydrobiologia,2004,12:271-278.
[34]Ayodeji O Fasuyi.Bio-nutritional evaluations of three tropicalleafvegetables(Telfairia occidentalis,Amaranthus cruentus and Talinum triangulare)as sole dietary protein sources in rat assay[J].Food Chemistry,2007,103:757-765.
[35]FAO/WHO.Protein Quality Evaluation;Report of the Joint FAO/WHO Expert Consultation,FAO Food and Nutrition[R]. Rome,Italy,1991:51.
[36]黄沧海,陈东晓.几种蛋白质原料体外消化率测定方法的比较[J].饲料工业,2005,26(20):48-51.
[37]Urbano G,López Jurado M,Frejnagel S,et al.Nutritional assessment of raw and germinated pea(Pisum sativum L.)protein and carbohydrate by in vitro and in vivo techniques[J].Nutrition,2005,21:230-239.
Development of methods for the determination of protein digestibility
SUN Min-jie,MU Tai-hua*
(Laboratory of Food Chemistry and Nutrition Science,Institute of Agro-Food Science and Technology,Chinese Academy of Agricultural Sciences,Beijing 100193,China)
The study of protein digestibility,not only makes people aware of the characteristic of protein digestion,but also is of great significance to study the nutritional value of protein and its application.Therefore,commonly used methods for the determination of protein digestibility of foods at home and abroad were reviewed and evaluated.ln addition,the advantages and disadvantages,and the scope of application of different methods for the determination were also discussed.
protein;digestibility;in vivo;in vitro
TS201.2+1
A
1002-0306(2011)02-0382-04
2010-01-15 *通讯联系人
孙敏杰(1982-),女,在读博士研究生,研究方向:食品化学与营养。
国家“863”计划资助项目(2006AA10Z332);现代农业产业技术体系建设专项资金资助。
