mRNA差异显示技术研究中外猪种肉质性状差异表达基因
2011-11-10覃立立李加琪
覃立立,童 雄,徐 建,张 豪,李加琪,王 翀
(华南农业大学广东省农业动物基因组学与分子育种重点实验室,广东广州 510642)
真核生物基因组中,只有约10% ~15%的基因在单个细胞中表达,因而从mRNA水平上研究差异表达的基因对于从事家畜育种研究工作者是一项非常有意义的工作.Liang等[1]创立了mRNA差异显示技术(DDRT-PCR)以研究 mRNA的表达差异.李盛霖等[2]利用该技术对福州黑猪、肉用型猪和其他杂种猪的肉质特性进行了研究,结果表明福州黑猪的各项肉质指标均高于各引进肉用型猪种,福州黑猪的肌肉pH为5.24±0.16,肌肉颜色评分为4.33±0.21,肌肉大理石纹评分为3.33±0.21,失水率为(19.28±5.49)%,肌纤维直径为(43.05±6.12)μm.Lonergan等[3]认为造成猪种生长和肉质性状差异的原因是高强度选育.李亮等[4]利用mRNA差异显示技术对丝羽乌骨鸡与快大型肉鸡肝脏组织中差异表达基因进行筛选,得到10条丝羽乌骨鸡与快大型肉鸡肝脏差异表达序列标签.Liu等[5]应用DDRT-PCR技术研究大白、长白正反杂交组合与大白、梅山杂交组合之间背最长肌中基因表达的差异,发现了一个与CO2水合作用相关的新基因,命名为猪的CA-Ⅲ基因.本研究利用mRNA差异显示技术对广东省地方品种蓝塘猪和引进品种大白猪达到经济成熟时的眼肌组织mRNA进行比较.利用DDRT-PCR技术研究中外猪种肉质性状相关差异表达基因,探讨造成中外猪种肉质表型差异的分子机制,对于充分发挥地方品种和引入品种的遗传优势、生产出更多满足人们需要的产品具有重要意义.
1 材料与方法
1.1 试验材料
1.1.1 试验动物 纯种蓝塘猪眼肌组织样品采自广东省板岭原种猪场,共4头(公母各半);纯种大白猪也来自同一猪场,共4头(公母各半).采集的2个品种猪均为达到体成熟的健康猪.
1.1.2 差异显示引物 本研究所用的差异显示引物由美国Iowa State University的Rothschild教授惠赠,锚定引物序列见表1,随机引物序列见表2.

表1 差异显示3′锚定引物序列Tab.1 3′anchor primer sequences of differential display
1.1.3 差异显示条带重扩增所用引物 差异显示条带回收后重扩增所用引物如表3所示.
1.1.4 主要试剂 TRIZOL Reagent为Invitrogen公司产品.Taq酶、dNTPs、低熔点的琼脂糖、AMV反转录酶、RNasin为 TaKaRa公司产品.DEPC、EDTA、TRIS、TEMED、去离子甲酰胺、过硫酸铵、硼酸、丙烯酰胺、双丙烯酰胺、甘油均为上海生物工程有限公司产品.
1.2 试验方法
1.2.1 总RNA提取 总RNA的提取按照Invitrogen公司的 TRIZOL Reagent使用说明进行.用DNase-I处理以去除其中痕量的染色体DNA污染.
1.2.2 非变性聚丙烯酰胺凝胶电泳 差异显示PCR产物在非变性的聚丙烯酰胺凝胶电泳上分离并拍照.

表2 差异显示5′随机引物序列Tab.2 5′random primer sequences of differential display
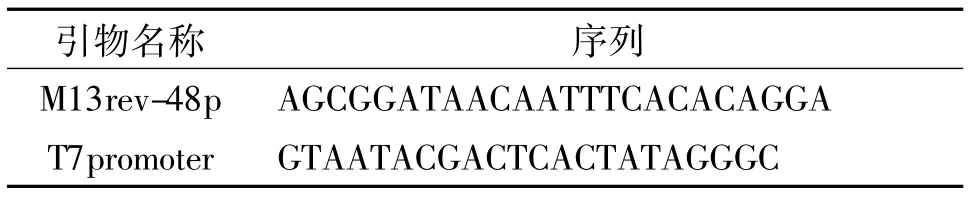
表3 差异显示条带重扩增引物序列Tab.3 Re-amplified primer sequences of differential display bands
1.2.3 银染显带 在银染的每一步都要戴上干净的手套,避免在胶板上留下指纹.步骤为凝胶板的分离、固定、凝胶染色、显影、固定、拍照.
1.2.4 差异显示条带回收与重扩增 用洁净的手术刀片将凝胶上的差异条带切下,放入0.5 mL的离心管中,加入 50 μL双蒸水,煮沸 15 min,然后在4℃、8000 r/min离心1 min,吸取上清液,-20℃保存.取上述回收产物1 μL做模板,用与第一次PCR相同的反应体系,分别用T7 promoter和M13rev-48p作为重扩增的上下游引物,进行PCR.PCR反应程序为:94℃变性5 min后,按94℃ 30 s、60℃ 40 s、72℃ 1 min共进行30个循环,最后72℃延伸5 min.
1.2.5 测序 将差异表达ESTs的PCR产物送交上海英骏生物技术有限公司测序.
2 结果
2.1 差异显示结果
2.1.1 差异显示ESTs的重复性 为了便于直观地显示出差异表达的条带,并且保证有差异的条带具有可重复性,本试验在电泳时,将2个重复样品连续点样,同一对引物组合4个样品平行上样,如图1所示.其中 ESTsp7在大白猪种中表达量高,而ESTsp8、ESTsp9、ESTsp10、ESTsp11在大白猪中表达量低.差异显示结果见表4.

图1 差异显示PCR聚丙烯酰胺凝胶电泳图Fig.1 Differential display PCR in polyacrylamide gel electrophoresis
2.1.2 差异显示ESTs测序结果 本研究得到的差异显示ESTs测序结果见表5.
2.1.3 差异显示条带的重扩增 对差异比较明显的目的条带回收后,以回收产物作模板进行PCR,其产物用普通琼脂糖凝胶电泳检测,得到特异性的条带(图2).

表4 5条差异显示的ESTsTab.4 Five differential display ESTss

图2 差异条带重扩增电泳图Fig.2 Differential band re-amplification in gel electrophoresis

表5 ESTs测序结果Tab.5 Sequencing results of ESTs
2.1.4 相似性比对结果 将差异显示PCR得到的5条ESTs序列与GenBank上已知序列进行对库检索,结果表明:ESTsp7序列与细胞色素c氧化酶亚单位Ⅲ基因在473 bp的范围内相似性达到100%,而ESTsp9、ESTsp10、ESTsp11均与猪 SLN 基因相似性达到了94% ~95%,表明这3段ESTs位于猪SLN基因的不同位置.ESTsp8未搜索到相似基因.
3 讨论
Janzen 等[6]利用 DD RT-PCR 的方法鉴定了一个经过选择纯化的品系和一个随机的对照品系的背最长肌的差异表达基因,分离和鉴定了一条在选择品系的背最长肌中有很高表达量的590 bp的cDNA,该cDNA与牛的相对分子质量为16000的cAMP-调控磷蛋白(Regulated phosphoprotein,ARPP-16)cDNA序列的3'-非转录区有89%的相似性.对猪的ARPP-16的RT-PCR扩增和测序证实DD法得到的cDNA是猪的 ARPP-16转录子的3'末端.半定量PCR分析表明ARPP-16在选择品系中表达量比对照品系提高了4倍(P<0.01),表明 ARPP-16可能是调控猪骨骼肌生长的一个重要的基因.银巍等[7]应用mRNA差异显示技术获得164个在大鼠小脑颗粒神经元凋亡模型中差异表达的ESTs,对其中的17个ESTs进行了克隆并测序,再通过反Northern杂交初步筛选得到 5 个阳性片段.Muráni等[8]用 DDRTPCR技术对胚胎期的皮特兰和杜洛克骨骼肌转录本进行研究,对其中80个cDNA片段测序,43个与生长的时期相关,37个与猪种相关,在得到的85条特异ESTs中,有52条位于已知的基因上.Mario等[9]用DDRT-PCR技术对新生小猪的左右心室的基因表达进行比较,在得到的5600条带中,有153条被识别的差异显示条带.Ponsuksili等[10]为了鉴定可能代表猪胴体性状候选基因的ESTs,采用DD法对一个资源群体的F2代个体和纯种的德国长白猪进行研究,得到了6条差异表达的ESTs,其中的3条与已知基因无任何相似性,另3条与已知基因存在不同程度的相似性.本研究利用200对引物组合筛选到了在蓝塘和大白猪种中存在明显差异表达的5个肌肉组织的ESTs,其中ESTsp7与已知的线粒体基因组编码的细胞色素c氧化酶亚单位Ⅲ基因高度相似.在线粒体编码的3个大亚基中,亚基Ⅰ是一种完整的膜蛋白并带有12个跨膜螺旋(Ⅰ~Ⅻ),含有3个氧化还原反应中心,并存在于所有的亚铁血红素-铜氧化酶中[11].是否参与氧化呼吸链,影响肌肉的熟化代谢过程还有待深入研究.ESTsp9、ESTsp10、ESTsp11与猪SLN基因相似性达到了94% ~95%,表明是该基因的不同区段.SLN基因在骨骼肌肌浆网快肌纤维中有较高的表达,而在慢肌纤维中表达减少[12].在心力衰竭的狗的心房中,检测到SLN蛋白表达水平提高了3倍多,而在心肌缺血的心房中,表达水平减少30%.在受磷蛋白缺失的心房中,SLN蛋白表达量增加,在心房中SLN蛋白代偿缺失了的受磷蛋白[13].研究表明猪SLN基因在猪的背最长肌组织中表达最高,在大梅杂种猪中,背最长肌中该基因的表达量要高于梅山猪[14].本研究发现,该基因上的ESTs片段在蓝塘猪中表达均高于大白猪,能否作为一个影响中外猪种的产肉机制的候选基因,还需深入研究.
[1]LIANG Peng,PARDEE A B.Differential display of eukaryotic messenger RNA by means of the polymerase chain reaction[J].Science,1992,257(5072):967-971.
[2]李盛霖,陈岩锋,郑逢源,等.福州黑猪、肉用型猪及其杂种猪肉质特性的研究[J].福建农业学报,1996,11(1):8-11.
[3]LONERGAN S M,HUFF-LONERGAN E,ROWE L J,et al.Selection for lean growth efficiency in Duroc pigs influences pork quality[J].J Anim Sci,2001,79(8):2075-2085.
[4]李亮,赵小玲,李琴,等.利用mRNA差异显示技术筛选丝羽乌骨鸡肝脏差异表达序列标签[J].畜牧兽医学报,2010,41(4):387-391.
[5]LIU Yong-yang,XIONG Yuan-zhu,DENG Chang-yan et al.Isolation,cDNA sequence analysis and tissue expression profile of a novel swine gene diferentially expressed in the Longissimus dorsi muscle tissues from Large White×Meishan cross combination[J].Progress in Natural Science,2005(12):3-6.
[6]JANZEN M A,KUHLERS D L,JUNGST S B,et al.ARPP-16 mRNA is up-regulated in the longissimus muscle of pigs possessing an elevated growth rate[J].J Anim Sci,2000,78(6):1475-1484.
[7]银巍,黄奕俊,皮荣标,等.应用mRNA差异显示技术筛选大鼠小脑颗粒神经元凋亡模型中差异表达基因[J]. 中国病理生理杂志,2007,23(11):2141-2146.
[8]MURÁNI E,MURÁNIOVÁ M,PONSUKSILI S,et al.I-dentification of genes differentially expressed during prenatal development of skeletal muscle in two pig breeds differing in muscularity[J].BMC Developmental Biology,2007,7:109.
[9]MARIO T,RAGUEL I,BEATRIZ N,et al.Identification of candidate genes potentially relevant to chamber-specific remodeling in postnatal ventricular myocardium[J].J Biomed Biotechnol,2010,10:1155.
[10]PONSUKSILI S,WIMMERS K,SCHELLANDER K.Application of differential display RT-PCR to identify porcine liver ESTs[J].Gene,2001,280(1/2):75-85.
[11]江海洪,谢燕,刘倩予.细胞色素c氧化酶的分子生物学研究进展[J].国外医学:生理、病理科学与临床分册,2001(1):20-22.
[12]BECUCCI L,GUIDELLI R,KARIM C B,et al.An electrochemical investigation of sarcolipin reconstituted into a mercury-supported lipid bilayer[J].Biophys J,2007,93(8):2678-2687.
[13]GOPAL J B,POOMIMA B,CYNTHIA A C,et al.Differential expression of sarcolipin protein during muscle development and cardiac pathophysiology[J].J Mol Cell Cardiol,2007,43(2):215-222.
[14]黄涛.杂种大白×梅山F1代与其母本梅山猪背最长肌间差异表达基因的克隆鉴定及其特征分析[D].武汉:华中农业大学动物科技学院,2006.
