好氧反硝化细菌WIT-1的分离鉴定及其脱氨氮特性
2011-11-09武汉工程大学化工与制药学院绿色化工过程省部共建教育部重点实验室湖北省新型反应器与绿色化学工艺重点实验室湖北武汉430074
(1.武汉工程大学化工与制药学院,绿色化工过程省部共建教育部重点实验室,湖北省新型反应器与绿色化学工艺重点实验室,湖北武汉 430074;
2.合肥工业大学生物与食品工程学院,安徽合肥 230009)
好氧反硝化细菌WIT-1的分离鉴定及其脱氨氮特性

(1.武汉工程大学化工与制药学院,绿色化工过程省部共建教育部重点实验室,湖北省新型反应器与绿色化学工艺重点实验室,湖北武汉 430074;
2.合肥工业大学生物与食品工程学院,安徽合肥 230009)
为了选择和研究一种好氧反硝化细菌,从武汉工程大学苗圃分离到一株具有好氧反硝化能力的细菌并命名为WIT-1,鉴定为革兰氏阴性菌,杆状,菌落为淡黄色,结合16S rDNA序列分析结果初步鉴定菌株WIT-1为施氏假单胞菌(Pseudomonas stutzeri).初步探讨了菌株WIT-1在不同碳源种类、碳氮比、p H值、温度对菌株WIT-1脱氨氮作用的影响.结果表明,该菌去除氨氮过程中同时也能降低化学需氧量(Chemical Oxygen Demand,COD),并且不积累硝酸盐和亚硝酸盐.不同碳源种类下菌株WIT-1的脱氨氮能力从高到低顺序为:丁二酸钠、乙酸钠、蔗糖、葡萄糖、柠檬酸三钠.除氨氮和COD的最适初始p H为7.5,最适温度为30℃.菌株WIT-1在最适条件下,24 h对氨氮的降解率可以达到100%,48 h对COD的降解率为73.44%.
好氧反硝化;异养硝化;施氏假单胞菌;氨氮
0 引 言
据《2010年环境状况公报》显示,我国环境总体形势依然十分严峻.湖泊(水库)富营养化问题依然突出,在监测营养状态的26个湖泊(水库)中,富营养化状态的占42.3%.水体的富营养化问题主要由水体中的总氮超标所引起.由于氮元素污染的危害,脱氮已经成为水处理和防止氮素危害的重要一步.目前普遍认为,生物脱氮是水处理中防止氮素危害最经济有效的方法之一.传统生物脱氮途径一般包括硝化和反硝化两个步骤,即在好氧条件下通过自养硝化菌的作用,将水中氨氮(NH4+-N)转化为硝酸氮(NO-3-N)或亚硝酸氮(NO-2-N),然后在缺氧或厌氧条件下,利用反硝化菌将硝酸氮和亚硝酸氮还原为氮气,达到脱氮的目的[1].由于两个菌的作用条件不同,这两个过程不能同时发生,只能序列进行[2].近些年来,不断有好氧反硝化细菌的分离报道,好氧反硝化现象的出现突破了传统理论的束缚,使人们对生物脱氮技术的发展有了全新的认识.已有文献[3]报道一些好氧反硝化细菌同时具有异养硝化功能,这一发现为同时硝化反硝化工艺(simultaneous nitrification denitrification,SND)发展奠定了理论基础[4].因此异养硝化-好氧反硝化菌正成为研究的热点.文献报道的许多菌属如Pseudomonas stutzeri,Thiosphaera pantotropha,Alcaligenes faecalis,Pseudomonas putida等[5-7]都具有良好的异养硝化-好氧反硝化作用.笔者从武汉工程大学苗圃采集土样,通过富集分离到一株具有好氧反硝化能力的细菌,该菌株命名为WIT-1.通过形态观察和16S rDNA序列分析,对菌株WIT-1进行初步鉴定.初步探讨了不同碳源种类、碳氮比、p H值、温度对菌株WIT-1脱氨氮作用的影响.为后面的实现同时硝化反硝化工艺做前期的理论研究.
1 实验部分
1.1 材料
1.1.1 菌种来源 好氧反硝化细菌WIT-1为本实验室从武汉工程大学苗圃采集土样中分离.
1.1.2 培养基 反硝化细菌富集分离培养基[8]成分(g/L):Na2HPO4·7H2O为7.9;KH2PO4为1.5;NH4Cl为0.3;MgSO4·7 H2O为0.1;丁二酸钠为4.7;KNO3为2;NaNO2为0.5.微量元素溶液2 m L.
微量元素溶液成分(g/L):EDTA为50.0;ZnSO4为2.2;CaCl2为5.5;MnCl2·4H2O为5.06;FeSO4·7 H2O为5.0;CuSO4·5H2O为1.57;CoCl2·6H2O为1.61.p H为7.0~7.5.
反硝化测定培养基:不添加KNO3和NH4Cl,初始亚硝酸氮质量浓度为100 mg/L,其它与反硝化细菌富集分离培养基基本一致.
脱氨氮测定培养基:不添加 KNO3和Na NO2,(NH4)2SO4代替NH4Cl,(NH4)2SO4和丁二酸钠含量随实验内容而变,其它与反硝化细菌富集分离培养基基本一致.
1.2 实验方法
1.2.1 菌株的富集分离纯化 称取1 g土样接种到装有四粒玻璃珠和100 m L灭菌的反硝化细菌富集分离培养基的250 m L锥形瓶中,锥形瓶用九层纱布封口,在30℃、180 r/min的摇床中振荡48 h.经过四次重复的富集后,取0.5 m L进行10倍梯度稀释到10-7,从10-5到10-7分别取100 u L进行平板涂布于30℃电热恒稳培养箱培养48 h.通过四次平板划线得到三株纯化的菌株,分别命名为WIT-1、WIT-2和WIT-3.
1.2.2 好氧反硝化菌株脱NO2--N的测定 在3个装有100 m L反硝化测定培养基的250 m L锥形瓶中,以体积分数30%的接种量分别加入富集扩大培养后的菌液WIT-1、WIT-2和WIT-3,锥形瓶置于30℃、180 r/min的摇床上振荡培养,每隔2 h取1次样测定亚硝酸盐氮的浓度,并计算亚硝酸盐氮的减少量及去除率,以时效比指标选择优势菌株[9].用格利斯试剂定性测定去除亚硝酸盐氮过程中是否有硝态氮产生.
1.2.3 供试菌株的形态观察 细菌形态观察根据《微生物学实验》进行鉴定[10].
1.2.4 16S r DNA序列分析 用于16S r DNA PCR反应的通用引物是27F和1492R,其中27F为5'-GAGTTTGATCCTGGCTCAG-3',1492R为5'-CGGTTACCTTGTTACGACTT-3',都由南京金斯瑞生物科技公司合成.测序也由南京金斯瑞生物科技公司完成.将16S r DNA所测序列通过BLAST检索程序与GenBank中已知16S r DNA序列进行比对分析.
1.3 供试菌株的脱氨氮特性的研究
1.3.1 供试菌株在不同的COD浓度下脱氨氮过程的测定 以丁二酸钠为碳源,分别配制COD为500 mg/L,1 000 mg/L,2 000 mg/L,氨氮为90 mg/L的培养基.250 m L锥形瓶分装100 m L培养液,接种扩大培养后的供试菌株菌液2%(v/v),置于30℃、180 r/min的摇床上振荡培养.分别在培养0、6、12、24、48 h取样,用Sigma离心机离心5 min,转速8 000 r/min,取上清液测定其COD和氨氮含量.
1.3.2 供试菌株脱氨氮最适碳源种类试验分别以葡萄糖、蔗糖、乙酸钠、柠檬酸三钠、丁二酸钠为碳源,配制C/N质量比为2∶1,氨氮为100 mg/L的培养基.250 m L锥形瓶装液量、接种量、培养条件、离心参数等同1.3.1,在培养12 h和24 h测定其氨氮的去除率.
1.3.3 供试菌株脱氨氮最适温度试验 以丁二酸钠为碳源,配制COD为500 mg/L、氨氮为100 mg/L的培养基.250 m L锥形瓶装液量、接种量、离心参数等同1.3.1,培养温度分别设定为20、25、30、35、37°C,摇床转速为180 r/min,在分别培养12和24 h测定其氨氮的去除率,48 h测定其COD去除率.
1.3.4 供试菌株脱氨氮最适p H试验 培养温度为30℃,初始p H分别为6.0、6.5、7.0、7.5、8.0,其他试验设计同1.3.3.
1.3.5 供试菌株对氨氮质量浓度的耐受性试验
以丁二酸钠为碳源,配制COD为500 mg/L,初始氨氮质量浓度分别为100、200、300、400、500、600、800、1 600、2 000 mg/L的培养基.250 m L锥形瓶装液量、接种量、培养条件、离心参数等同1.3.1,在培养24 h测定其氨氮的去除率.
1.4 检测方法
NH4+-N:纳氏试剂光度法[11];
NO-2-N:N-(1-萘基)-乙二胺光度法[11];
COD:重铬酸钾法[11];
定性NO-3-N:格利斯试剂[12].
2 结果与讨论
2.1 好氧反硝化菌株脱NO-2-N的测定
由图1可知,在一定时间内,菌株WIT-1和WIT-2对亚硝酸盐氮有很好且较为稳定的去除效果.在去除亚硝酸盐氮过程中,经格利斯试剂定性测定WIT-1、WIT-2和WIT-3无硝态氮产生.可以判断菌株WIT-1、WIT-2和WIT-3为好氧反硝化菌株.比较WIT-1、WIT-2和WIT-3三条曲线,经计算菌株WIT-1、WIT-2和WIT-3在4 h对NO-2-N的去除率分别为99.995%、99.958%、33.082%,在10 h内菌株WIT-3对NO-N的去除率为99.999%.以时效比指标选择去除亚硝酸盐氮高优势菌株,菌株WIT-1能在短时间内去除亚硝酸盐氮.其次是菌株WIT-2和WIT-3.选择菌株WIT-1为进一步试验的供试菌株.

图1 好氧反硝化菌株的NO-N的降解曲线Fig.1 Degradation curves of nitrite nitrogen of aerobic denitrification strain注:图中数据为3次重复试验结果的平均值,以下同.
2.2 菌株WIT-1形态观察和16S r DNA序列分析
通过形态观察,菌株WIT-1为革兰氏阴性菌,杆状,菌落为淡黄色,经16S r DNA序列分析,菌株WIT-1序列全长1 395 bp,其16S r DNA基因序列与Pseudomonas stutzeri亲缘关系最为接近,相似性达99%,初步鉴定菌株WIT-1为施氏假单胞菌(Pseudomonas stutzeri).
2.3 菌株WIT-1的脱氨氮特性
2.3.1 菌株WIT-1在不同的COD浓度下脱氨氮过程的测定 菌株WIT-1在不同的COD质量浓度下脱氨氮过程的试验结果如图2(a)、2(b)、和2(c).从图可知,去除氨氮过程中同时也能降低COD,且COD的降解率为62.48%~95.34%.整个过程用N-(1-萘基)-乙二胺法和格利斯试剂定性检测,无NO-N、NO2--N的积累.比较图2(a)、2(b)和2(c)发现,菌株WIT-1对氨氮降解趋势一致,12 h能达到97.37%左右,之后的24、48 h氨氮维持平衡.由实验结果可知,对氨氮测定时间是12 h和24 h,而对COD测定时间为48 h.考虑到经济因素和现实生活污水的COD为200~600 mg/L,所以对起始COD含量设定为500 mg/L.
2.3.2 菌株WIT-1脱氨氮最适碳源种类试验
菌株WIT-1脱氨氮最适碳源种类试验,发现菌株WIT-1能够利用多种碳源进行脱氨氮.由图3可知,在12 h以丁二酸钠为碳源其对氨氮的去除率最高为34.12%.在24 h分别以蔗糖、乙酸钠、丁二酸钠为碳源其对氨氮的去除率都达到了100%.所以,丁二酸钠为菌株WIT-1的最适碳源.王弘宇[13]等报道的两株异养硝化细菌利用丁二酸钠为碳源对氮素有较高的去除率.
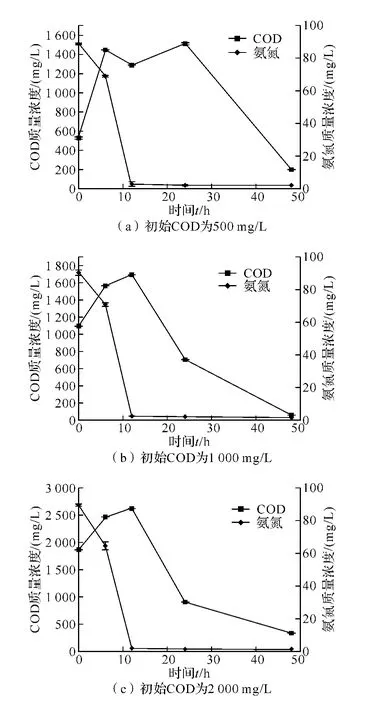
图2 菌株WIT-1不同初始COD条件下去除氨氮和COD测定Fig.2 Determination of strain WIT-1 removing ammonia and COD under different initial COD

图3 菌株WIT-1不同碳源条件下去除氨氮的测定Fig.3 Determination of strain WIT-1 removing ammonia under different carbon sources
2.3.3 菌株WIT-1脱氨氮最适温度 在不同的温度条件脱氨氮的试验表明,菌株WIT-1在25~37℃之间时,能够最大程度地去除氨氮,24 h氨氮的去除率在97%左右.WIT-1在20℃时,虽然能够最大程度地去除 COD,其去除率为82.99%,但是其24 h氨氮的去除率只有64.7%.说明低温不利于菌株WIT-1脱氨氮.在30℃时,其去除COD的能力高于25、35和37℃,COD去除率为70.73%.综合考虑菌株脱氨氮同时去除COD的能力,菌株WIT-1的最适温度为30℃.这与文献[6]报道的Alcaligenes faecalis菌株的最适反应温度一致.
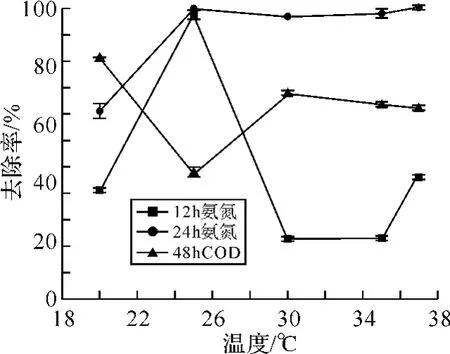
图4 菌株WIT-1不同温度条件下去除氨氮和COD的测定Fig.4 Determination of strain WIT-1 removing ammonia and COD under different temperatures
2.3.4 菌株WIT-1脱氨氮最适p H值 在不同初始p H值条件下脱氨氮的试验表明,菌株WIT-1在p H值为7.0~7.5之间时,能够最大程度地去除氨氮,24 h氨氮的去除率在100%.这说明该菌株在脱氨氮时适应于中性略偏碱性的环境.菌株WIT-1在p H值为6.5时,虽然能够最大程度地去除COD,其去除率为89.98%,但是其24 h氨氮的去除率只有76.55%.综合考虑菌株脱氨氮同时去除COD的能力,菌株WIT-1的最适p H值为7.5.这与文献[14]报道的具有异养硝化功能的恶臭假单胞菌脱氨氮最适p H值相近.

图5 菌株WIT-1在不同p H条件下去除氨氮和COD的测定Fig.5 Determination of strain WIT-1 removing ammonia and COD under different p Hs
2.3.5 菌株WIT-1对氨氮浓度的耐受性试验不同初始氨氮条件下菌株WIT-1去除氨氮试验结果表明,随着初始氨氮浓度的增加氨氮除去率在下降.当初始氨氮的含量小于800 mg/L时,其对氨氮的降解率为18.5%~97.67%,相应的去除量为54.33~179 mg/L.当初始氨氮的含量2 000 mg/L时,其对氨氮的降解率为0.这有可能是C/N的质量比引起其菌株WIT-1对氨氮浓度的耐受性降低.

图6 菌株WIT-1不同初始氨氮条件下去除氨氮的影响Fig.6 Effect of strain WIT-1 removing ammonia under different initial ammonia
3 结 语
a.菌株WIT-1是一株好氧反硝化细菌,同时也是异养硝化细菌.
b.菌株WIT-1为革兰氏阴性菌,杆状,菌落为淡黄色,初步鉴定菌株WIT-1为施氏假单胞菌(Pseudomonas stutzeri).
c.菌株WIT-1能在去除氨氮过程中同时也能降低化学需氧量.
d.菌株WIT-1不同碳源种类下菌株的脱氨氮能力大小排列为:丁二酸钠>乙酸钠>蔗糖>葡萄糖>柠檬酸三钠.
e.菌株WIT-1除氨氮和COD的最适初始p H为7.5,最适温度为30℃.在最适条件下,24 h对氨氮的降解率可以达到100%,48 h对COD的降解率为73.44%.
f.菌株WIT-1对氨氮的耐受性为2 000 mg/L.
虽然已分离得到较好的一株异养硝化-好氧反硝化细菌WIT-1,但其硝化与反硝化作用机理,以及其作用过程中的酶的影响和如何用菌株WIT-1构建SND反应,还需要进一步的探讨和研究.
[1] Szewczyk K W,Kuron'-Kulig A.Simultaneous nitrification and denitrification in a new air-lift reactor[J].Journal of Biotechnology,2007,131(2):S148.
[2] Voytek M A,Priscu J C,Ward B B.The distribution and relative abundance of ammonia-oxidizing bacteria in lakes of the Mc Murdo Dry Valley,Antarctica[J].Hydrobiologia,1999,401:113.
[3] Robertson L A,Cornelisse R,Vos P D,et al.Aerobic denitrification in various heterotrophic nitrififiers[J].Antonie Van Leewwenhoek,1989,56(44):289-299.
[4] 周少奇,周吉林.生物脱氮新技术研究进展[J].环境污染治理技术与设备,2000,12,1(6):11-17.
[5] Daum M,Zimmer W,Papen H,et al.Physiological and Molecular Biological Characterization of Ammonia Oxidation of the Heterotrophic Nitrifier Pseudomonas putida[J].Current Microbiology,1998,37:281-288.
[6] Joo H S,Hirai M,Shoda M.Characteristics of Ammonium Removal by Heterotrophic Nitrification-Aerobic Denitrification by Alcaligenes faecalis No.4[J].Journal of Bioscience and Bioengineering,2005,100:184-191.
[7] Khardenavis A A,Kapley A,Purohit H J.Simultaneous nitrification and denitrification by diverse Diaphorobacter sp[J].Appl Microbiol Biotechnol,2007,77:403-409.
[8] 苏俊峰,马放,高珊珊,等.好氧反硝化细菌处理硝酸盐废水的研究及微生物群落结构分析[J].应用基础与工程科学学报,2008,2,16(1):30.
[9] 蔡昌凤,梁磊.高效好氧反硝化细菌的筛选及脱氮特性的研究[J].环境科学与技术,2011,34(1):42.
[10] 沈萍,陈向东.微生物学实验[M].4版.北京:高等教育出版社,2007:81.
[11] 国家环保局《水和废水监测分析方法》编委会编.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002:211-281.
[12] 李阜,喻子牛,何绍江.农业微生物学实验技术[M].北京:中国农业出版社,1996:87-88.
[13] 王弘宇,马放,杨开,等.两株异养硝化细菌的氨氮去除特性[J].中国环境科学,2009,29(1):47-52.
[14] 黄钧,杨航,牟丽娉,等.异养硝化-好氧反硝化菌株DN1.2的脱氮特性研究[J].高技术通讯,2009,19(2):213-218.
Identification and characteristics of aerobic denitrification strain WIT-1
ZHANG Kai1,LEI Meng-jie1,HU Guo-yuan1,YUAN Jun1,YANG Yang1,ZHANG Jian-guo2
(1.Hubei Key Lab of Novel Reactor &Green Chemical Technology,Key Lab for Green Chemical Process of Ministry of Education,School of Chemical Engineering and Pharmacy,Wuhan Institute of Technology,Wuhan 430074,China;
2.School of Biotechnology and Food Engineering,Hefei University of Technology,Hefei 230009,China)
A aerobic denitrification strain was isolated from soil of nursery garden of Wuhan Institute of Technology,named as WIT-1.The strain WIT-1 was Gram negative,belonging to Bacillus,blond of bacterical colony.The result of 16S r DNA sequences showed that the strain WIT-1 was firstly identified as Pseudomonas stutzeri.The effects of different carbon sources,C/N,p H and temperature on the strain WIT-1 were detected.The results showed that the strain WIT-1 has the capability of removing ammonia and COD synchronously without accumulation of nitrate or nitrite.The comparison results of the ability to remove ammonia of the strain WIT-1 by different carbon sources showed in descending order as follow:sodium succinate,sodium acetate,sucrose,glucose,trisodium citrate.The optimum conditions for the strain WIT-1 of removing ammonia and COD were p H 7.5 and 30℃.In the optimum conditions,the removal rate of ammonia was 100%in 24 h,and the removal rate of COD was 73.44%in 48 h.
aerobic denitrification;heterotrophic nitrification;Pseudomonas stutzeri;ammonia
张 瑞
Q939.9
A
10.3969/j.issn.1674-2869.2011.11.004
1674-2869(2011)11-0014-05
2011-09-30
湖北省新型反应器与绿色工艺重点实验室开放基金(RGCT201101)
张 凯(1985-),男,湖北武汉人,硕士研究生.研究方向:应用化学.
指导老师:胡国元,男,教授,博士,硕士研究生导师.研究方向:环境微生物.*通信联系人
