分子印迹技术与固相微萃取技术联用的研究进展*
2011-11-08李文超王永花杨绍贵
李文超 王永花 孙 成 杨绍贵**
(1.污染控制与资源化研究国家重点实验室,南京大学环境学院,南京,210093;2.浅水湖泊综合治理与资源开发教育部重点实验室,河海大学环境学院,南京,210098)
分子印迹技术与固相微萃取技术联用的研究进展*
李文超1王永花2孙 成1杨绍贵1**
(1.污染控制与资源化研究国家重点实验室,南京大学环境学院,南京,210093;2.浅水湖泊综合治理与资源开发教育部重点实验室,河海大学环境学院,南京,210098)
固相微萃取技术是一种广泛使用的样品前处理技术,涂层是固相微萃取技术的核心部分.目前商品化的涂层缺乏选择性,易受基质干扰,不适合复杂环境基质中痕量有机污染物的分析.分子印迹聚合物是一种具有强大分子识别功能的材料,具有高效的选择特异性,将其作为固相微萃取涂层,可提高其选择性,扩大其应用范围,是目前固相微萃取涂层的研究热点之一.本文介绍了分子印迹技术的基本原理,综述了近年来国内外分子印迹技术与固相微萃取技术联用的研究进展,包括分子印迹固相微萃取装置形式以及方法研究等,最后展望了分子印迹固相微萃取的发展方向.
固相微萃取,分子印迹技术,涂层材料.
固相微萃取(solid-phase microextraction,SPME)技术是1989年由加拿大Waterloo大学Pawliszyn教授的研究小组[1]以固相萃取为基础研发出的一种无溶剂前处理方法.自从20世纪90年代初问世以来SPME发展日臻成熟,由于它具有样品用量少、操作方便、快速等优点,且易与气相色谱(GC)、高效液相色谱(HPLC)、毛细管电泳(CE)、气相色谱-质谱(GC-MS)等常见的色谱仪器联用,从而得到广泛的应用,已成功地应用于气体、水体、土壤/底泥等环境样品中挥发性/半挥发性有机物甚至部分无机物的分析[2].
SPME装置由萃取头(fiber)和手柄(holder)两部分构成,类似于气相色谱微量进样器.SPME的核心部分是萃取头的涂层部分,涂层的厚度和种类在很大程度上决定了方法的灵敏度和选择性.目前,已经商品化的SPME涂层有数十种,但商品化的涂层存在耐高温性能(一般使用温度在240℃—320℃)和耐溶剂性能较差,石英纤维基底易折断、使用寿命短和价格偏高等缺点[3].特别是商品化涂层不具有萃取选择性,不适宜于复杂介质中痕量有机污染物的定量分析,从而限制了其应用范围[4].近年来,研制具有选择性乃至特异性的SPME涂层倍受关注[5].其中分子印迹聚合物(Molecularly Imprinted Polymers,MIPs)涂层由于制备简单、能够反复使用、机械强度较高、耐高温和耐溶剂性好,尤其是具有高效选择特异性的优点,可适用于复杂环境介质中的痕量目标物分析,应用前景广阔[6],已成为选择性固相微萃取涂层研究热点之一.
本文介绍了分子印迹技术的基本原理,并综述了近年来国内外分子印迹技术与固相微萃取技术联用的研究进展.
1 分子印迹技术的基本原理
分子印迹技术(Molecularly Imprinted Technique,MIT)是一种制备具有特定选择性的分子识别材料的新兴技术.分子印迹技术也叫分子模板技术,源于生物学上抗原与抗体的作用机理.即模板分子与功能单体在合适分散介质中依靠相互作用力,如共价键、氢键、离子键、范德华力、疏水作用及空间位阻效应等,形成可逆结合的复合物;加入交联剂后,在光、热、电场等作用以及引发剂和致孔剂辅助下形成既具有一定刚性又具有一定柔性的多孔三维立体功能材料,将模板分子有规律地包在其中;最后用一定方法把模板分子去除,即可获得与模板分子互补有特异识别功能的三维孔穴,该孔穴可特异性识别并与模板分子再结合.图1为MIPs合成过程.
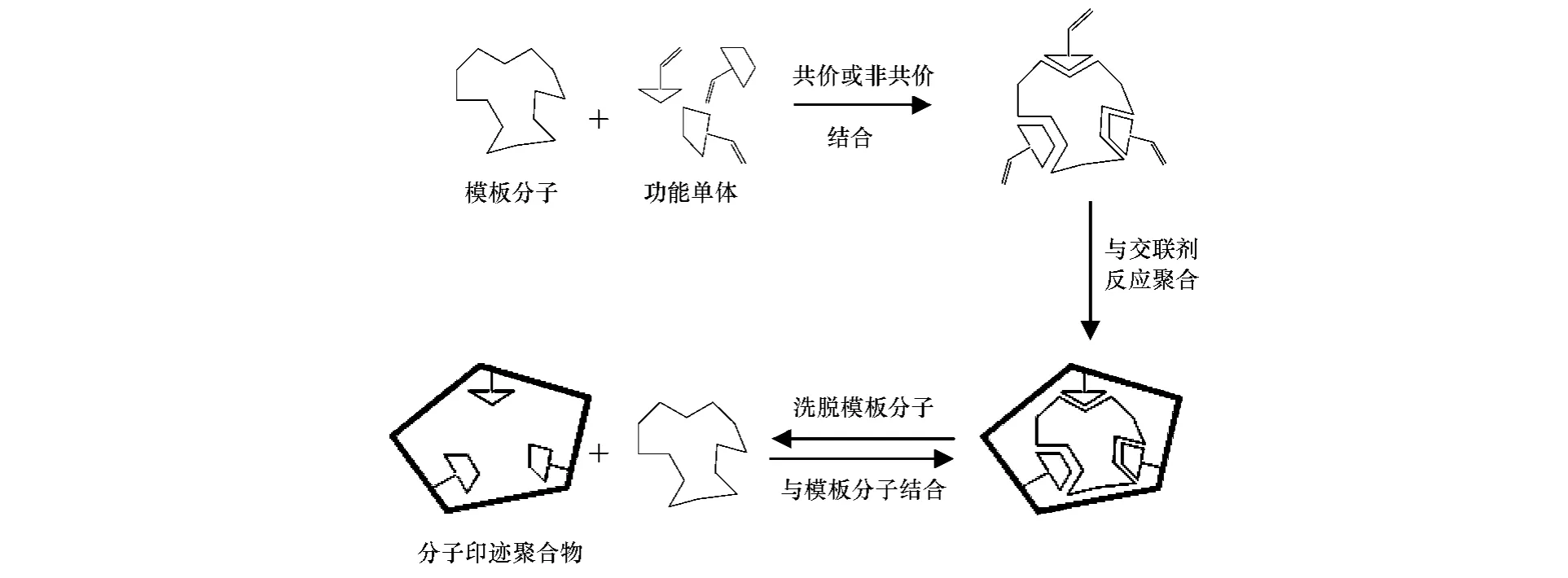
图1 分子印迹示意图[7]Fig.1 The schematic diagram for the synthesis of molecularly imprinted polymers[7]
按照单体与模板分子结合方式的不同,分子印迹技术可分为预组装法和自组装法两种基本方法.预组装法(preorganization)又称共价法,此方法中模板分子首先通过可逆共价键与单体结合生成如硼酸酯和缩酮等可再分解的复合物,然后交联聚合,聚合后再通过化学途径将共价键断裂而除去模板分子.自组装法(self-assembling)又称非共价法,此方法中模板分子与功能单体之间自组织排列,以非共价键自发形成具有多重作用位点的单体-模板分子复合物,经过交联聚合后这种作用保存下来.MIPs的制备方法主要分为以下几种:本体聚合法、沉淀聚合法、原位聚合法、悬浮聚合法、多步溶胀聚合法、表面印迹法、分散聚合法和分子印迹溶胶-凝胶技术[8].
2 分子印迹固相微萃取
分子印迹固相微萃取(Molecularly Imprinted Solid Phase Microextraction,MISPME)将MIPs作为SPME萃取涂层,克服商品化SPME涂层选择性差的缺点,使其既具有SPME高效萃取的优点,又具有MIPs强大的分子识别能力,从而提高复杂环境基体中痕量目标物分析的适用性.下面对MISPME装置形式以及研究方法分别进行论述.
2.1 装置形式
2.1.1 管内 MISPME
管内SPME(In-Tube Solid-Phase Microextraction,In-Tube SPME)是将萃取固定相涂敷于毛细管的内壁上,样品可通过在线连接的HPLC系统进行在线萃取和分离测定.管内MISPME是将MIPs装填于毛细管柱内作为预处理柱.
2001年Mullet等[9]首次将分子印迹技术与固相微萃取相结合,制备以外消旋心得安(一种β-受体阻断剂)为模板分子的MIPs,将MIPs研磨筛分出具有一定粒度大小的颗粒,将其装入聚醚醚酮(PEEK)毛细管中,利用一套自动的在线In-tube SPME/HPLC装置分析尿液中心得安的含量.该涂层与其它管内SPME涂层相比,提高了对心得安的选择性和灵敏度,其检测限低(0.32 μg·mL-1),线性范围较宽(0.5—100 μg·mL-1),重现性较好(相对标准偏差小于5.0%),使用寿命长(约500 次),方法经济简便.但这种装置需要额外的仪器设备如泵和多口进样阀配合使用.因此,有必要研究更为简便的装置形式.
2.1.2 萃取纤维
萃取纤维结构类似于商用的SPME萃取装置.它是将MIPs直接合成在石英纤维或金属丝表面.这是目前MISPME研究的主要装置形式.
2001年Koster等[10]首先报道了纤维状的MISPME装置,用于提取尿液中的克伦特罗.其制备方法是首先将预处理过的石英纤维进行硅烷化,然后将石英纤维放置在预聚合液(模板分子、交联剂、功能单体和引发剂)中,在4℃下350 nm紫外光引发反应12 h,使MIPs直接键合到石英纤维表面,反应后得到厚度为75 μm的MISPME萃取头.该涂层具有高选择性,重现性较好,最低检测线可达10 μg·mL-1.但是,该萃取纤维不能与HPLC联用,不能实现自动化.2007年李攻科等[11]用类似于上述方法合成了扑灭净MIPs涂层,该涂层厚度约为25 μm,并首次与商品化的SPME-HPLC联用测定大豆、玉米、生菜和土壤中 5 种三嗪类除草剂的含量,最低检测限为 0.012—0.090 μg·L-1.2008—2010 年期间,他们[12-14]采用同样的方法分别制备出四环素、心得安和17β-雌二醇MIPs涂层,应用于生物样品的检测,均取得了较好的结果.2009年谭峰[15]等采用一种可以控制涂层厚度的方法制备出双酚A分子印迹涂层.该方法没有使用石英纤维作为基体,而是将较细的石英毛细管插到较粗的石英毛细管中,然后把预聚合液注入两根毛细管之间,毛细管两端用橡皮塞住,在紫外光引发下聚合,反应后除去外层石英毛细管,制备出以石英毛细管为基体的萃取纤维.其制备过程如图2所示.
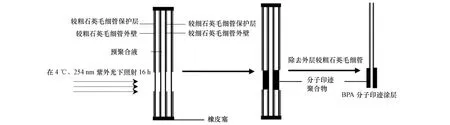
图2 MISPME萃取纤维涂层制备过程示意图[15]Fig.2 Schematic diagram for preparing the MIP-coated SPME fibers[15]
使用4 种不同规格的石英毛细管(内径/外径:0.20 mm/0.32 mm,0.25 mm/0.37 mm,0.32 mm/0.45 mm,0.53 mm/0.69 mm)[15],将 3 种外径分别为 0.32、0.37、0.45 mm 的石英毛细管插入内径为0.53 mm较粗的石英毛细管内,制备出60、100和125 μm 3种厚度的MIPs涂层和直径为530 μm的分子印迹整体材料萃取纤维,并对这4种MIPs涂层的萃取能力进行了比较.研究结果表明,随着MIPs涂层厚度的增加,萃取容量逐渐增加,但达到萃取平衡和解析目标物所需时间也逐渐增加.因此,综合考虑萃取容量和萃取时间两个因素,涂层厚度在60—100 μm之间较为合适.遗憾的是,该装置不能与HPLC联用,且检测限较高,难以用于实际环境样品的检测.
以往研究中大多使用石英纤维作为基体,但石英纤维存在易折断的缺点.2010年Djozan[16]等首次以铝丝为萃取纤维基体,制备出草杀净分子印迹涂层,克服了石英纤维易折断的缺点.该制备方法是先将铝丝进行阳极氧化和硅烷化处理,然后用实验室自制的气压喷雾器将预聚合液喷洒在铝丝上,再将其放在紫外灯下,由紫外光引发聚合10 min.该装置与GC/MS联用,成功应用于井水、大米、玉米和洋葱实际样品中7种三嗪类除草剂的检测.
2.1.3 整体材料
整体材料是一种无需石英纤维作为基体,以MIPs整体材料作为萃取纤维的装置形式.与萃取纤维形式相比,该方法更为简便、易操作.
2007年Djozan[17]等和Turiel[18]等几乎同时报道了这种简单易行的制备方法.其制备方法如图3所示.该方法以熔融石英毛细管或玻璃毛细管为模具,通过微量进样器将预聚合液注入毛细管中,并将毛细管的两端用橡皮封住,一定温度下固化一定的时间,最后去除毛细管模具,得到MIPs涂层.该种方法无需纤维基底,克服了石英纤维容易折断的缺点.
Turiel[18]等用该方法使用不同内径的石英毛细管(0.1、0.25、0.32 和 0.53 mm)制备了扑灭净 MIPs整体材料,并研究了标准溶液中扑灭净的回收率与MIPs整体材料的体积之间的关系.实验结果表明,扑灭净的回收率与MIPs整体材料的体积呈正相关,且线性关系较好(R2>0.99),但其原因还不得而知.选择直径为0.53 mm的纤维用于萃取土壤中的三嗪类农药,所得谱图基线与该涂层萃取标准溶液所得基线一样平整,可见该涂层选择性很强,能够有效地抗基体干扰.Djozan[17]用该方法制备了二乙醯吗啡MIPs整体材料.该纤维在300℃下仍能保持热稳定性,因此可直接与GC或GC/MS联用,用于检测水中二乙醯吗啡的含量,线性范围为350—8000 ng·mL-1,检测限为300 ng·mL-1,因此可直接用于实际样品的检测.此后,2008和2009年[19,20]他们又分别制备了以阿特拉津和莠灭净为模板分子的MIPs整体材料,与GC联用,用于测定自来水、洋葱和大米中7种三嗪类农药.该种装置形式与萃取纤维相比,萃取容量较大,但所需萃取平衡时间较长,且目标分子不容易被洗脱[15].
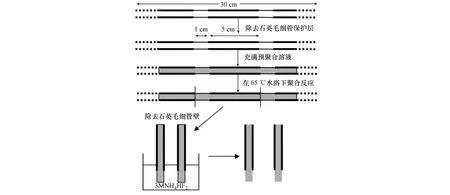
图3 分子印迹涂层的制备[18]Fig.3 Prepration of molecularly imprinted coatings[18]
2.1.4 搅拌棒
SPME搅拌棒(Stir bar sorptive extraction,SBSE)是1999年出现的一种新的固相微萃取方法[21],是一种无溶剂萃取与高强度富集的样品制备方法.与SPME相比,SBSE的萃取涂层体积较大,因此具有更大的萃取容量,但SBSE所需萃取平衡时间较长,同样面临易受到复杂环境基质干扰的缺点[22].目前,商品化的SBSE萃取涂层种类只有聚二甲基硅烷(polydimethylsiloxane,PDMS)一种.以MIPs作为SBSE的萃取涂层(Molecularly Imprinted Stir bar sorptive extraction,MISBSE),可以扩大SBSE的适用范围.目前,MISBSE涂层的研究报导较少.
2006年朱晓兰等人[23]分别制备了以久效磷为模板分子的MISBSE涂层.采用相转换法,将磁芯长为30 mm、PDMS涂层厚度为1 mm的商用搅拌棒浸在30%尼龙-6、3%久效磷和67%蚁酸组成的胶体溶液中,然后将搅拌棒放置在100 mL纯净水中,尼龙-6在水中凝胶化10 min后用10%(V/V)乙酸/甲醇溶液冲洗搅拌棒,除去搅拌棒表面的溶剂和模板分子.该搅拌棒涂层厚度约为180 μm,表面呈多孔型,因此可以快速地达到吸附平衡,且具有较高的选择萃取性,可用于土壤中4种有机磷农药含量的测定.2007年用同样的方法制备出左旋谷酰胺MISBSE涂层[24],可用于测定5种氨基酸.2010年李攻科[25,26]等使用玻璃毛细管,分别以雷托帕明和特丁津为模板分子自制了一种MISBSE涂层.其制备方法是:首先将一根直径1 mm、长15 mm的玻璃毛细管的一端先用丙烷火焰烧结,再将玻璃管外表面经过预处理后进行硅烷化处理,然后放置在装有预聚合液的试管中,于60℃水浴条件下反应90 min,使MIPs涂层合成在玻璃毛细管的外表面,反应结束后将磁铁插入玻璃毛细管中,用丙烷火焰将另一端烧结.最终玻璃毛细管的两端被烧结成球型,这种自制的搅拌棒形状类似于哑铃型.雷托帕明MISBSE涂层结构均匀,呈多孔状,平均厚度为20.6 μm.实验证明,该涂层与非分子印迹涂层相比有更高的萃取能力,稳定性好,反复使用至少40次涂层没有明显损失,涂层置于干燥的空气中8个月萃取能力未见明显降低.将雷托帕明MISBSE与HPLC联用,对雷托帕明、异舒普林和克仑特罗的检测限分别为0.10、0.19和0.21 μg·L-1,可直接用于猪肉、猪肝和饲料中痕量 β2-兴奋剂的检测.用同样的方法制备的特丁津MISBSE涂层,检测大米、苹果、生菜和土壤中9种三嗪类除草剂也取得了满意的结果.同年,林福华等[27]以双酚A为模板分子,使用原位聚合法制备MISBSE涂层,与高效液相色谱(HPLC)-二极管阵列检测器(DAD)联用,探讨其对环境水样中双酚A的选择萃取性能.在最佳条件下,该搅拌棒可对模板分子进行有效的选择性萃取,线性范围为1.0—200 μg·L-1,检出限(S/N=3)和定量限(S/N=10)分别为0.28 μg·L-1和 0.94 μg·L-1.在实际水样分析中,加标回收率为 96.0%—108.7%.研究结果表明,所建方法具有简便、灵敏和环境友好等特点.
2.1.5 其它形式
2005[28]和2006[29]年Yu和Lai报道了以赭曲霉素为模板分子,采用电化学的方法,以铂电极作为对电极,Ag/AgCl作为参比电极,不锈钢套箍作为工作电极,将分子印迹聚吡咯(MIPPy)和碳纳米管(CNT)同时沉积在不锈钢套箍上,在其表面形成了MIPPy/CNT复合膜,并作为一种预富集装置,与HPLC联用测定红酒中赭曲霉素的含量.这种复合涂层既具有较大的绝对比表面积,又具有较高的表面积-体积比,因此具有较高的萃取富集能力,还具有选择性.对3 mL红酒样品浓缩,检测限可达到12 ng·L-1以下.虽然,2006年后再没有此类研究的报道,但是上述研究可为使用电化学方法制备MISPME萃取涂层,将MIPs和纳米材料复合物作为固相微萃取涂层和新型的固相微萃取装置的研究提供了重要依据.
2.2 方法研究
2.2.1 制备方法
目前报道的MISPME装置制备方法主要有:涂渍装填法、原位聚合法和分子印迹溶胶-凝胶法.
涂渍装填法首先合成块状MIPs,然后将其粉碎、研磨、筛分得到具有一定粒度的MIPs颗粒,经溶剂洗脱除去模板分子,并真空干燥后,再将此颗粒物填装到毛细管内.此种方法主要用于制备In-Tube SPME装置.由于该种方法须将MIPs粉碎、研磨等,会对聚合物的空腔造成破坏,降低其选择性,因此除了2001年Mullet等[9]报道过这种方法后,就很少有人研究使用该种方法制备MISPME装置.
原位聚合法是目前制备MISPME装置的主要方法.该方法将MIPs直接合成在毛细管内,制备出整体材料形式的MISPME装置,Djozan研究小组[17,19-20]就是采用这种方法制备出能和GC联用的MISPME装置.李攻科研究小组[11-14]使用该种方法,将MIPs直接合成在经过硅烷化处理的石英纤维表面,并可与商用SPME-HPLC装置联用.经过硅烷化处理后的石英纤维表面含有能与MIPs结合的位点,因此MIPs是通过化学作用键合在石英纤维的表面,而不是简单地涂覆在纤维表面,这种方法使涂层与支撑材料结合更加牢固,从而延长了MISPME涂层的使用寿命.另外,影响原位聚合法制备MISPME涂层主要因素还有功能单体、交联剂和聚合溶剂的种类和比例、聚合时间和聚合温度等.2007年,李攻科[11]的研究中表明,使用不同的聚合溶剂会影响涂层制备的可行性及其形态结构.当使用极性溶剂如丙酮或氯仿作为聚合溶剂时,无法合成出MIPs涂层;当使用乙腈或乙酸乙酯作为聚合溶剂时,制备出的MIPs涂层不均匀;而当使用非极性的溶剂苯或甲苯作为聚合溶剂时,制备得到的MIPs涂层均匀致密,所以最终选择甲苯作为聚合溶剂.聚合时间也是影响涂层厚度以及制备重现性的关键因素[12].聚合时间太短,涂层不均一且薄;聚合时间较长则无法将石英纤维从聚合物中拉出,只有当聚合物呈半固体状态时将石英纤维拉出,才能保证涂层既具有一定厚度,又能保证石英纤维的安全.因此,需要反复实验最终确定合适的聚合时间.
目前使用分子印迹溶胶-凝胶法制备MISPME涂层的报道比较少.分子印迹溶胶-凝胶法利用溶胶-凝胶过程把模板分子引入到无机网络结构中,形成一种刚性材料.分子印迹溶胶-凝胶材料兼顾了溶胶-凝胶和分子印迹二者的优点,克服了分子印迹有机聚合物的刚性与惰性较差的缺点[30].2006王淼[31]等、2009年Maggie Ka-Yi Li[32]等用该种方法,选用正硅酸乙酯(TEOS)作为前躯体,分别制备出联苯和十溴联苯醚(BDE-209)分子印迹固相微萃取头,该萃取纤维可直接与GC联用,分别用于测定市售胶黏剂中的苯及其同系物的含量以及城市废水中多溴联苯醚同系物的含量,均取得了满意结果.
2.2.2 性能研究
对MISPME涂层的性能研究主要包括涂层表征和萃取性能的研究.
涂层表征可通过红外光谱、热重分析、扫描电镜和耐溶剂性等几个方面来考察.如可通过红外光谱推测模板分子与功能单体的结合方式;通过热重分析可考察MIPs涂层的热稳定性;通过扫描电镜可观察涂层形貌;通过耐溶剂性考察可检验MIPs涂层的化学稳定性.李攻科[26]等对雷托帕明分子印迹搅拌棒涂层进行研究时,通过分析比较非分子印迹涂层、洗脱模板分子前后的分子印迹涂层和雷托帕明4个红外谱图推测雷托帕明与功能单体之间只是氢键作用.热重分析表明分子印迹和非分子印迹涂层在220℃下保持热稳定性,因此选择120℃作为老化温度.将搅拌棒分别浸泡在水、甲醇、乙腈、丙酮、氯仿、二甲亚砜、苯、甲苯和10%(V/V)醋酸/甲醇或水中30 min,印迹和非印迹涂层表面均没有明显脱落,溶液中也没有发现残留物,说明该MIPs涂层具有较好的化学稳定性.
萃取性能通过萃取容量、萃取选择性、使用寿命以及与商用SPME涂层或其它萃取方法做比较研究.涂层的萃取容量可通过绘制吸附等温线得到.在一定浓度范围内,MIPs涂层对目标物的萃取量会随溶液中目标物初始浓度的增大而增大,但超过某一浓度时,涂层的萃取量将不会改变,这时的萃取量就是涂层的萃取容量.2008年,李攻科小组[12]研究了自制的四环素MISPME萃取涂层和非分子印迹涂层的萃取容量.当4种四环素混标浓度在2.00—200 μg·L-1范围内,MIPs萃取涂层对4种四环素的萃取量会随初始浓度的增大而增大;当混标浓度在200—800 μg·L-1范围内,随着初始浓度的增大MIPs萃取涂层对土霉素和四环素的萃取量基本保持不变,而对强力霉素和氯四环素的萃取量却逐渐减小,这表明当MIPs涂层达到萃取平衡时,土霉素、四环素与强力霉素、氯四环素之间存在竞争吸附作用.最后经实验得到MIPs涂层对土霉素、四环素、强力霉素、氯四环素的萃取容量分别为110、100、55和60 ng,该萃取容量分别是非分子印迹涂层萃取容量的3.9、3.9、2.4和2.1倍.涂层的萃取选择性通常选择具有相似化学结构的物质来考察.例如,Djozan[19]等选择8种与目标分子具有相似结构的三嗪类除草剂和4种其它结构的杀虫剂来考察阿特拉津分子印迹涂层的选择性.实验表明,该涂层对三嗪类除草剂具有较高的选择性,而对其它杀虫剂没有选择性,与其它类似结构的三嗪类除草剂相比,该涂层对目标分子阿特拉津的萃取有更高的选择性.涂层使用寿命的长短是固相微萃取涂层的一个重要衡量指标.2010年,李全龙[33]对自制的单壁碳纳米管固相微萃取涂层进行了使用寿命的实验研究,比较了使用0、40、80和120次后涂层对苯系物的萃取效率,结果表明使用120次后萃取效率并没有发生明显变化,说明该涂层的使用寿命至少可达120次以上.
2.2.3 研究应用
总结目前报导的有关MISPME的文献,MIPs涂层可成功应用于环境、食物和生物样品中目标物的分析中.根据解析过程不同可分为3种类型:少量溶剂洗脱、商用SPME-HPLC联用装置洗脱和GC进样口热解析.表1列出分子印迹固相微萃取涂层及其应用.
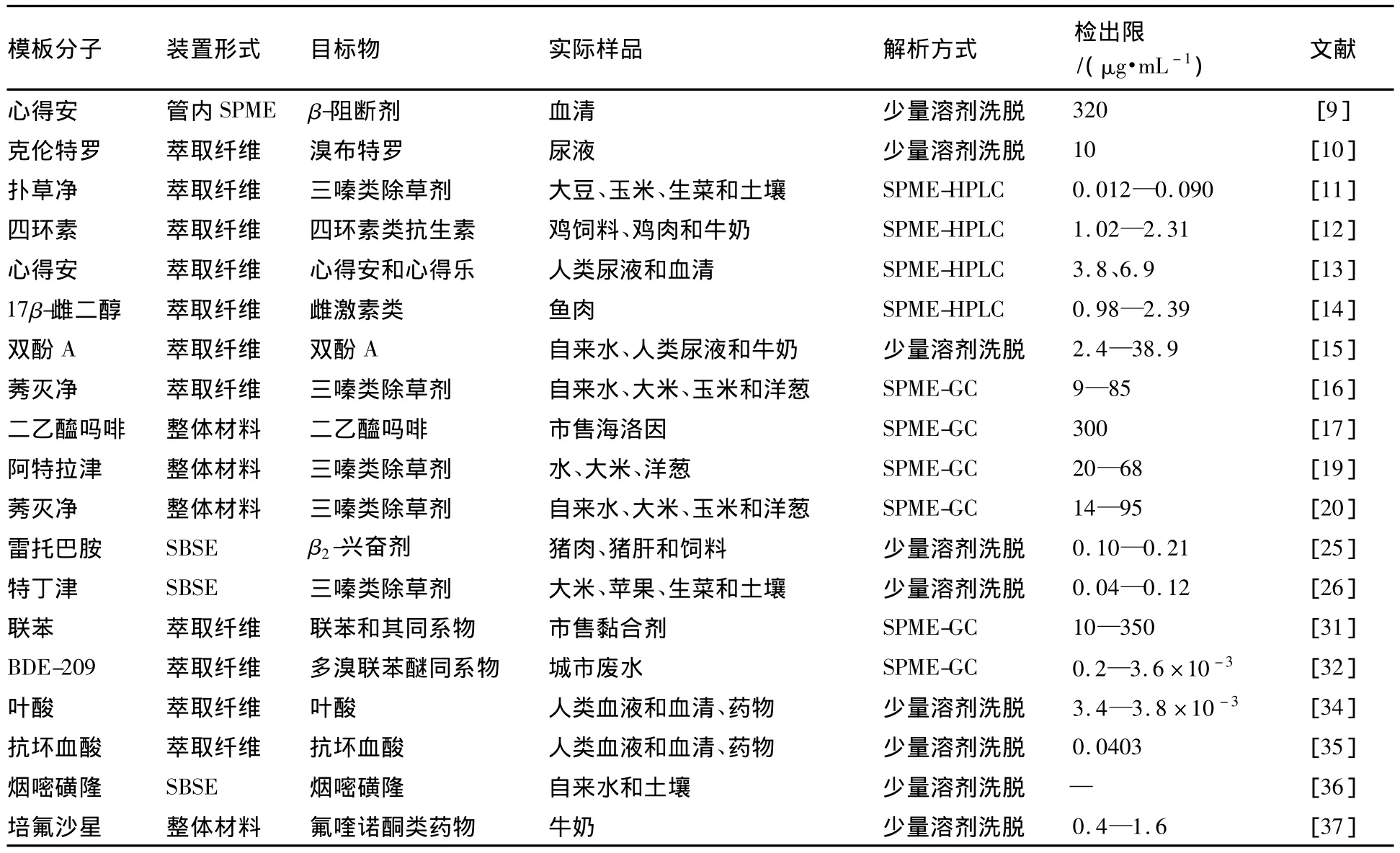
表1 分子印迹固相微萃取涂层及其应用Table 1 Molecularly imprinted solid phase microextraction coatings and their applications
少量溶剂洗脱的方法是将萃取纤维浸泡在少量溶剂中,通过破坏印迹空腔中目标物与聚合物的特异性作用,使目标物被洗脱出来.少量溶剂洗脱是一种离线洗脱方式,最终只有很小部分的洗脱溶剂进入色谱系统用于分析,为降低检测限可采用在线洗脱方式.商用SPME-HPLC联用装置是一种可用于在线洗脱的装置.当萃取过程结束后将萃取纤维插入到解析池中,通过适宜溶剂或流动相的冲洗使目标物被洗脱,并随流动相直接进入色谱柱和检测器进行分离和测定.由于MIPs涂层具有较好的热稳定性,可以将萃取纤维直接插入到GC进样口,目标物经热解析后被载气送入气相色谱柱和检测器中进行分离和检测.
3 结论与展望
分子印迹技术是提高分析选择性的有力工具.虽然分子印迹技术与固相微萃取技术的联用尚处于初步研究阶段,但已经有很多文献报道了MIPs作为SPME涂层的优越性.由于制备MIPs涂层的方法简便、价格低廉,并且制备出的涂层具有化学稳定性、热稳定性以及很强的选择性,与LC和GC均可联用,适用范围较广,因此MISPME是近年来自制固相微萃取涂层的研究热点.但是,MISPME也存在一定的缺陷[3-4,6].首先,MIPs涂层的识别位点与模板分子之间的作用力主要是靠氢键作用,因此在水溶液或极性溶剂中萃取目标物时,容易受到干扰,影响萃取效率.其次,目前所用于制备MIPs的交联剂和功能单体有限,MIPs涂层的种类还比较少.另外,目前所报道的文献中[10-16,31-35],MISPME萃取纤维大多数以石英纤维为基体,存在着石英纤维易被折断的缺点;MIPs整体材料萃取纤维虽然无需石英纤维为基体,不易被折断,但与色谱联用问题还有待解决.最后,虽然MIPs制备方法较多,但制备MISPME涂层的方法较少,采用一种简单的制备方法来控制涂层厚度的问题还有待进一步研究解决.总之,虽然MIPs涂层有一定的缺点,但是由于其在萃取选择性方面具有其它涂层无法比拟的优势,新型的MIPs涂层以及萃取装置依然是研究热点.
[1]Arthur C L,Pawliszyn J.Solid phase microextraction with thermal desorption using fused silica optical fibers[J].Analytical Chemistry,1990,62(19):2145-2148
[2]傅若农.固相微萃取(SPME)的演变和现状[J].化学试剂,2008,30(1):13-22
[3]陈金美,曾景斌,陈文峰,等.新型固相微萃取涂层的研究进展[J].化学进展,2009,21(9):1922-1929
[4]Turiel E,Martin-Esteban A.Molecularly imprinted polymers for solid-phase microextraction[J].Journal of Separation Science,2009,32(19):3278-3284
[5]黄健祥,胡玉玲,李攻科.选择性固相微萃取涂层的研究进展[J].分析科学学报,2008,24(1):97-102
[6]高会云,何娟,刘德仓.分子印迹技术与固相微萃取技术的联用[J].化学世界,2008(4):252-254
[7]马玉哲,李红霞.分子印迹技术的应用进展[J].化工技术与开发,2009,38(4):20-22
[8]谭淑珍,李革新,李再全.分子印迹技术的研究与应用[J].应用化工,2004,33(4):4-6
[9]Mullett W M,Martin P,Pawliszyn J,In-tube molecularly imprinted polymer solid-phase microextraction for the selective determination of propranolol[J].Analytical Chemistry,2001,73(11):2383-2389
[10]Koster E H M,Crescenzi C,Den Hoedt W,et al.Fibers coated with molecularly imprinted polymers for solid-phase microextraction[J].Analytical Chemistry,2001.73(13):3140-3145
[11]Hu X G,Hu Y L,Li G K.Development of novel molecularly imprinted solid-phase microextraction fiber and its application for the determination of triazines in complicated samples coupled with high-performance liquid chromatography[J].Journal of Chromatography A,2007,1147:1-9
[12]Hu X G,Pan J L,Hu Y L.Preparation and evaluation of solid-phase microextraction fiber based on molecularly imprinted polymers for trace analysis of tetracyclines in complicated samples[J].Journal of Chromatography A,2008,1188:97-107
[13]Hu X G,Pan J L,Hu Y L,et al.Preparation and evaluation of propranolol molecularly imprinted solid-phase microextraction fiber for trace analysis of beta-blockers in urine and plasma samples[J].Journal of Chromatography A,2009,1216(2):190-197
[14]Hu Y L,Wang Y Y,Chen X G,et al.A novel molecularly imprinted solid-phase microextraction fiber coupled with high performance liquid chromatography for analysis of trace estrogens in fishery samples[J].Talanta,2010,80(5):2099-2105
[15]Tan F,Zhao H X,Li X X,et al.Preparation and evaluation of molecularly imprinted solid-phase microextraction fibers for selective extraction of bisphenol A in complex samples[J].Journal of Chromatography A,2009,1216:5647-5654
[16]Djozan D,Ebrahimi B,Mahkam M,et al.Evaluation of a new method for chemical coating of aluminum wire with molecularly imprinted polymer layer.Application for the fabrication of triazines selective solid-phase microextraction fiber[J].Analytica Chimica Acta,2010,674:40-48
[17]Djozan D,Tahmineh B.Preparation and evaluation of solid-phase microextraction fibers based on monolithic molecularly imprinted polymers for selective extraction of diacetylmorphine and analogous compounds[J].Journal of Chromatography A,2007,1166:16-23
[18]Turiel E,Tadeo J L,Martin-Esteban A.Molecularly imprinted polymeric fibers for solid-phase microextraction[J].Analytical Chemistry,2007,79:3099-3104
[19]Djozan D,Ebrahimi B.Preparation of new solid phase micro extraction fiber on the basis of atrazine-molecular imprinted polymer:Application for GC and GC/MS screening of triazine herbicides in water,rice and onion[J].Analytica chimica acta,2008,616(2):152-159
[20]Djozan D,Mahkam M,Ebrahimi B.Preparation and binding study of solid-phase microextraction fiber on the basis of ametryn-imprinted polymer application to the selective extraction of persistent triazine herbicides in tap water,rice,maize and onion[J].Journal of Chromatography A,2009(1216):2211-2219
[21]David F,Sandra P.Stir bar sorptive extraction for trace analysis[J].Journal of Chromatography A,2007,1152(12):54-69
[22]Prieto A,Basauri O,Rodil R,et al.Stir-bar sorptive extraction:A view on method optimisation,novel applications,limitations and potential solutions[J].Journal of Chromatography A,2010,1217(16):2642-2666
[23]Zhu X L,Cai J B,Yang J,et al.Films coated with molecular imprinted polymers for the selective stir bar sorption extraction of monocrotophos[J].Journal of Chromatography A,2006,1131:37-44
[24]Zhu X L,Zhu Q S.Molecular imprinted nylon-6 stir bar as a novel extraction technique for enantioseparation of amino acids[J].Journal of Applied Polymer Science,2008,109:2665-2670
[25]Xu Z G,Hu Y F,Hu Y L,et al.Investigation of ractopamine molecularly imprinted stir bar sorptive extraction and its application for trace analysis of β2-agonists in complex samples[J].Journal of Chromatography A,2010,1217:3612-3618
[26]Hu Y L,Li J W,Hu Y F,et al.Development of selective and chemically stable coating for stir bar sorptive extraction by molecularly imprinted technique[J].Talanta,2010,82:464-470
[27]林福华,黄晓佳,袁东星,等.分子印迹聚合物为涂层的吸附萃取搅拌棒在环境水样双酚A含量测定中的应用色谱[J].色谱,2010,28(5):507-512
[28]Yu Jorn C C,Svetla Krushkova,Lai Edward P C,et al.Molecularly-imprinted polypyrrole-modified stainless steel frits for selective solid phase preconcentration of ochratoxin A[J].Analytical and Bioanalytical Chemistry,2005,382(7):1534-1540
[29]Yu,Jorn C C,Lai Edward P C.Molecularly imprinted polypyrrole modified carbon nanotubes on stainless steel frit for selective micro solid phase pre-concentration of ochratoxin A[J].Reactive& Functional Polymer,2006,66(7):702-711
[30]吕运开,严秀平.分子印迹溶胶-凝胶材料的制备及应用[J].分析化学评述与进展,2005,33(2):254-260
[31]王淼,刘萍,贾金平,等.新型固相微萃取头测定胶粘剂中苯及其同系物[J].环境科学与技术,2006,29(6):43-45
[32]Li M K Y,Lei N Y,Gong C B,et al.An organically modified silicate molecularly imprinted solid-phase microextraction device for the determination of polybrominated diphenyl ethers[J].Analytica Chimica Acta,2009,633:197-203
[33]Li Q L,Ma X X,Yuan D X,et al.Evaluation of the solid-phase microextraction fiber coated with single walled carbon nanotubes for the determination of benzene,toluene,ethylbenzene,xylenes in aqueous samples[J].Journal of Chromatography A,2010,1217(15):2191-2196
[34]Prasad B B,Tiwari M P,Madhuri R,et al.Development of a highly sensitive and selective hyphenated technique(molecularly imprinted micro-solid phase extraction fiber-molecularlyimprinted polymer fiber sensor)for ultratrace analysis of folic acid[J].Analytica Chimica Acta,2010,662:14-22
[35]Prasad B B,Tiwari K,Singh M,et al.Molecularly imprinted polymer-based solid-phase microextraction fiber coupled with molecularly imprinted polymer-based sensor for ultratrace analysis of ascorbic acid[J].Journal of Chromatography A,2008,1198-1199:59-66
[36]Yang L Q,Zhao X M,Zhou J.Selective enrichment and determination of nicosulfuron in water and soil by a stir bar based on molecularly imprinted polymer coatings[J].Analytica Chimica Acta,2010,670:72-77
[37]Zheng M M,Gong R,Zhao X,et al.Selective sample pretreatment by molecularly imprinted polymer monolith for the analysis of fluoroquinolones from milk samples[J].Journal of Chromatography A,2010,1217:2075-2081
THE DEVELOPMENT OF MOLECULARLY IMPRINTED TECHNIQUE COUPLED WITH SOLID PHASE MICROEXTRACTION
LI Wenchao1WANG Yonghua2SUN Cheng1YANG Shaogui1
(1.School of the Environment,State Key Laboratory of Pollution Control and Resource Reuse,Nanjing University,Nanjing,210093,China; 2.School of the Environment,Key Laboratory of Integrated Regulation and Resource Department on Shallow Lakes,Hohai University,Nanjing,210098,China)
Coating is considered to be the key element in solid phase microextraction(SPME)technique as it has been widely used in sample pretreatment.However,currently the commercially available fibers based on nonselective sorbent are lack of selectivity in the extraction and easy to be interfered by environmental matrix.Therefore,they are not suitable for the analysis of organic contaminants in complex environmental matrix.As a kind of material which have strong molecular recognition ability and high specific selectivity,molecularly imprinted polymers can greatly improve the separation capability of microextraction technique and expand the application scope of SPME when used as the coating materials of SPME,which has made it become one of research hotspots of SPME selective coatings.The concept,basic principle and method of molecularly imprinted technique,were introduced systematically,and the recent progress of molecularly imprinted technique coupled with solid phase microextraction,including the type of equipment of molecularly imprinted solid phase microextraction and the reaserch method,were also reviewed in this paper.Future research trends of molecularly imprinted solid phase microextraction(MISPME)were emphasized in the end of this paper.
solid phase microextraction,molecularly imprinted technique,material of coating.
2010年10月27日收稿.
*江苏省环境监测科研基金(No.1011)和Agilent Technologies Foundation(Grant ID 0851和Grant ID 2190)资助.
**通讯联系人,E-mail:yangsg@nju.edu.cn
