激发剂作用下的盐石膏废渣的水化过程
2011-11-08李瑞宁陈丽芳袁青彬王利莎
陈 侠 李瑞宁 陈丽芳 袁青彬 王利莎 刘 迪
(1.天津科技大学海洋科学与工程学院,天津,300457;2.天津市海洋资源与化学重点实验室,天津,300457)
激发剂作用下的盐石膏废渣的水化过程
陈 侠1,2*李瑞宁1,2陈丽芳1,2袁青彬1王利莎1,2刘 迪1,2
(1.天津科技大学海洋科学与工程学院,天津,300457;2.天津市海洋资源与化学重点实验室,天津,300457)
运用Kondo模型,研究了在激发剂硫酸钠作用下盐石膏废渣的水化过程.盐石膏废渣的水化过程分为3个阶段,第1、第3阶段受扩散作用控制;第2阶段受相边界反应控制.分别研究了激发剂溶液浓度和温度对相边界反应阶段水化速率的影响,结果表明,在0—0.60 mol·L-1范围内,增大激发剂溶液浓度可使水化速率常数k增大,在12℃≤T≤34℃范围内,升高温度会使水化速率常数k减小.对盐石膏废渣水化产物的X射线衍射分析表明,水化过程中有复盐Na4Ca(SO4)3生成.复盐作为异质颗粒,降低了二水硫酸钙的成核表面能势垒,加速了水化.
盐石膏,激发剂,水化,相边界反应.
石膏是一种历史悠久的胶凝材料,其广泛应用于建材、化工、医疗、农业等领域[1].盐石膏废渣是石膏型卤水真空制盐过程中由于氯化钠和硫酸钙共同析出而产生的一种固体废弃物,其主要成分以无水硫酸钙为主,兼有二水硫酸钙、氯化钠、氯化镁等.盐石膏废渣含盐量高,无法作为建筑石膏和水泥添加剂直接利用,被盐化企业长年堆积或违规排放,不但占用土地,而且其所含的高盐分对土壤、河流和地下水会造成严重污染,对盐石膏废渣进行资源化处理成为亟待解决的问题.
无水硫酸钙可与水发生水化反应生成二水硫酸钙,但其水化活性较差,相关研究表明[2-5],在无水硫酸钙水化体系中添加激发剂可在短时间内大幅度提高其水化速率,达到良好的水化效果.经过水化处理后的盐石膏废渣,大部分可转化为二水石膏,粒度和强度显著增大,改善分离与洗涤条件,大幅度降低其含盐量,满足制备水泥添加剂与加工成为建筑石膏的要求.应用水化动力学模型可分析胶凝体系的水化进程与水化速率.水泥和混凝土是两类重要的胶凝材料,这两类材料的水化动力学模型长期以来得到了较为系统的研究,Jander[6]、Avrami[7]、Kondo[8]、Krstulovic'[9]等分别针对不同种类的水泥或混凝土体系提出了相应的水化模型,其中Kondo模型运用的范围较广,已被运用于MgO-MgSO4[10]、Al2O3[11]等非水泥混凝土胶凝体系,但针对石膏以及盐石膏的水化模型则鲜有报道.
本文以在激发剂硫酸钠作用下的盐石膏废渣水化过程为研究对象,研究了将Kondo模型运用于这一水化过程的可行性,分析了激发剂添加量、水化温度等条件对水化速率常数的影响,并通过X射线衍射仪分析了水化产物的物相组成.
1 实验部分
1.1 实验原料
盐石膏废渣取自河南,为干态粉状固体,采用GB/T5484—2000中的EDTA滴定法、硫酸钡重量法、银量法等分析方法测定其主要化学成分含量,采用灼烧减量法测定其结晶水含量.该盐石膏废渣的主要化学成分为 CaSO4(含量84.93%)、NaCl(含量7.90%)、MgCl2(含量2.80%),另含有4.12%的结晶水.
1.2 实验仪器
双层玻璃反应器(S212-1L型),巩义予华仪器有限公司;超级恒温水浴(HK-2A型),南京大学应用物理研究所;电热恒温鼓风干燥箱(101-3BS型),天津华北实验仪器有限公司;节能型电阻炉(SX3-4-10型),天津中环实验电炉有限公司.
1.3 实验方法
配制一定浓度的硫酸钠溶液,加入双层玻璃反应器中,以水膏比10∶1(质量比)加入盐石膏,开动搅拌,搅拌速度300 r·min-1,控制在一定的温度下进行盐石膏的水化反应,到达取样时间点后,抽取石膏浆用真空泵抽干水分,用无水乙醇润湿并洗涤石膏固体以终止水化,根据GB/T5484—2000,将水化后的石膏首先在(45±3)℃的干燥箱中烘至恒重,以去除附着水,再将其放入高温炉中,在(230±5)℃下灼烧至恒重,根据灼烧减量计算结晶水的含量与水化率.
2 结果与讨论
2.1 盐石膏的不同水化阶段分析
在研究胶凝体系水化动力学时,相边界反应收缩球状模型(如式(1)所示)和Jander三维扩散球型对称模型(如式(2)所示)是两个常用的模型[12],其将水化物质颗粒看作三维球状,将水化看作是由球型外层向内核的渗透过程.

Kondo认为水化是多种推动力的共同作用过程,在水化的不同阶段,主导的水化推动力与作用机理不同,其整合上述两种模型,提出如式(3)所示的动力学模型以适应整个水化进程[8]:

其中:α:水化率;t:水化时间;k:水化反应速率常数;N:与水化反应机理有关的参数.当0<N<1时,表示水化反应由受成核控制的自动催化反应控制;当N≈1时,表示水化反应由相边界反应控制,此时式(3)近似等于式(1),表明Kondo模型中的相边界反应控制也属于收缩球状模型;当N≥2时,表示水化反应由扩散过程控制.
对式(3)两边取双对数,得式(4):
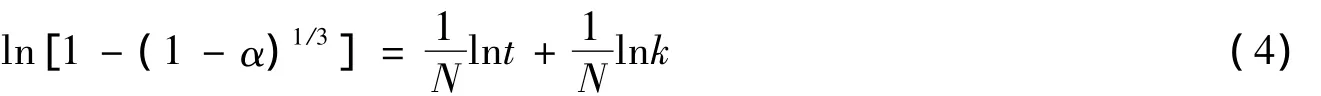
研究盐石膏在0.2 mol·L-1的硫酸钠溶液中的水化过程,由实验测得到达不同时间t时的水化率α,计算 ln[1-(1-α)1/3]值和 lnt值,以lnt为横坐标,以 ln[1-(1-α)1/3]为纵坐标作图,并分段进行线性拟合,如图1所示.

图1 盐石膏水化过程lnt-ln[1-(1-α)1/3]线性拟合Fig.1 Linear regression lnt-ln[1 -(1 - α)1/3]of different stages in the hydration of salt gypsum
由图1可以看出,ln[1-(1-α)1/3]-lnt图线中的数据点有3部分呈现线性关系,分别对应的时间段为0—1 h、6—60 h和72—96 h,通过线性拟合,得出水化过程不同阶段的动力学拟合方程并由方程的斜率和截距求出N值和k值,结果表1所示.
由表1中的k值和N值可以看出,在水化过程中,盐石膏的水化速率常数k先增大后减小,水化第1小时,水化速率较慢,水化速率常数k值为2.46×10-6h-1,N值为3.078,表明此阶段水化反应由扩散过程控制,这是由于在反应初期,无水硫酸钙处于不断溶解的状态,水化体系中Ca2+和SO2-4混合还不均匀,还未形成对二水硫酸钙的过饱和度,在搅拌的作用下通过离子扩散作用逐步达到均一混合状态.水化第6—60小时,水化速率常数k值为4.316×10-3h-1,N值为1.022,表明此阶段水化反应由相边界反应控制,这表明在激发剂的诱导下,经过无水硫酸钙溶解,水化体系中对二水硫酸钙的过饱和度已经形成,在盐石膏颗粒表面与水的界面,发生无水硫酸钙的溶解和二水硫酸钙晶核的析出过程,水分子透过颗粒表面已形成的二水硫酸钙继续向其内部渗透,逐步与内部的无水硫酸钙反应,以提高盐石膏颗粒的水化程度,以最终达到水化平衡.水化第72—96小时,水化速率再次变慢,水化速率常数k值为2.204×10-4h-1,N值为3.658,反应重新回到扩散过程控制阶段,这表明水化反应已进入后期,盐石膏的水化率(以百分率计算)已达到70%左右,再加上盐石膏废渣本身所含结晶水,体系中二水硫酸钙比例已达到80%以上,盐石膏颗粒外层已被致密的二水硫酸钙所包裹,水分子渗透进入颗粒内部与无水硫酸钙反应的速率大幅减小,水化体系逐渐转为二水硫酸钙的溶解平衡状态.而1—5 h,60—72 h这两个时间段是处于3个主要水化阶段之间的过渡段,是不同的水化作用推动力进行相互转化的阶段,由于没有某一种推动力处于主导地位,因此线性关系不明显.

表1 水化不同阶段的线性拟合Table 1 Linear regression of hydration at different stages
通过以上数据拟合和分析可以看出,运用Kondo模型来分析盐石膏的水化动力学过程是可行的.
2.2 激发剂用量对于盐石膏水化的影响
分别配制 0.05、0.10、0.20、0.40、0.60、0.80 mol·L-1的硫酸钠溶液 250 mL.各取 25g 盐石膏,分别以水膏比10∶1,投加到去离子水与上述6种不同浓度的硫酸钠溶液中,于18℃,在300 r·min-1的均匀搅拌下进行水化反应,测定0—48 h的水化率,其水化率变化曲线如图2所示.
由图2可以看出,盐石膏自身的水化活性较差,水化速度慢,其在纯水中水化进行48 h后,水化率(以百分率计算)仅能达到 8.11%,而在 0.05 mol·L-1、0.10 mol·L-1、0.20 mol·L-1、0.40 mol·L-1、0.60 mol·L-1、0.80mol·L-1的硫酸钠溶液中水化 48h 后,盐石膏的水化率(以百分率计算)分别可提高至 28.97%、48.25%、62.02%、74.95%、75.63%、74.40%,水化率得到显著提高.当硫酸钠溶液浓度较低时(0.05—0.2 mol·L-1),在水化初期即前10h,盐石膏的水化速率仍然较慢,而12 h后,水化速率开始增大,当硫酸钠溶液浓度较高时(0.40—0.80 mol·L-1),盐石膏在水化初期即可获得较高的水化速率,水化率迅速增加,当硫酸钠溶液浓度为0.60 mol·L-1时,水化在进行到20 h左右时即可达到平衡态.但当硫酸钠溶液浓度为0.80 mol·L-1时,与0.60 mol·L-1相比,盐石膏的水化率在10 h 后不增反降,达到水化平衡所需时间也有所增加,这表明硫酸钠溶液浓度过大会抑制二水硫酸钙的生成.
由实验结果可以看出,相边界反应是盐石膏水化的主要反应阶段,对其整体水化速度具有重要影响,因此进一步研究在相边界反应阶段激发剂溶液浓度对水化速率常数k的影响.根据(4)式,计算水化第二阶段的 lnt和 ln[1-(1-α)1/3]值,分别拟合激发剂溶液浓度在0—0.60 mol·L-1范围内作用下的lnt-ln[1-(1-α)1/3]曲线,如图3所示.
由图3中线性拟合的方程的斜率和截距,计算出不同浓度激发剂溶液作用下的水化速率常数k和N的值,如表2中所示.从表2中的数据可以看出,不论激发剂溶液浓度高低,N值均在1左右波动,说明这一阶段的水化反应均受相边界反应控制,与激发剂溶液浓度的大小无关;而水化速率常数k的值则随激发剂溶液浓度的增加而增加,这说明在水化温度一定的条件下,在0—0.60 mol·L-1范围内增大激发剂溶液的浓度有利于加速盐石膏废渣的水化.
2.3 水化温度对于盐石膏水化的影响
各取 25g 盐石膏,分别以水膏比 10∶1,投加到 0.60 mol·L-1的硫酸钠溶液中,在 300 r·min-1的均匀搅拌下,分别于12℃、16℃、24℃、28℃、34℃进行水化反应,测定0—10 h的水化率,其水化率变化曲线如图4所示.
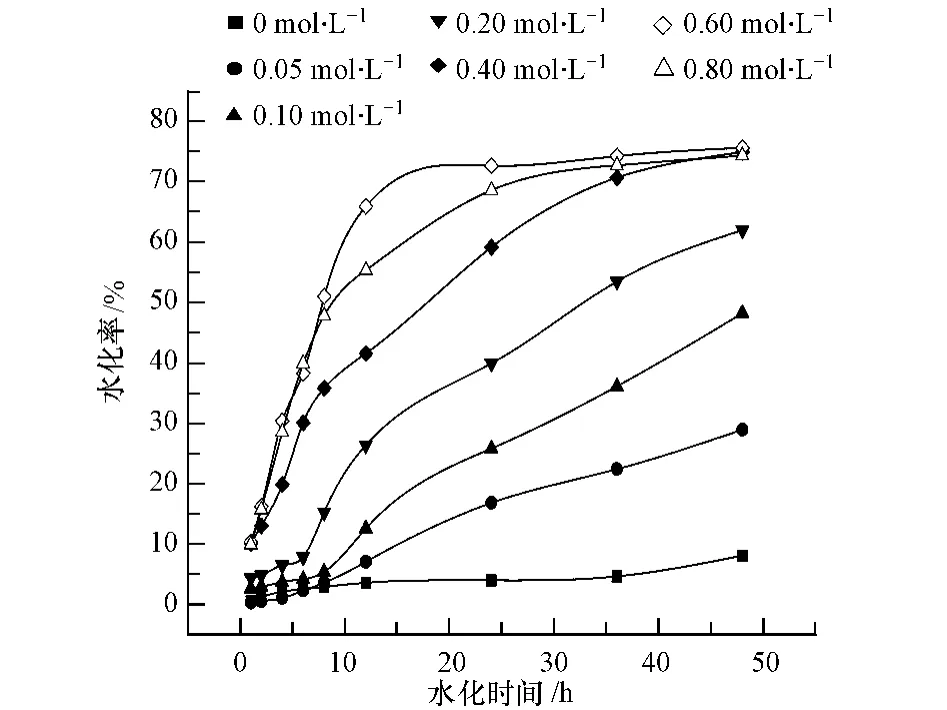
图2 盐石膏在不同浓度激发剂溶液中的水化率Fig.2 Hydration curves of salt gypsum in activator solutions of different concentrations
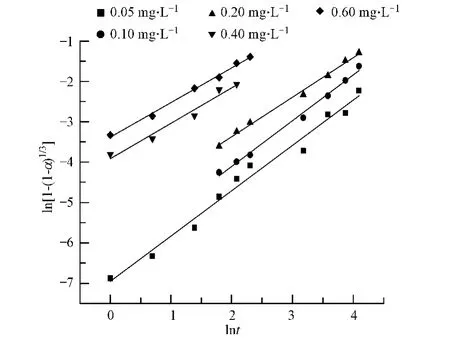
图3 不同激发剂溶液浓度下的lnt-ln[1-(1-α)1/3]线性拟合Fig.3 Linear regression lnt-ln[1 - (1 - α)1/3]at different activation concentrations

表2 不同浓度激发剂溶液作用下的线性拟合Table 2 Linear regression of hydration at different activation concentrations
由图4可以看出,随着水化温度的升高,盐石膏的水化率逐渐降低,在12℃、16℃、20℃、24℃、28℃下进行水化反应10 h后,盐石膏的水化率(以百分率计算)分别为61.91%、55.26%、47.85%、42.36%、28.62%,由此可见,升高温度不利于盐石膏的水化.当温度为34℃时,盐石膏的水化率最高仅能达到6.36%,水化速度大大降低,因此应控制水化温度不超过30℃.石膏的水化活性呈现逆温性,这是由于无水硫酸钙的溶解度随着温度的升高而降低,而二水硫酸钙的溶解度受温度的影响很小,基本维持在0.20 g左右;温度越低,二水硫酸钙的溶解度与无水硫酸钙的溶解度相差越大,体系中形成的二水硫酸钙的过饱和度越大,越有利于二水硫酸钙的析出,随着温度升高,二水硫酸钙的过饱和度逐渐减小,其析出速度逐渐减慢,当无水硫酸钙的溶解度小于二水硫酸钙的溶解度时,水化将无法进行.
研究水化温度对水化速率常数k的影响,根据(4)式,计算水化第二阶段的lnt和ln[1-(1-α)1/3]值,分别拟合不同温度下的lnt-ln[1-(1-α)1/3]曲线,如图5所示.
由图5中线性拟合的方程的斜率和截距,计算出不同温度下的水化速率常数k和N的值,如表3中所示.从表3中的数据可以看出,随着水化温度的升高,N值逐渐增大,在20℃以下时围绕1左右波动,在20℃—30℃之间时,有逐步向1.5增大的趋势,在34℃时已超过1.5,达到1.631;水化速率常数k的值随温度的升高而减小.这是由于随着温度升高,水化体系中对二水硫酸钙的过饱和度减小,二水硫酸钙的生成速率逐渐减慢,在盐石膏颗粒表面发生的反应由水分子透过颗粒表层向颗粒内部渗透的相边界反应逐渐变化为无水硫酸钙在水中通过自身溶解与析出最终达到平衡态的扩散过程,即回到了反应的第一阶段.从N值上来看,其由低温下值为1左右逐渐变化为28℃—34℃时值为1.5左右,这也说明水化反应由低温下的相边界反应转变为高温下的相边界反应与扩散过程并存,并逐步由扩散过程占主导.
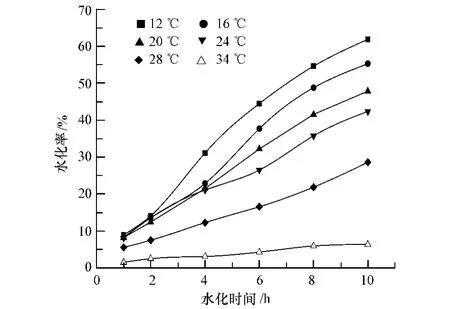
图4 盐石膏在不同温度下的水化率Fig.4 Hydration curves of salt gypsum at different temperatures
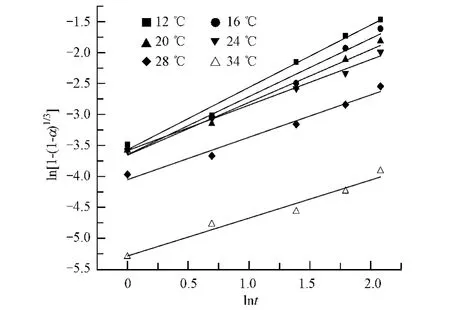
图5 不同温度下的lnt-ln[1-(1-α)1/3]线性拟合Fig.5 Linear regression lnt-ln[1 - (1 - α)1/3]at different temperatures
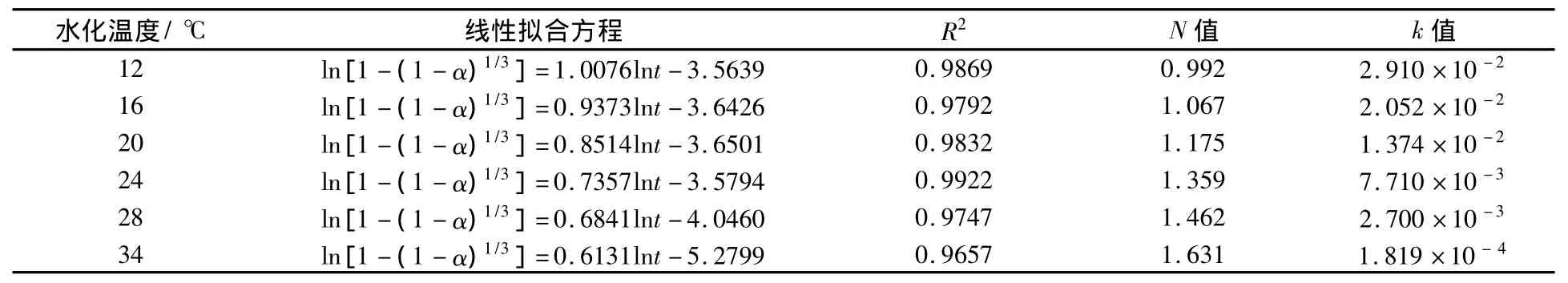
表3 不同温度下的线性拟合Table 3 Linear regression at different temperatures
2.4 水化产物的X射线衍射分析
对在激发剂作用下的盐石膏水化72 h产物进行X射线衍射分析,采用Bruker D8 Advance X射线衍射仪测定盐石膏水化产物的成分,Cu Kα辐射,管电压40 kV,管电流40 mA,扫描步长0.02°·s-1.其XRD谱图如图6所示.
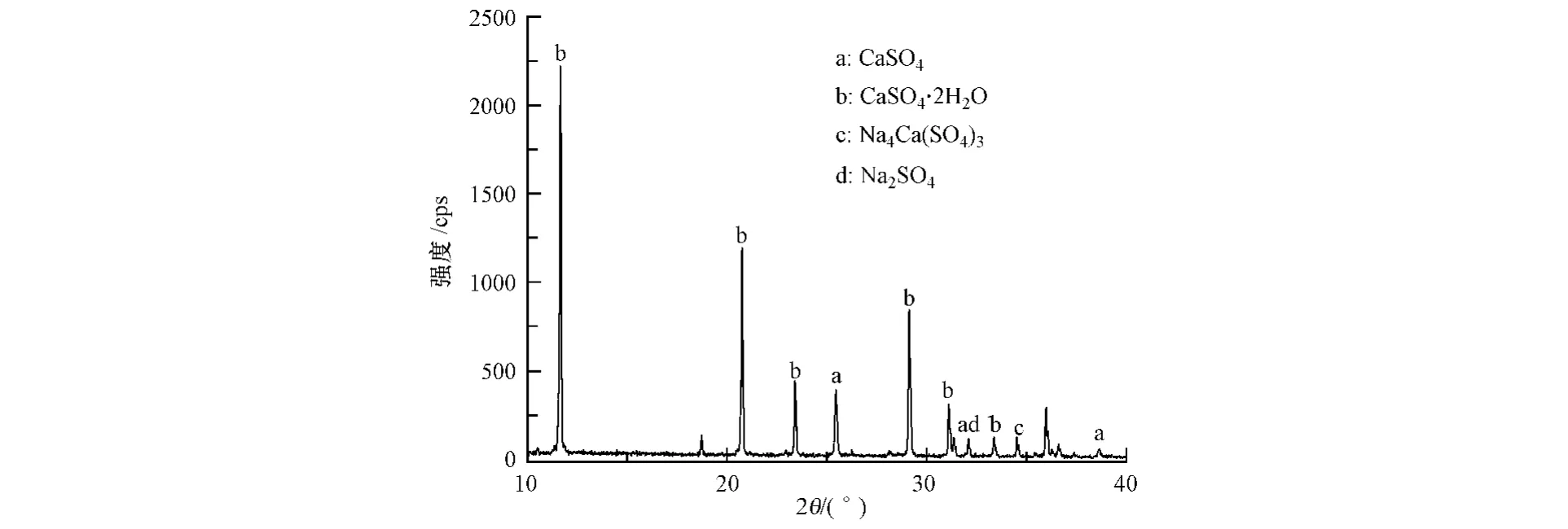
图6 盐石膏水化72 h产物的XRD谱图Fig.6 XRD pattern of the product after 72 h hydration time
由图6 可以看出,经过72 h 水化后,无水硫酸钙的特征峰(2θ=38.66°、31.38°、25.46°)强度明显降低,而在2θ=29.14°、20.76°、11.66°等处出现二水硫酸钙较强的特征峰,表明盐石膏已有最初的以无水硫酸钙占主体转变为以二水硫酸钙占主体.在 2θ=32.12°处,有无水 Na2SO4的特征峰(PDF No.08—0839)的特征峰出现,这是由于水化产物中由于母液夹带而残留的激发剂Na2SO4所致.在2θ=34.53°处,有Na4Ca(SO4)3(PDF No.17—0361)的特征峰出现,这表明在水化进行过程中,CaSO4和Na2SO4反应生成了复盐Na4Ca(SO4)3,复盐微粒有助于降低在相边界反应阶段无水硫酸钙生成二水硫酸钙的成核表面能势垒[13],使二水硫酸钙优先在复盐颗粒表面成核,从而加快无水硫酸钙的水化.
3 结论
(1)利用Kondo模型分析了盐石膏废渣在激发剂作用下的水化过程,其水化过程分为3个阶段,第1、第3阶段受扩散作用控制,体现为无水硫酸钙和二水硫酸钙的溶解过程,第2阶段受相边界反应过程控制,体现为在盐石膏颗粒与水的接触表面,通过无水硫酸钙的溶解和二水硫酸钙晶核的析出和生长发生水化反应.
(2)激发剂对盐石膏废渣的水化有促进作用,激发剂溶液浓度在0—0.60 mol·L-1范围内,水化速率随激发剂溶液浓度的增大而增大,但继续增大激发剂溶液浓度,水化速率会减慢.
(3)水化温度对盐石膏废渣的水化有重要影响,盐石膏的水化活性呈现逆温性,当温度低于30℃时,水化速率随温度的升高而减小,当温度达到34℃时,水化几乎难以进行.
(4)对水化产物进行X射线衍射分析,结果表明:水化产物以二水硫酸钙为主,达到了预期的水化目的;另检测到有复盐Na4Ca(SO4)3存在,复盐微粒降低了二水硫酸钙晶体成核时的表面能势垒,对盐石膏废渣的水化有促进作用.
[1]刘巽伯.胶凝材料:水泥、石灰、石膏的生产和性能[M].上海:同济大学出版社,1990:5
[2]Singh N B.The activation effect of K2SO4on the hydration of gypsum anhydrite,CaSO4(II)[J].Journal of the American Ceramic Society,2005,88(1):196-201
[3]Manjit S,Mridul G.Activation of gypsum anhydrite-slag mixtures[J].Cement and Concrete Research,1995,25(2):332-338
[4]杨新亚,喻德高,王锦华.硫酸钾对无水硫酸钙水化激发机理研究[J].沈阳建筑大学学报(自然科学版),2008,24(1):104-107
[5]高祥鑫,杨新亚,王锦华,等.激发剂对天然硬石膏的适应性研究[J].武汉理工大学学报,2009,31(9):21-24
[6]Jander W.Reactions in the solid state at high temperature[J].Zeitschrift für anorganische und allgemeine Chemie,1927,163(1/2):1-30
[7]Avrami M.Kinetics of phase change.Ⅱ.Transformation-time relations for random distribution of nuclei[J].Journal of Chemical Physics,1940,8(2):212-224
[8]Kondo R,Ueda S.Kinetics and mechanisms of hydration of cement[C].Proceeding of 5th International Symposium On The Chemistry of Cement,Tokyo,1968:224-225
[9]Krstulovic'R,Dabic P.A conceptual model of the cement hydration process[J].Cement and Concrete Research,2000,30(5):693-698
[10]罗建国,姚吉升,孙建鄂.MgO-MgSO4-H2O胶凝体系水化动力学的研究[J].硅酸盐学报,1998,26(2):157-163
[11]刘永杰,孙杰,曹伟.β-Al2O3水化动力学的研究[J].硅酸盐学报,1998,26(6):782-786
[12]胡荣祖,史启桢.热分析动力学[M].北京:科学出版社,2001:127-130
[13]洪广言.无机固体化学[M].北京:科学出版社,2002:58-63
HYDRATION PROCESS OF SALT GYPSUM DREGS UNDER THE EFFECT OF ACTIVATOR
CHEN Xia1,2LI Ruining1,2CHEN Lifang1,2YUAN Qingbin1WANG Lisha1,2LIU Di1,2
(1.College of Marine Science and Engineering,Tianjin University of Science& Technology,Tianjin,300457,China;2.Tianjin Key Laboratory of Marine Resources and Chemistry,Tianjin,300457,China)
The hydration process of salt gypsum dregs under the effect of anhydrous sodium sulfate activator was studied through the Kondo model.The hydration process contained three stages.The first and the third stages were controlled by diffusion,and the second stage was controlled by phase boundary reaction.The influences of the activator concentration and the temperature on the hydration rate were studied.The hydration rate constant k increased with increasing activator concentration in the range from 0 mol·L-1to 0.60 mol·L-1and decreased with the increase of the temperature in the range from 12℃ to 34℃.The X-Ray diffraction analysis indicated that the double salt Na4Ca(SO4)3was generated during the hydration progress.The double salt promoted the hydration as the alloplasm grain to reduce the nucleation surface energy barrier.
salt gypsum,activator,hydration,phase boundary reaction.
2010年12月3日收稿.
* 通讯联系人,Tel:13920675187;E-mail:cx5187@tust.edu.cn
