酶辅助提取紫甘蓝中原花青素的工艺优化
2011-11-02李松林
李松林,汤 彤
(淮阴工学院食品工程系,江苏淮安223003)
酶辅助提取紫甘蓝中原花青素的工艺优化
李松林,汤 彤
(淮阴工学院食品工程系,江苏淮安223003)
以紫甘蓝为原料,在单因素实验基础上,通过中心组合设计和响应面分析法,对酶辅助提取紫甘蓝中原花青素的条件进行研究。确定酶辅助提取的最佳工艺条件是:酶解时间2.5h,酶解温度43.39℃,纤维素酶浓度0.02%,果胶酶浓度0.02%,在此工艺条件下,原花青素的提取率为17.3%。
紫甘蓝,原花青素,酶提取,中心组合设计,响应曲面
1 材料与方法
1.1 材料与仪器
紫甘蓝 购自本地菜市场;葡萄籽原花青素标准品 天津市尖峰天然产物研究开发有限公司;香草醛 天津市光复精细化工研究所;乙醇、甲醇、盐酸 均为分析纯,购于蚌埠化学试剂厂;纤维素酶、果胶酶 张家港市金源生物化工有限公司。
722N可见光分光光度计、FA2004N电子天平上海民桥精密仪器科学有限公司;HH-4数显恒温水浴锅 江苏金坛市荣华仪器制造有限公司;旋转蒸发仪(RE-52) 上海雅荣生化仪器设备有限公司。
1.2 实验方法
1.2.1 原花青素的检测方法 采用香草醛-盐酸法[19]。原花青素提取率的计算公式如下:

1.2.2 紫甘蓝原花青素的酶辅助提取 利用粉碎机对紫甘蓝进行粉碎,加入500mL蒸馏水,加入酶进行水解,过滤后得到的滤液使用旋转蒸发仪蒸干大部分水分,余下的滤液配成500mL 60%的乙醇溶液在60℃条件下浸提,再在50℃条件下用旋转蒸发仪将乙醇蒸出,所剩体积约为原体积的五分之一,过滤后定容,即得提取液。将提取液稀释一定的倍数,测定原花青素的含量。
1.2.3 单因素实验设计 精确称取一定质量紫甘蓝放入锥形瓶中,采用复合酶辅助法提取原花青素,考察酶解时间、酶解温度、纤维素酶的添加量和果胶酶的添加量对原花青素提取率的影响。
1.2.4 紫甘蓝原花青素的酶辅助提取的工艺优化在单因素实验结果的基础上,采用中心组合设计和响应面分析法对酶辅助提取的工艺进行优化。实验因素及水平选取见表1。

表1 酶辅助提取紫甘蓝原花青素实验的因素与水平
2 结果与分析
2.1 影响酶辅助提取原花青素的单因素实验
2.1.1 酶浓度对原花青素提取率的影响 由图1和图2可知,随着酶浓度的增加,原花青素的提取率随之相应增加。但当纤维素酶和果胶酶的浓度分别大于0.016%和0.022%时,原花青素的提取率开始下降。这可能是由于与纤维素酶和果胶酶充分接触的纤维素和果胶质被完全分解,或者由于木质素等物质阻碍了酶与底物的接触所导致的。

图1 纤维素酶浓度对原花青素提取率的影响
2.1.2 酶解时间和酶解温度对原花青素提取率的影响 图3表明,原花青素的提取率随着酶作用时间的延长而增大(纤维素酶添加量为0.016%,果胶酶添加量为0.022%),在作用的前2h提取率增加较快。当酶解时间超过2h后,提取率开始下降。综合考虑,复合酶作用时间以2h为合适。由图4可以看出,随着酶解温度的增高(纤维素酶添加量为0.016%,果胶酶添加量为0.022%),原花青素的提取率逐渐增加,在40℃时到达最高值。但随着温度的继续增加,原花青素的提取率开始下降。这是因为在复合酶的作用下,催化反应的速度随着温度的升高而加快,但酶是蛋白质,可随着温度的升高而变性,且多数变性都不可逆。所以在较高温度下,随着时间的延长,酶逐渐变性,导致提取率降低。故提取温度选择40℃左右较为合适。

图2 果胶酶浓度对原花青素提取率的影响

图3 酶解时间对原花青素提取率的影响
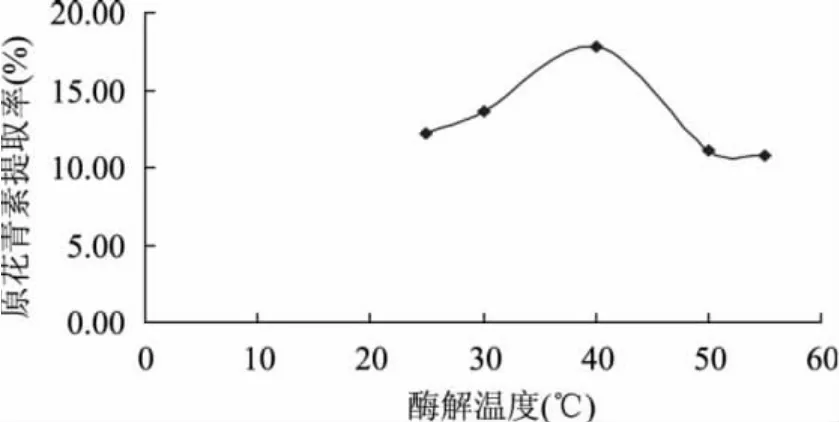
图4 酶解温度对原花青素提取率的影响
2.2 中心组合设计及响应面法优化紫甘蓝原花青素的酶法辅助提取
采用回归正交组合设计,结合单因素实验结果,考察纤维素酶的添加量(X1),酶解温度(X2),酶解时间(X3)和果胶酶的添加量(X4)对提取率(Y)的影响。酶辅助提取原花青素的实验方案与结果如表2所示。利用Design-expert软件对表2数据进行回归拟合,得到紫甘蓝原花青素提取率Y与自变量X1、X2、X3和X4的二次回归方程为:

对该模型进行的方差分析及显著性检验结果见表3。
在置信水平为95%的条件下,当参数的p-value<0.05时,认为此因素或者因素之间的交互作用对于模型的影响是显著的。由表3可知,酶解时间X3、酶解温度X2、纤维素酶的添加量X1、果胶酶的添加量X4及其二次项,以及各因素之间的交互作用(X1X2,X1X3,X2X3,X3X4)对提取率的影响均在显著水平以上。因变量与自变量之间的多元回归关系是高度显著的(复相关系数R2=0.9935),该模型对Y值变化的描述程度为99.35%,且失拟性检验结果为不显著,表明实验设计结果可靠。图5为原花青素提取率的实验数值与二次回归模型预测值之间的比较。从图5中可以看出模型充分覆盖了所研究的实验范围。删除不显著的回归数据项后,重新拟合的最优回归模型为:
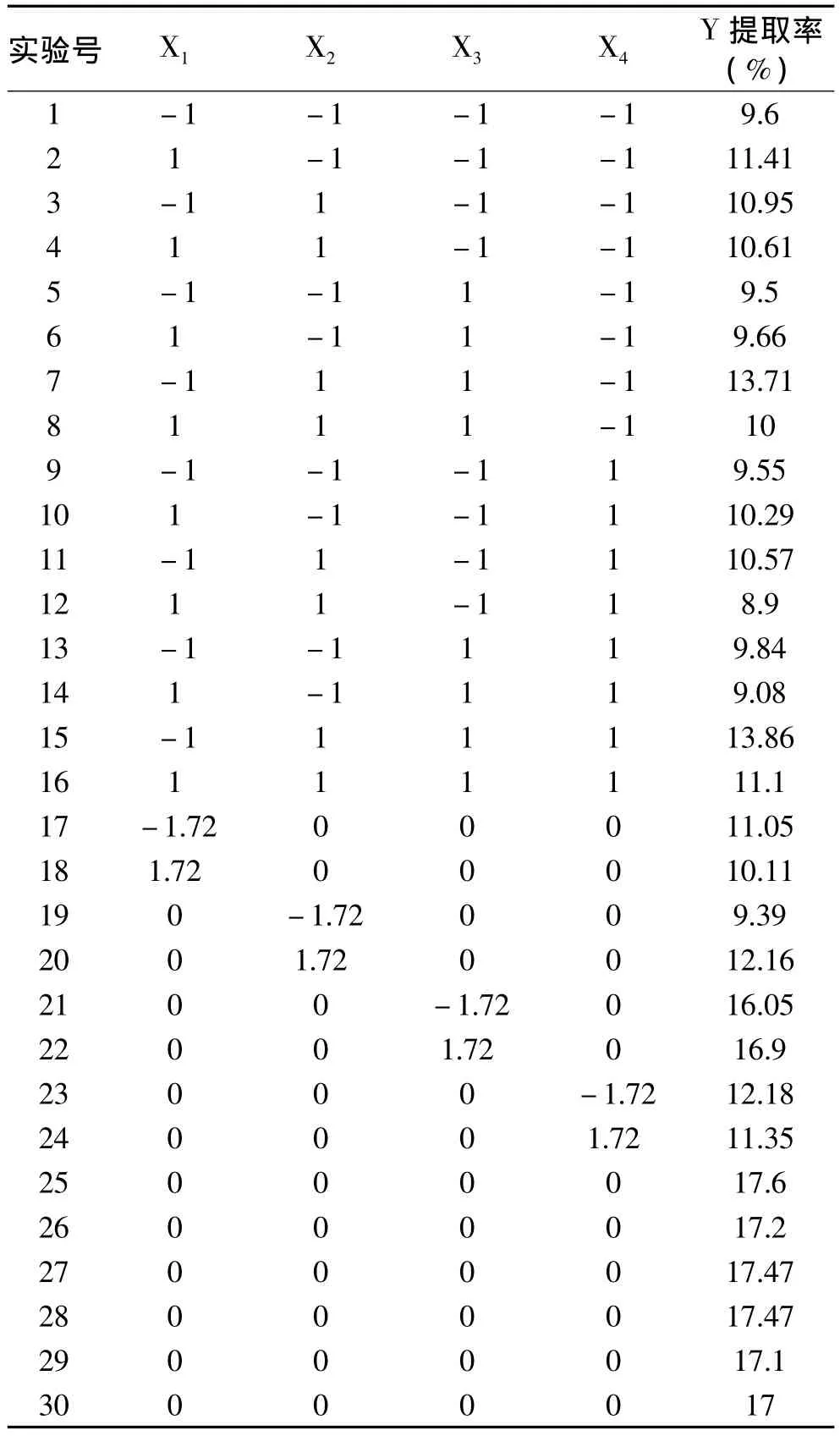
表2 酶法辅助提取紫甘蓝原花青素的正交设计实验方案与结果
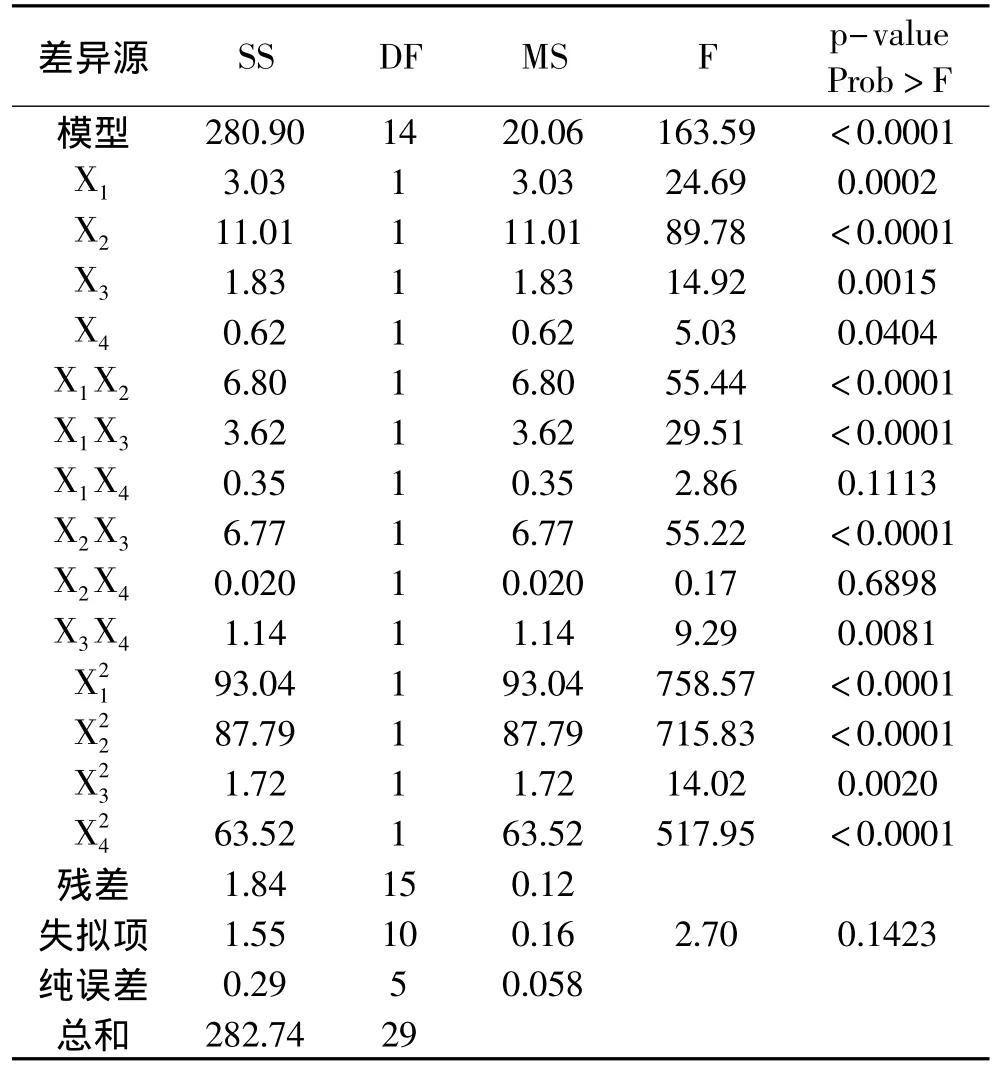
表3 响应面实验方差分析


图5 原花青素提取率的实验数值与二次回归模型预测值之间的比较
图6~图9中的响应面图较好地描述了纤维素酶的添加量(X1),酶解温度(X2),酶解时间(X3),果胶酶的添加量(X4)对原花青素提取率的影响过程。
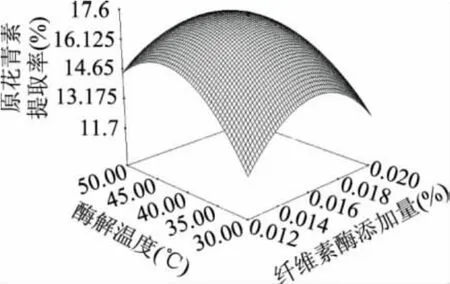
图6 Y=(X1,X2)的响应曲面图
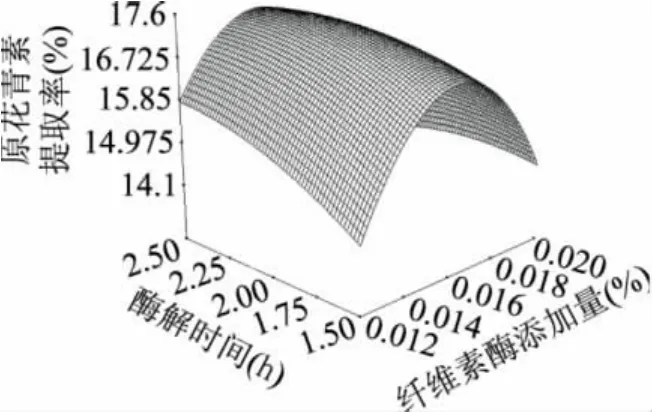
图7 Y=(X1,X3)的响应曲面图

图8 Y=(X2,X3)的响应曲面图
从图6中可以看出,当X1保持一定时,提取率随着X2的升高呈先增后减趋势。当X2一定时,提取率随着X1的增大呈先增后减趋势。图7表示,当X3保持不变时,随着X1的增加,提取率先增大后减小。在图8中,当X3保持一定时,提取率随着X2的增大呈先增后减的趋势。当X2一定时,X3的增加会使提取率不断增大,随后保持稳定。由图9可以看出,当X3一定时,提取率随着X4的增大呈先增后减趋势。当X4一定时,X3的增加会使提取率不断增大,随后保持稳定。

图9 Y=(X3,X4)的响应曲面图
由此可知,原花青素提取率与上述四个因素均存在对应关系。由Design-expert软件分析得出各因素最优水平组合为:X1=0.02,X2=43.39,X3=2.50,X4=0.02,Y=17.6366,即提取率为17.64%。在实际实验中,近似值取X1=0.02,X2=43,X3=2.50,X4= 0.02。在该条件下,实验得原花青素平均提取率为17.3%,误差为1.93%。这说明采用四因素二次回归正交组合设计寻求的最佳工艺条件是可行的。
3 结论
采用中心组合设计和响应面分析法,得到酶辅助法提取紫甘蓝原花青素的最佳工艺条件:酶解时间为2.5h,酶解温度为43.39℃,纤维素酶的添加量为0.02%,果胶酶的添加量为0.02%,此时原花青素提取率为17.3%。用传统溶剂法提取紫甘蓝原花青素时,原花青素提取率仅为10%左右。与其相比,酶辅助提取法是较为有效的方法。但总体来看,提取率仍然较低,这可能是由于紫甘蓝中的原花青素与蛋白质和纤维素呈结合状态,而游离原花青素相对较少。此外紫甘蓝原花青素含量还与紫甘蓝的贮存条件有关,贮存温度的变化或放置时间的长短都会影响原花青素的提取效果,这些都需要进一步的研究。
[1]Kohler N,Wray V,Winterhalter P.Preparative isolation of procyanidins from grape seed extracts by high-speed countercurrent chromatography[J].Journal of Chromatography A,2008,1177:114-125.
[2]Sanoner P,Guyot S,Marnet N,et al.Polyphenol profiles of French cider apple varieties(Malus domestica sp.)[J].Journal of Agricultural and Food Chemistry,1999,47(12):4847-4853.
[3]Jorge M,RicardoI D,Jacques R,et al.Procyahidins dimmers and trimers from grape seeds[J].Phytochemistry,1991,30(4): 1259-1264.
[4]Frankel E N,Kanner J,et al.Inhibition of oxidation of human low-density lipoprotein by phenolic substances in red wine[J]. Lancet,1993,341:454-457.
[5]Adam M.Plant in vitro culture for the production of antioxidants-A review[J].Biotechnology Advances,2008,26: 548-560.
[6]Nothlings U,Schulze M B,et al.Intake of vegetables,legumes,and fruit,and risk for all-cause,cardiovascular,and cancer mortality in a European diabetic population[J].J Nutr,2008,138:775-781.
[7]Takuro K,Kciko,Moro,et al.Increase of antioxidative protentian of rat plasma by oral administration of proanthocyanidin -rich extract from rape seeds[J].Journal of Agricultural and Food Chemistry,1999,47(5):1892-1897.
[8]Rigo A,VianelloI F,ClementiL G,et al.Contribution of proanthocyanidins to the peroxy radical scavenging capacity of some Italian red wines[J].Journal of Agricultural and Food Chemistry,2000,48(6):1996-2002.
[9] Yamagish M,Natsume M.Effects ofcacao liquor proanthocyanidins on Ph IP-induced mutagenesis in vitro,and in vivo mammary and pancreatic tumorigenesis in female Sprague-Dawley rats[J].Cancer Letter,2002,185:123-130.
[10]Laparra J,Michaud J,Masquelier J.ETUDE PHARMA-cocinetique des OLIGOMERES FLAVANOLIQUES[J].Plante,edicinales Phytoterapie,1977(11):133-142.
[11]赵万洲,陆茵,闫新琦,等.葡萄籽原花青素抗促癌作用的实验研究[J].中草药,2000,31(12):917-920.
[12]尤新.天然食用色素和功能[J].中国食品添加剂,2002 (5):1-3.
[13]Cos P,De Bruyne T,Hermans N,et al.Proanthocyanidins in health care:current and new trends[J].Current Medical Chemistry,2004,11(10):1345-1359.
[14]段玉清,谢笔钧.原花青素在化妆品领域的研究与开发现状[J].香料香精化妆品,2002,12(6):23.
[15]Goda Y,Shimizut,Kato Y.Two acylaled anthocyanins of purple sweet potato[J].Phytochemistry,1997,44(1):183-186.
[16]赵文恩,韩桂花,焦凤云.葡萄籽原花色素提取工艺研究[J].食品科学,2002,23(8):108-110.
[17]马玉美,王辉宪,谢聃,等.葡萄籽中原花青素提取、分离纯化研究进展[J].湖南工程学院学报:自然科学版,2006,16 (3):88-90.
[18] Wang HZ,Zhao GR.Enzymatic extraction of active components from radix scutellariae[D]. Tianjin:Tianjin University,2007.
[19]李春阳,许时婴,王璋.香草醛-盐酸法测定葡萄籽、梗中原花青素含量的研究[J].食品科学,2004,25(2):157-161.
Optimization of enzyme-assisted extracting technology of proanthocyanidins from purple cabbage
LI Song-lin,TANG Tong
(School of Food Engineering,Huaiyin Institute of Technology,Huai’an 223003,China)
To optimize proanthocyanidins yield from purple cabbage extracted by enzymatic-assisted technology,single factor experiments followed by central composite design combined with response surface analysis were carried out.Results showed that the optimal enzymatic-assisted extraction,namely using 0.02%cellulase and 0.02%pectinase to extract the powdered material at temperature of 43.39℃ for 2.5 hour,resulted in a proanthocyanidins yield of up to 17.3%.
purple cabbage;proanthocyanidins;enzymatic extraction;central composite design;response surface methodology
TS255.1
B
1002-0306(2011)09-0315-04
紫甘蓝(Brassica oleracea L.var.Capitata DC.)属十字花科芸蔓属,二年生植物,又称紫椰菜、紫苞菜,是结球甘蓝中的一个类型,易种、易采,产量大,通体呈紫红色。紫甘蓝含有丰富的维生素C、较多的维生素B族和维生素E族以及丰富的硫元素。原花青素(Procyanidins)是一类多酚化合物的总称,由不同数量的儿茶素或表儿茶素缩合而成,其基本组成单位是黄烷-3-醇和黄烷-3,4-二醇[1],广泛存在于植物类食品中。各国学者对不同来源的植物原花青素进行了深入的研究[2-3],发现甘蓝中的原花青素具有预防心脏疾病[4]、食品抗氧化[5]、预防心血管疾病[6]等功能,同样也发现葡萄籽中的原花青素具有抗氧化[7]、抗衰老[8]、抗肿瘤[9]等多种生物活性和药理作用[10-15]。因此人们对原花青素的研究越来越重视,寻找新的富含原花青素的资源和适合于工业化提取、检测原花青素的方法是两个研究的热点。原花青素的提取主要采用有机溶剂提取法[16-17],但由于原花青素与紫甘蓝的纤维组织结合较紧密,不容易溶出,导致提取率较低。植物细胞壁主要成分是纤维素、半纤维素和果胶质。使用纤维素酶和果胶酶作用于紫甘蓝,可以使细胞壁及细胞间质中的纤维素、半纤维素、果胶等物质降解,引起细胞壁及细胞间质结构产生局部疏松、膨胀、崩溃等变化,从而增大有效成分的扩散面积,促进有效成分提取率提高[18]。因此,本实验采用纤维素酶和果胶酶对紫甘蓝原花青素进行酶辅助提取及工艺优化,为紫甘蓝的进一步开发和综合利用提供科学依据。
2010-10-08
李松林(1982-),男,博士,讲师,研究方向:食品资源的开发与利用。
