乙醇溶液体系中Span修饰猪胰脂酶的研究
2011-11-02杨国龙毕艳兰孙尚德
曾 俊,杨国龙,毕艳兰,张 洁,孙尚德
(河南工业大学粮油食品学院,河南郑州450052)
乙醇溶液体系中Span修饰猪胰脂酶的研究
曾 俊,杨国龙*,毕艳兰,张 洁,孙尚德
(河南工业大学粮油食品学院,河南郑州450052)
在乙醇-水溶液体系中采用Span系列表面活性剂对猪胰脂酶进行了修饰,以其催化酯交换的交换量为指标衡量修饰的效果,并且比较了修饰酶与未修饰酶的热稳定性差异。结果表明:40℃下30min即可完成Span对猪胰脂酶的修饰,但各种表面活性剂修饰的最佳条件并不相同。Span20修饰脂肪酶的最佳条件是水与乙醇的比例为4∶1(v/v),Span20用量为25%;Span40修饰猪胰脂酶的最佳条件是水与无水乙醇的比例为2∶1(v/v),Span40用量为20%; Span65修饰猪胰脂酶的最佳条件为水与无水乙醇的比例为1∶1(v/v),Span65的用量为20%;Span60、Span80和Span85修饰脂肪酶的最佳条件是水与无水乙醇的比例为3∶1(v/v),用量均为20%。通过修饰后酶的热稳定性实验可以看出,六种表面活性剂修饰的酶在30~70℃间催化反活性都高于未修饰酶,在40℃下,修饰酶的催化活性基本达到最高,而未修饰酶要70℃才能达到最高催化活性。Span60修饰脂肪酶的效果优于其它五种表面活性剂。
猪胰脂酶,Span,修饰,乙醇溶液
1 材料与方法
1.1 材料与仪器
猪胰脂酶 购于Novo公司;茶油 购于河南信阳长园野生茶油有限公司;棕榈酸、Span表面活性剂购于Sigma公司;其他化学试剂 均购于天津市科密欧化学试剂有限公司,色谱纯。
气相色谱仪 Agilent6890N,美国Agilent公司;色谱柱 BPX-70(30.0m×250μm×0.25μm),澳大利亚SGE公司。
1.2 实验方法
1.2.1 猪胰脂酶的修饰

1.2.2 修饰前后脂肪酶促酯交换反应催化活性的测定 称取3g茶油于50mL烧瓶中,加入一定量棕榈酸,反应底物比为棕榈酸∶茶油=2∶1(mol/mol),加入脂肪酶为茶油重的15%(m/m),加入异辛烷30mL,体系含水量为体系总重的0.5%,在40℃下搅拌反应4h。分离混合物中的甘三酯,进气相分析脂肪酸组成。以4h后的酯交换量来评价脂肪酶修饰前后的催化活性。催化活性(酯交换反应的交换量) =产物甘三酯中棕榈酸的百分含量-原料茶油中棕榈酸的百分含量。
1.2.3 甘三酯脂肪酸组成分析 将0.5mL反应产物溶解于1.0mL石油醚中,然后进行薄层层析(吸附剂为硅胶G,展开剂为石油醚-无水乙醚-甲酸混合物,石油醚∶无水乙醚∶甲酸=70∶30∶1,v/v/v),再将薄层板置于通风橱中晾干,并将2,7-二氯荧光素均匀地喷在薄层板上,晾干后放于紫外分析仪上观察并刮下甘三酯谱带[7]。
将从薄层板上刮下的甘三酯谱带(甘三酯与硅胶的混合物)溶于 2.5mL正己烷中,加入 1mL 0.5mol/L甲醇钠溶液,室温下轻摇5min,然后加入少量无水硫酸钠,静置1h后,于2000~3000r/min离心2~3min,取上清液用于GC分析[7]。
原料茶油及酶催化反应产物甘三酯脂肪酸组成分析条件:气相色谱仪:Agilent6890N;色谱柱:BPX-70 (30.0m×250μm×0.25μm);进样口温度:230℃;柱温: 180℃;检测器温度:300℃;氮气流速:1.5mL/min。
2 结果与讨论
2.1 水与无水乙醇的比例对修饰效果的影响
无水乙醇与水的比例对修饰效果的影响见图1。就Span20修饰猪胰脂酶的效果而言,催化活性随无水乙醇用量的减小先增加后减小,水与无水乙醇的比例为4∶1(v/v)时猪胰脂酶的催化活性达到极大值;用Span40修饰猪胰脂酶时,催化活性随无水乙醇用量的减小先增加后减小,水与无水乙醇的比例为2∶1(v/v)时猪胰脂酶的催化活性达到极大值;用Span60修饰猪胰脂酶时,其活性随乙醇用量的减小而逐渐增加,水与无水乙醇的比例大于3∶1(v/v)以后,猪胰脂酶的催化活性较高并趋于稳定;用Span65修饰猪胰脂酶时,催化活性随无水乙醇用量的减小先增加后减小,水与无水乙醇的比例为1∶1(v/v)时猪胰脂酶的催化活性达到极大值;用 Span80和Span85修饰猪胰脂酶时,催化活性随无水乙醇用量的减小先增加后减小,水与无水乙醇的比例为3∶1 (v/v)时猪胰脂酶的催化活性达到极大值。Kamiya等[8]研究表面活性剂修饰过程中采用缓冲溶液/乙醇(v/v)混合体系,在乙醇体积占总体积的0%~20%时,对修饰酶活性略有提高,混合体系可以提高表面活性的分散性,而且还可以改变酶的溶解性。
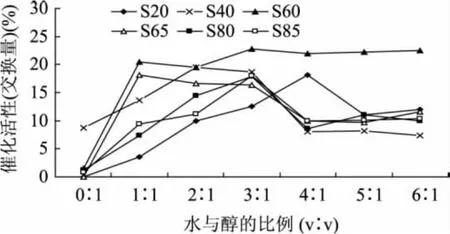
图1 水与无水乙醇的比例对猪胰脂酶修饰效果的影响注:搅拌时间:30min;Span用量:25%(Span占猪胰脂酶与Span总量的质量百分数);温度:40℃。
2.2 Span用量对修饰效果的影响
Span占Span和酶总重的百分比对修饰酶催化反应活性的影响见图2。由图可以看出,对于Span40、65、80和85来说,在用量为20%时修饰效果达到最佳,增加Span的用量对酶的修饰并没有很大的影响;Span60在用量为20%修饰效果最佳,随后增大用量,修饰效果略有下降;Span20最佳的修饰用量为25%。较低和较高的Span用量都会降低对猪胰脂酶的修饰效果。Thakar等[9]研究发现,修饰过程中表面活性剂的种类和用量对修饰酶催化酯交换反应有重要的影响,非离子型表面活性剂修饰效果比阳离子型的效果好,阴离子型表面活性剂会抑制修饰酶活力,修饰过程中较低的表面活性剂用量能显著提高修饰酶的活性。
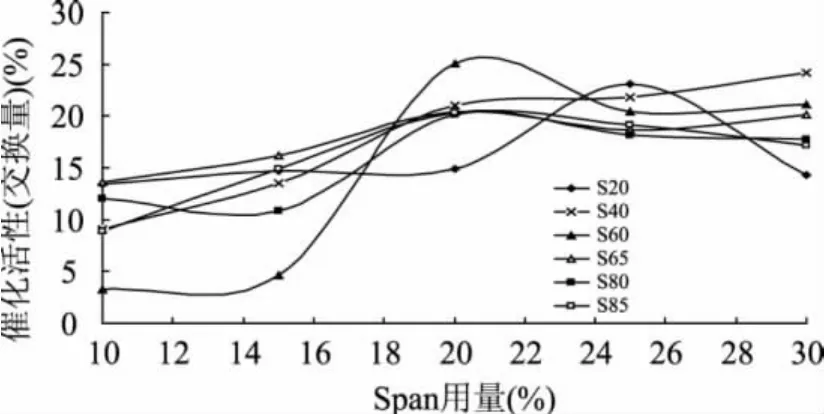
图2 Span用量对猪胰脂酶修饰效果的影响
2.3 搅拌时间对修饰效果的影响
由图3可以看出,对于六种表面活性剂修饰的猪胰脂酶,在搅拌时间为30min时,催化酯交换的催化活性最高,随着搅拌时间的增加,催化酯交换的催化活性略有下降,Span65修饰的猪胰脂酶最为明显。由此可见,对于六种表面活性剂来说,修饰最佳的搅拌时间为30min,较长或者较短的搅拌时间,都会降低酶催化酯交换反应的催化活性。

图3 搅拌时间对猪胰脂酶修饰效果的影响
2.4 脂肪酶热稳定性
对六种表面活性剂修饰酶的热稳定性进行了研究,主要研究了在30、40、50、60、70、80℃下修饰酶催化酯交换的反应,并用未修饰酶在相同温度下反应进行比较,实验结果见图4。

图4 修饰酶与未修饰酶的热稳定性
由图4可以看出,六种表面活性剂修饰的酶,在30~70℃间,催化活性都高于未修饰酶,是未修饰脂肪酶的1.5~2倍;在40℃时催化活性基本达到最高,40~70℃间的催化活性基本不变,未修饰酶在70℃时催化活性才能达到最高。80℃时修饰酶和未修饰酶的催化活性均急速下降,高温导致酶失活的缘故; Span60修饰的脂肪酶在相同温度下的催化活性均高于其它五种。
3 结论
在乙醇-水溶液体系中采用Span系列表面活性剂对猪胰脂酶进行修饰,以催化酯交换反应的交换量为指标,研究修饰条件对猪胰脂酶修饰效果的影响。研究发现:40℃下30min即可完成Span对猪胰脂酶的修饰,但各种表面活性剂修饰的最佳条件并不相同。Span20修饰脂肪酶的最佳条件是水与乙醇的比例为4∶1(v/v),Span20用量为25%;Span40修饰猪胰脂酶的最佳条件是水与无水乙醇的比例为2∶1 (v/v),Span40用量为20%;Span65修饰猪胰脂酶的最佳条件为水与无水乙醇的比例为1∶1(v/v),Span65的用量为20%;Span60、Span80和Span85修饰脂肪酶的最佳条件是水与无水乙醇的比例为3∶1 (v/v),用量均为20%。通过修饰后酶的热稳定性实验可以看出,六种表面活性剂修饰的酶,在30~70℃间催化活性都高于未修饰酶,在40℃下,修饰酶的催化活性基本达到最高,而未修饰酶要在70℃才能达到最高催化活性。Span60修饰脂肪酶的效果优于其它五种表面活性剂。
[1]郭挣,张根旺.脂肪酶的结构特征和化学修饰[J].中国油脂,2003,28(7):5-10.
[2]Brockerhoff H,Jensen R G.Lipolytic Enzymes[M].Academic Press,New York,1874:25-90.
[3]欧志敏,周晓云,柳彩波.逆胶束系统中脂肪酶的催化[J].天津轻工业学院学报,2000,15(4):21-26.
[4]赵玮,袁均林,杨旭,等.吐温修饰脂肪酶的研究[J].化学与生物工程,2005,22(10):14-16.
[5]Banu Babali,H Ayse Aksoy,Melek Tuter,et al.Enzymatic esterification of(-)-menthol with lauric acid in isooctane by sorbitan monostearate-coated lipase from Candida rugosa[J].J Am Oil Chem Soc,2001,78(2):173-175.
[6]Basheer S,Nakajima M,Cogan U.Sugar ester-modified lipase for the esterification of fatty acids and long-chain alcohols[J].J Am Oil Chem Soc,1996,73(11):1475-1479.
[7]孙晓洋.脂肪酶催化茶油酯交换制备类可可脂的研究[D].河南工业大学,2008.
[8]Kamiya N,Murakami E,Goto M,et al.Effect of using a Co-Solvent in the preparation of surfactant-coated lipases on catalytic activity in organic media[J].J Ferment Bioeng,1996,82 (1):37-41.
[9]Thakar A,Madamwar D.Enhanced ethyl butyrate production by surfactant coated lipase immobilized on silica[J].Proc Biochem,2005,40(10):3263-3266.
Modification of porcine pancreas lipase by Span in ethanol solution
ZENG Jun,YANG Guo-long*,BI Yan-lan,ZHANG Jie,SUN Shang-de
(School of Food Science and Engineering,Henan University of Technology,Zhengzhou 450052,China)
The porcine pancreas lipase was modified by Span in the ethanol-water solution,the effectiveness of the modification of the porcine pancreas lipase was determined by incorporation of interesterification of oils catalyzed by them,and the thermal stability of the modified lipase and the original lipase were investigated.The results indicated that the modification was finished for 30min at 40℃,however the optimum conditions for Span were different.For Span20,the optimum conditions were the ratio of water to ethanol 4∶1(v/v),the amount of Span20 25%.For Span40,the optimum conditions were the ratio of water to ethanol 2∶1(v/v),the amount of Span40 20%. For Span65,the optimum conditions were the ratio of water to ethanol 1∶1(v/v),the amount of Span65 20%.For Span60,Span80 and Span85,the optimum conditions were the ratio of water to ethanol 3∶1(v/v),the amount of them 20%.The the catalytic activity of the modified lipase was increased comparison to that of the native lipase in the rang of 30~70℃,the modified lipases showed the better catalytic activity in the range of 40~70℃,while the native lipases showed the better catalytic activity at 70℃.The modification effectiveness of Span60 was better than those of others.
porcine pancreas lipase;Span;modification;ethanol solution
TS201.2+5
A
1002-0306(2011)09-0187-03
脂肪酶除了能催化甘油酯类化合物的水解和合成之外,还可以催化酯交换反应、多肽合成和药物的合成等,尤其是利用脂肪酶的立体专一性催化合成一些特殊结构的物质,因而脂肪酶在食品、日用化学、油脂化学以及药物合成等许多领域有广泛的应用[1]。脂肪酶广泛存在于原核生物和真核生物中,按其来源可分为三种:动物酶、植物酶和微生物酶[2]。脂肪酶催化的反应是一种界面反应,脂肪酶的结构特性和其在界面上的分布状态决定催化活性[3]。脂肪酶通过化学修饰后,改变了脂肪酶的表面特性,使底物和脂肪酶更容易发生接触,从而提高反应速率[4]。Banu Babali等[5]研究在水溶液体系中采用Span 60修饰脂肪酶,修饰后的脂肪酶在异辛烷体系中催化薄荷醇与月桂酸的酯化反应,修饰酶催化反应1h后酯化率81%,4h后达94%,而未修饰酶在72h后才达到93%。Sobhi Basheer等[6]研究采用糖酯修饰的脂肪酶在正己烷体系中催化脂肪醇和长碳链脂肪酸的酯化反应,与未修饰酶相比,修饰脂肪酶能提高反应速率。从化学结构上来看,失水山梨醇脂肪酸酯(Span系列)是多元醇的部分脂肪酸酯,它属于非离子表面活性剂,是一种优良的油包水或水包油型表面活性剂,广泛地用在食品、化妆品和医药等精细化工领域。本文研究在醇溶液体系中采用Span系列表面活性剂修饰猪胰脂酶,S20、S40、S60、S65、S80和 S85分别代表 Span20、Span40、Span60、 Span65、Span80和Span85,探讨了最佳的修饰条件和修饰条件对修饰效果的影响。
2010-10-11 *通讯联系人
曾俊(1985-),男,硕士研究生,研究方向:油脂化学。
国家自然科学基金项目(31071558);河南工业大学校科研基金(08XZZ027)。
