猴头菌发酵刺五加后多糖与紫丁香苷的含量变化研究
2011-11-02陈丽艳王伟明
陈丽艳,金 爽,张 迎,李 月,王伟明
(黑龙江省中医研究院,黑龙江哈尔滨150036)
猴头菌发酵刺五加后多糖与紫丁香苷的含量变化研究
陈丽艳,金 爽,张 迎,李 月,王伟明*
(黑龙江省中医研究院,黑龙江哈尔滨150036)
研究猴头菌发酵刺五加后多糖及紫丁香苷的含量变化,为新药源开发提供理论依据。以蒽酮-硫酸法测定猴头菌发酵刺五加前后多糖的含量,并采用高效液相色谱法对发酵前后紫丁香苷的含量进行检测。结果显示,猴头菌发酵刺五加后多糖的质量分数由发酵前的0.3%提高到0.7%,多糖的含量提高了133%;而刺五加原药材中紫丁香苷的含量为0.0096%,发酵后在紫丁香苷标准峰对应处未出峰,而是在其它位置出现了三个新的谱带。猴头菌发酵刺五加后多糖含量显著提高,可以起到协同或增加猴头菌及刺五加药效的作用;发酵物中紫丁香苷成分未检出,是由于发酵后紫丁香苷在微生物酶的作用下降解转化为其它物质,有利于提高生物利用度,为新药源的开发奠定了基础。
猴头菌,刺五加,发酵,多糖,紫丁香苷
1 材料与方法
1.1 材料与设备
紫丁香苷标准品 购于中国药品生物制品检定所,批号111574-200502,规格20mg;葡萄糖对照品购于中国药品生物制品检定所,批号110833-200503;其他试剂 均为色谱纯或分析纯;猴头菌 购于黑龙江省微生物研究所,菌种名称猴头菌(Hericium erinaceus),编号8415;刺五加 购于黑龙江省药材公司,经黑龙江省中医研究院付克志研究员鉴定为Acanthopanax senticosus(Rupr.etMaxim.)Harms。
UV2550紫外-可见分光光度计 上海第三分析仪器厂;KQ-300DB型数控超声波清洗器 昆山市超声仪器郁良公司;FA1104分析天平 上海天平仪器厂;KE·WEI电热恒温水浴锅 北京科伟永新实验仪器设备厂;PH140A型培养干燥箱 上海一恒科技有限公司;SHB-IIIA循环水式多用真空泵 郑州长城科工贸有限公司;YS-280B手提式不锈钢蒸汽消毒器 上海三申医疗器械有限公司;AF-20A密封型摇摆式中药粉碎机 温岭市奥力中药机械有限公司;SSI型高效液相色谱仪 天津市兰博实验仪器设备有限公司;Diamonsil C18色谱柱(4.6mm×250mm,5μm) 中国迪马公司。
1.2 发酵菌质的制备
以猴头菌为发酵菌种,CPDA培养基进行培养传代,以刺五加为药性基质加入麸皮15%,碳酸钙1%,硫酸钙1%及药材总重1.5倍体积的蒸馏水浸泡12h作为发酵培养基。传代后的菌液接种于高压灭菌后的发酵培养基上,28℃恒温培养40d。发酵好的药性菌质先自然干燥,再于40℃烘干,粉碎备用。
1.3 多糖含量测定
1.3.1 样品多糖提取 取刺五加原药材及刺五加发酵样品各100g,按照固液比1∶10的比例加水于80℃水浴浸提两次,每次4h,合并滤液并浓缩至100mL,冷却后加乙醇至浓度为30%,静置过夜,真空抽滤,弃去滤渣。滤液加乙醇至浓度为80%,操作同上,用无水乙醇冲洗滤渣至粉末状,干燥至恒重,即为多糖。
1.3.2 刺五加未加菌发酵培养基对照样品的多糖提取 刺五加中加入1.5倍体积蒸馏水浸泡12h,并加入麸皮15%,碳酸钙1%,硫酸钙1%,灭菌后不接种猴头菌,在相同条件下进行发酵处理,作为对照,同样称取100g,同法提取多糖。
1.3.3 蒽酮硫酸法方法学考察
1.3.3.1 线性关系考察 精密称取干燥至恒重的无水葡萄糖对照品20mg,加蒸馏水溶解定容至100mL,配成0.2g/L的葡糖糖标准液。再精密吸取标准液1、2、3、4、5mL置于10mL容量瓶中,以蒸馏水定容摇匀,得系列对照品溶液。称取0.2g蒽酮,加100mL浓硫酸,置于棕色瓶中,混合摇匀置于冰箱中(现配现用)。
精密吸取上述系列对照品溶液1.0mL,置于10mL具塞试管中,将试管置于冰水中,分别向试管中加入0.2%蒽酮-硫酸溶液4mL,待各管加完后同时摇匀,沸水浴中准确加热10min,取出用冷水迅速冷却至室温,放置10min,于620nm处测定吸光度。另精密吸取蒸馏水1.0mL,同法操作,作为空白对照。以吸光度值为横坐标,浓度为纵坐标,绘制标准曲线。
1.3.3.2 精密度、重现性、显色稳定性和加样回收率实验 取葡萄糖对照品溶液,连续测定5次,进行精密度实验;精密称取同批样品粉末5份,按照样品中多糖提取步骤提取样品溶液,精密吸取样品溶液各1.0mL,分别置于10mL具塞试管中,进行重现性实验;精密吸取制得的某一样品溶液1.0mL,分别在显色后0、10、20、40、60、80、100、120min测定吸光度,进行显色稳定性实验;精密称取已知含量的同批5份样品,精密加入一定量的葡萄糖对照品,进行加样回收率实验,计算回收率。
1.3.4 多糖含量测定
1.3.4.1 样品溶液制备 分别取刺五加原药材,刺五加发酵物及刺五加未加菌发酵培养基对照提取的3种多糖样品各12mg,精密称定,加蒸馏水定容至100mL量瓶中,以蒽酮-硫酸法[9]测定含量,实验平行3次。
1.3.4.2 多糖含量测定 精密吸取1.3.4.1制得的样品溶液各1.0mL于具塞试管中,按1.3.3的方法测定吸光度,由回归方程计算供试液中葡萄糖浓度。多糖含量(%)=CD/W×100%
其中:C:样品溶液中葡萄糖的浓度(g/L);D:样品溶液的稀释倍数;W:样品重量(g)。
1.4 紫丁香苷含量的测定[10-11]
1.4.1 色谱条件 色谱柱:Diamonsil C18(4.6mm× 250mm,5μm);流动相:乙腈-水(10∶90);柱温:室温;紫外检测波长265nm,流速0.08mL/min,进样量10μL。
1.4.2 对照品溶液制备 精密称取紫丁香苷1mg置于10mL容量瓶中,以甲醇溶解稀释至刻度,摇匀得浓度0.10g/L紫丁香苷对照品溶液。
1.4.3 供试品溶液制备 分别精密称取刺五加原药材,刺五加发酵物,刺五加未加菌发酵培养基对照及麸皮15%、碳酸钙1%、硫酸钙1%混合物的粉末各约2g,精密加入甲醇20mL,称重,记录重量,浸12h后,超声处理(250kw,36kHz)30min,静置至室温,补足重量,过滤后取续滤液备用。
1.4.4 方法学考察
1.4.4.1 线性关系考察 取紫丁香苷对照品溶液(0.10g/L)。分别精密吸取对照品溶液0.5、1、1.5、2、2.5mL溶于10mL容量瓶中,分别进样10μL。按上述色谱条件测定峰面积。以紫丁香苷进样量Y为纵坐标、峰面积X为横坐标绘制标准曲线。
1.4.4.2 精密度、重复性和回收率实验 精密吸取紫丁香苷对照品溶液(0.10g/L)10μL,重复进样5次,测定紫丁香苷峰面积,进行精密度实验;取刺五加原药材样品溶液,平行5次取样,制备供试品溶液,进行重复性实验;采取加样回收法,取已知质量分数(含紫丁香苷为0.096mg/g)刺五加原药材样品约1.0g,精密加入紫丁香苷对照品溶液(0.10g/L) 1.0mL,制备供试品溶液,计算回收率。
2 结果与讨论
2.1 多糖含量测定
2.1.1 方法学考察 如图1所示,在20~100μg范围内葡萄糖的含量与吸光度呈良好线性关系。且本方法精密度和重现性良好,RSD值分别为0.67%和2.67%。显色稳定性结果显示该样品在20~120min内吸收值基本稳定。平均回收率为97.52%,RSD为2.55%,回收率较好。各项结果均表明本方法可行。
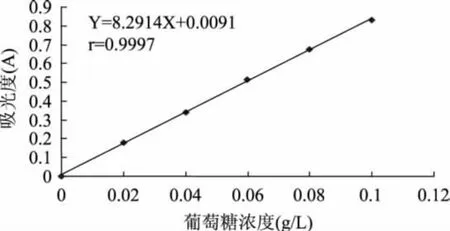
图1 葡萄糖标准曲线
2.1.2 多糖含量测定结果 刺五加原药材、刺五加发酵物及刺五加未加菌发酵培养基对照提取的3种多糖样品含量测定结果见图2,结果显示刺五加经猴头菌发酵后多糖质量分数由原药材的0.30%提高到0.70%,刺五加未加菌发酵培养基对照中,多糖质量分数0.39%,发酵后多糖的含量提高了133%。
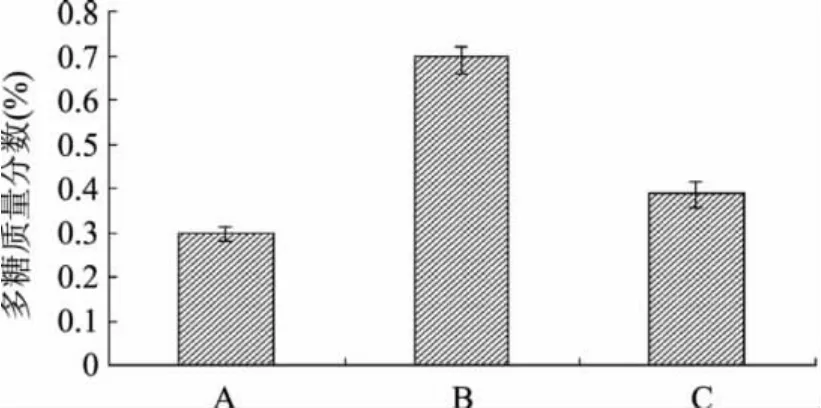
图2 刺五加发酵前后多糖质量分数
猴头菌发酵刺五加后多糖质量分数显著增加,一方面由于刺五加属木质类,经发酵后猴头菌产生的酶系能够使木质素和纤维素等刺五加细胞壁组成成分降解,产生大量多糖;另一方面猴头菌在刺五加药性基质生长旺盛时也会产生大量的多糖。
2.2 紫丁香苷含量测定
2.2.1 方法学考察 经计算得回归方程为Y= 5.09535×107X-0.312986,r=0.9997,表明紫丁香苷在0.05~0.25μg与峰面积具有良好的线性关系。且精密度、重复性良好,RSD值分别为1.18%和1.90%,平均回收率为98.54%,RSD 2.12%(n=5),表明此方法可行,能够满足定量分析的要求。
2.2.2 紫丁香苷含量测定结果 在确定的色谱条件下,分别测定刺五加原药材,刺五加发酵物,刺五加未加菌发酵培养基对照及麸皮、碳酸钙、硫酸钙混合物中紫丁香苷含量,进样量10μL。由表1可知,刺五加原药材紫丁香苷含量0.0096%,刺五加发酵后紫丁香苷未检出,刺五加未加菌发酵培养基对照紫丁香苷含量0.0025%,麸皮、碳酸钙、硫酸钙混合物中紫丁香苷峰谱对应处没有干扰;如图3所示。
将刺五加发酵前后HPLC图按保留时间分为a(0~5min),b(5~10min),c(10~15min),d(15~20min),e(20~25min)五个保留时间区。由表2可见,a1、a2、a3、a4、b2在刺五加未加菌发酵培养基对照(C)及麸皮、碳酸钙、硫酸钙混合物(D)中均出现,说明这四条谱带为来自麸皮、碳酸钙、硫酸钙的混合物;刺五加发酵物(B)中a4、b3、d1三条谱带全部消失,而产生了a5、b5、e1三条新谱带。
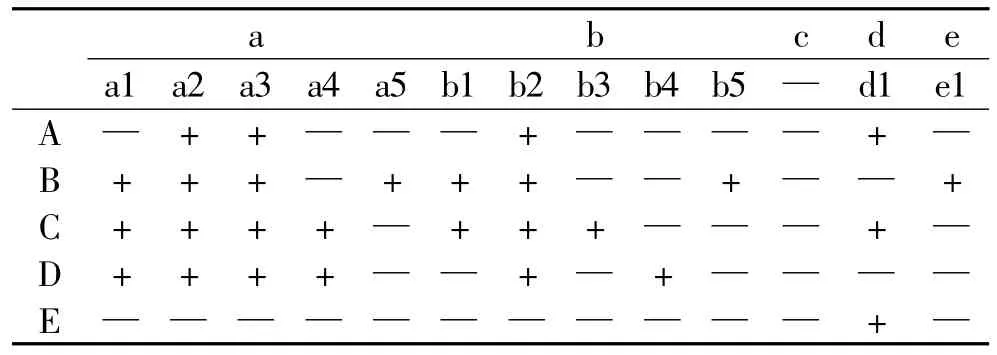
表2 刺五加发酵前后HPLC出峰的结果
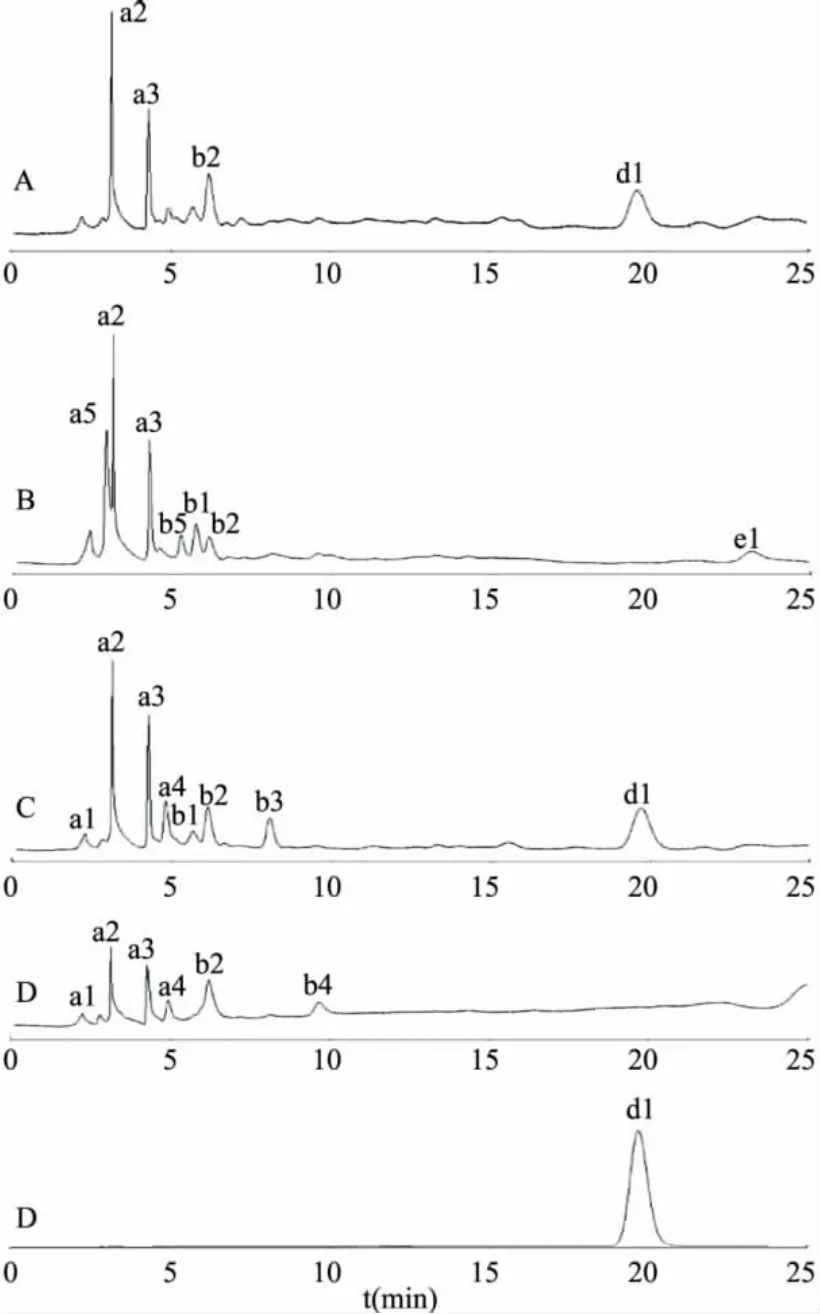
图3 刺五加发酵前后HPLC图
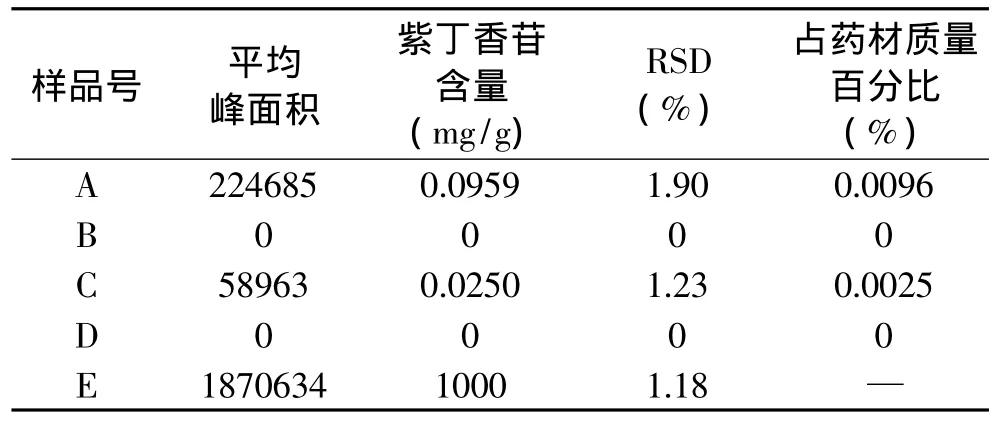
表1 紫丁香苷含量检测结果(n=5)
3 结论
刺五加经猴头菌发酵后多糖的含量显著提高,有利于提高其生物活性及利用度;刺五加中的紫丁香苷被猴头菌发酵转化后,含量显著减少,表明已被猴头菌分解转化。发酵后的高效液相图谱中新生成了三条新谱带,这三种物质将进一步通过液质联用及核磁技术进行检测。
[1]张晶,刘芳芳,陈彦池,等.刺五加化学成分及药理学研究进展[J].中国野生植物资源,2008,27(3):6-10.
[2]徐萌萌,王建芳,徐春,等.微生物转化苷类中药的机理及应用[J].世界科学技术,2006,24(8):2-6.
[3]葛喜珍.发酵在中药研究中的应用[J].时珍国医国药,2008,19(10):386-387.
[4]吴志勇.发酵中药-现代生物技术与传统中药配方的结合[J].现代中医药,2003,2(12):22-25.
[5]Lin QY,Jin LJ,Cao ZH,et al.Inhibition of induciblenitric oxide synthase by Acanthopanax senticosus extract in RAW264.7 macrophages[J].J Ethnopharmacol,2008,118(14):231-236.
[6]Yamada M,Tanabe F,Arai N,et al.Bioavailability of glucosyl hesperidins in rats[J].Biosci Biotechnol Biochem,2006,70 (11):1386-1394.
[7]Demain AL,Adrio JL.Contributions of microorganisms to industrial biology[J].Mol Biotechnol,2008,38(10):41-45.
[8]庄毅,池玉梅,陈慎宝,等.药用真菌新型固体发酵工程与槐芪菌质的研制[J].中国药学杂志,2004,39(3):175-176.
[9]王黎明,夏文水.蒽酮-硫酸法测定茶多糖含量的研究[J].食品科学,2005,26(7):185-188.
[10]刘建华,吕宁,文娟.高效液相色谱法测定刺五加中丁香苷的含量[J].时珍国医国药,2006,17(4):960-962.
[11]李辰,王晓燕,胡绪玮,等.刺五加抗疲劳活性部位中刺五加苷B的含量测定[J].中国中药杂志,2008,33(23):2801 -2802.
The content analysis of the crude polysaccharides and syringin in Acanthopanax senticosus fermented by Hericium erinaceus
CHEN Li-yan,JIN Shuang,ZHANG Ying,LI Yue,WANG Wei-ming*
(Heilongjiang Academy of Traditional Chinese Medicine,Harbin 150036,China)
To study the content of the crude polysaccharides and syringin in Acanthopanax senticosus fermented by Hericium erinaceus,and it would be offer the theoretical basis for developing the new resources of Traditional Chinese Medicine.The content of the crude polysaccharides and syringin in Acanthopanax senticosus before and after fermentation were determined by anthrone-sulphuric acid and HPLC methods,respectively.The results showed that the mass percentage of crude polysaccharides in the raw material was 0.3%,and it rose to 0.7%after fermented.The content of syringin in the raw material was 0.0096%,the peak was disappeared at the same retention time of syringin after fermented,and three new peaks were found.The content of crude polysaccharides in the fermented products of Acanthopanax senticosus was increased significantly,and the pharmacological effect may be stronger than before;syringin was disappeared in the fermented products of Acanthopanax senticosus,the reason may be that syringin has been transformed to other components with the efforts of microbiology enzymes. It was propitious to raise bioavailability and establishes a research foundation for the new Traditional Chinese Medicine resource development in the future.
Acanthopanax senticosus;Hericium erinaceus;fermentation;polysaccharides;syringin
TS201.3
A
1002-0306(2011)09-0184-04
猴头菌(Hericium erinaceus)隶属于担子菌门、猴头菌科,为药食兼用真菌,具有助消化、降血糖及抗氧化等药理活性,其有效成分为多糖。刺五加为五加科,五加属植物刺五加 Acanthopanax senticosus (Rupr.etMaxim.)Harms的干燥根茎[1],具有提高免疫力、抗疲劳、抗肿瘤等药理活性,其有效成分为多糖和苷类[2]。双向发酵技术使药物经体外微生物大量酶系分解转化[3-4],可提高药效及有效成分提取率,产生新药效,并为药物活性成分结构修饰提供了新途径[5-7]。研究采用双向发酵技术[8],用猴头菌发酵中药刺五加,实现苷类成分在体外转化为苷元,以利于人体吸收;多糖含量提高有利于药效的增强。实验采用高效液相色谱法对发酵物中紫丁香苷含量进行对比分析,并利用蒽酮-硫酸法对其多糖含量进行检测。
2010-09-14 *通讯联系人
陈丽艳(1971-),女,副主任药师,从事中药研究及开发。
十一五国家科技支撑计划(2006BAI06A20-11)。
